Гиперактивный мочевой пузырь (ГМП) (представляет собой особую проблему, которая сопровождается значительным снижением качества жизни больных, в то же время приводит к существенным социально-экономическим потерям. Это синдром, объединящий ряд симптомов, таких как ургентность, или повелительные позывы к мочеиспусканию, в сочетании или без ургентного недержания мочи, а также учащенное мочеиспускание и ноктурия [1]. Проблема ГМП затрагивает различные группы населения. Распространенность симптомов с возрастом увеличивается и достигает 30–50% у лиц старше 65 лет [2]. У многих пожилых пациентов, страдающих симптомами ГМП, имеют место сопутствующие заболевания, делающие затруднительным применение м-холиноблокаторов, например, такие как миастении, запоры, закрытоугольная глаукома или когнитивные расстройства.
Приверженность пациентов к терапии ГМП
К основным методам лечения гиперактивного мочевого пузыря относятся поведенческая терапия (удлинение интервалов между мочеиспусканиями, регулирование объема потребляемой жидкости и упражнения для укрепления мышц тазового дна), медикаментозная терапия препаратами, относящимися к группе м-холинолитиков, β3-адреномиметиками, а также внутрипузырное введение ботулинического токсина. Применение м-холинолитиков не всегда достаточно эффективно для фармакотерапии ГМП, это связано с возникновением специфических осложнений вследствие селективности препаратов к подтипам мускариновых рецепторов в других органах. Сухость во рту, запоры, повышение внутриглазного давления и другие побочные явления наряду с недостаточной эффективностью приводят к отказу больных от продолжения приема препаратов [3, 4] (табл. 1). Также, согласно данным исследования Wagg и соавт. [5], пожилым пациентам при смене препаратов холинергического ряда не удается повысить эффективность и переносимость последних.
Многочисленные исследования, направленные на изучение патофизиологии гиперактивного мочевого пузыря, привели к разработке и созданию новой группы фармакологических препаратов – β3-адреномиметиков, способствующих расслаблению мочевого пузыря.
Мирабегрон является новым первым в своем классе препаратом для лечения ГМП.

Первые исследования по применению β-адрено-миметиков были начаты в 1980-х гг. для тербуталина и кленбутерола [8, 9]. В 2007 г. японскими учеными был разработан селективный β3-адреномиметик – мирабегрон [10]. Клинические исследования, организованные и проведенные в Японии, доказали эффективность препарата и создали возможность для вывода лекарства на местный фармакологический рынок в 2011 г. Ровно через год после этого мирабегрон был разрешен к применению в США и годом позже препарат был представлен в Европе [11]. В России препарат мирабегрон зарегистрирован и используется с 2014 г., а отечественные клиники также участвуют в многоцентровых рандомизированных исследованиях по изучению особенностей приема данного препарата.
Мирабегрон – первый доступный β3-адре-номиметик, который имеет механизм действия, отличающийся от холинергических препаратов. В организме человека существуют три подтипа β-адренорецепторов. В мочевом пузыре β3-адренорецепторы составляют порядка 97% от всех β-адренорецепторов и считаются основным подтипом, влияющим на расслабление детрузора во время фазы накопления. Рецепторы, расположенные в гладко-мышечных волокнах служат основной мишенью воздействия мирабегрона, однако описано и прямое воздействие препарата на уротелий мочевого пузыря [6]. Возможен еще один механизм действия мирабегрона: так, по данным Kanai и соавт., β3-адреномиметики у животных с моделированной спинальной травмой непосредственно устраняют активацию чувствительных нервов [7].
 Многочисленные работы были направлены на изучение фармакокинетики мирабегрона. Поиск оптимальной дозы мирабегрона проводился в клиническом европейском мультицентровом исследовании DRAGON, которое длилось в течение 12 недель. В исследование были включены 919 больных, распределенных в 5 групп: плацебо, мирабегрон 25 мг, 50, 100 и 200 мг. Исследование показало, что эффективность доз 50 мг, 100 и 200 мг незначительно отличаются друг от друга [12]. Стандартной на сегодняшний день схемой приема препарата мирабегрон является дозировка 50 мгх1 раз в день (перорально). Максимальная концентрация препарата в крови достигается через 3–4 ч с момента приема. Абсолютная биодоступность составляет 29% для 25 мг и 35% для 50 мг. Биодоступность мирабегрона у женщин превышает таковую у мужчин на 40–50%. В исследованиях Takusagawa и соавт. говорится об особенностях абсорбции и выведении препарата из организма [13]. При использовании радиомеченого мирабегрона в дозе 160 мг отмечено два пика концентрации препарата – через 0,5–1 и через 2–4 ч от начала приема. Расчеты показали, что не менее 55% препарата абсорбировались в кишечнике. Далее мирабегрон выводился через мочу и кал в практически неизмененном виде. Лишь небольшое количество препарата преобразовывалось в 10 метаболитов, обнаруженных в моче. Восемь из 10 метаболитов определялись и в плазме, в основном являясь глюкуронидами, составив от 11 до 16% от общей концентрации препарата. Эти метаболиты не обладают фармакологической активностью. С учетом особенностей формирования метаболитов мирабегрона вероятность межлекарственного взаимодействия невысока, что важно при использовании препарата пожилыми с отягощенным соматическим статусом, которые принимают массу различных лекарственных препаратов. В исследовании van Gelderen и соавт. была продемонстрирована разница в фармакокинетике метаболитов, связанная с полиморфизмом цитохрома-Р450, однако существенного клинического значения это не имело [14].
Многочисленные работы были направлены на изучение фармакокинетики мирабегрона. Поиск оптимальной дозы мирабегрона проводился в клиническом европейском мультицентровом исследовании DRAGON, которое длилось в течение 12 недель. В исследование были включены 919 больных, распределенных в 5 групп: плацебо, мирабегрон 25 мг, 50, 100 и 200 мг. Исследование показало, что эффективность доз 50 мг, 100 и 200 мг незначительно отличаются друг от друга [12]. Стандартной на сегодняшний день схемой приема препарата мирабегрон является дозировка 50 мгх1 раз в день (перорально). Максимальная концентрация препарата в крови достигается через 3–4 ч с момента приема. Абсолютная биодоступность составляет 29% для 25 мг и 35% для 50 мг. Биодоступность мирабегрона у женщин превышает таковую у мужчин на 40–50%. В исследованиях Takusagawa и соавт. говорится об особенностях абсорбции и выведении препарата из организма [13]. При использовании радиомеченого мирабегрона в дозе 160 мг отмечено два пика концентрации препарата – через 0,5–1 и через 2–4 ч от начала приема. Расчеты показали, что не менее 55% препарата абсорбировались в кишечнике. Далее мирабегрон выводился через мочу и кал в практически неизмененном виде. Лишь небольшое количество препарата преобразовывалось в 10 метаболитов, обнаруженных в моче. Восемь из 10 метаболитов определялись и в плазме, в основном являясь глюкуронидами, составив от 11 до 16% от общей концентрации препарата. Эти метаболиты не обладают фармакологической активностью. С учетом особенностей формирования метаболитов мирабегрона вероятность межлекарственного взаимодействия невысока, что важно при использовании препарата пожилыми с отягощенным соматическим статусом, которые принимают массу различных лекарственных препаратов. В исследовании van Gelderen и соавт. была продемонстрирована разница в фармакокинетике метаболитов, связанная с полиморфизмом цитохрома-Р450, однако существенного клинического значения это не имело [14].
Существуют ограниченные данные по применению мирабегрона пациентами с почечной и печеночной недостаточностью: этой группе пациентов рекомендовано применение формы с дозой 25 мг.
Применение мирабегрона после терапии холинолитиками
После изучения механизмов действия и фармакокинетических особенностей мирабегрона ряд клинических исследований был направлен на сравнение эффективности и безопасности мирабегрона и различных препаратов группы м-холинолитиков. В 2012 г. в клиническом исследовании SCORPIO произведена сравнительная характеристика эффективности мирабегрона и толтеродина с медленным высвобождением. Это одно из самых крупных исследований, включивших 1978 больных гиперактивным мочевым пузырем из Европы и Австралии. Пациенты были разделены на 4 группы в зависимости от применяемого препарата: плацебо (494 больных), мирабегрон 50 мг (493 больных), 100 мг (496 пациентов) и толтеродин медленного высвобождения 4 мг (495 больных), исследование продолжалось в течение 12 нед. Больные, получавшие мирабегрон, отметили значительное улучшение симптоматики, однако преимущества β3-адреномиметика не достигли статистической значимости над эффектом толтеродина медленного высвобождения [15]. Но это исследование позволило сделать выводы, согласно которому мирабегрон оказался весьма эффективным для больных, ранее получавших холинолитики и прекративших их прием по причине недостаточного действия или выраженных побочных реакций. В работе Takasu и соавт. также показано преимущество мирабегрона, не приводившего к нарушениям опорожнения мочевого пузыря, в отличие от холинолитиков, которые могут приводить к увеличению объема остаточной мочи [10].

Комбинация мирабегрона с холинолитиком для первичных больных
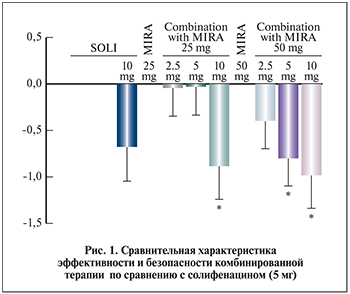
В 2015 г. было проведено рандомизированное двойное слепое плацебо-контролируемое клиническое исследование Symphony [24]. Коллектив авторов во главе с P. Abrams впервые изучали возможность комбинированного лечения пациентов с ГМП препаратами мирабегрон и солифенацин. Это исследование можно считать первой работой, приближенной к клинической практике, когда перед врачом-специалистом встает вопрос о применении препаратов холинергического ряда и β-адреномиметиков одновременно. Задачи исследования: изучение эффективности и безопасности комбинированного лечения препаратами мирабегрон (25, 50 мг)/солифенацин (2,5; 5 или 10 мг) по сравнению с монотерапией солифенацином (5 мг), а также влияния различных доз комбинированной терапии на уменьшение ургентной симптоматики.
В исследование были включены 1306 пациентов (66,4% из них составили женщины), разделенных на 12 групп: 6 комбинированных групп (солифенацин 2,5; 5 или 10 мг плюс мирабегрон 25 или 50 мг), 5 групп монотерапии (солифенацин 2,5; 5 или 10 мг, или мирабегрон 25 или 50 мг) и контрольная группа (плацебо). Анализ полученных данных показал, что комбинация препаратов (мирабегрон и солифенацин в любых дозировках) существенно уменьшала частоту мочеиспускания, а также ургентные позывы по сравнению с монотерапией солифенацином (5 мг) (рис. 1). В группе комбинированной терапии ГМП отмечено незначительное увеличение запоров. При изучении переносимости лечения и возникновения различных осложнений полученные результаты были одинаковыми во всех группах.
Добавление мирабегрона к холинолитику в отсутствие эффекта последнего
Drake и соавт. в 2016 г. продолжили изучение вопроса о целесообразности комбинированной терапии пациентов с ГМП препаратами мирабегрон и солифенацина (клиническое исследование BESIDE) [25]. Дизайн работы характеризовался тем, что в исследование происходил отбор больных, страдающих от симптомов ГМП после 4-недельной терапии солифенацином 5 мг (рис. 2). В исследование были включены 2174 пациента, разделенных на 3 группы: 1-я группа (n=727) включала больных, получавших комбинированную терапию препаратами мирабегрон (25 мг в течение 1 мес., затем по 50 мгх1 раз в день) и солифенацин 5 мг; 2-ю группу (n=728) составили пациенты, получавшие монотерапию препаратом солифенацин 5 мг; 3-я группа (n=719) больных получали солифенацин 10 мг. Результаты клинического исследования показали, что в группе больных, для которых терапия солифенацином 5 мг в течение месяца не дает адекватного положительного эффекта, добавление мирабегрона в дозировке 50 мг достоверно улучшает симптомы ГМП и предполагает минимальное количество побочных эффектов по сравнению с продолжением монотерапии солифенацином 5 мг или увеличением дозировки до 10 мг.

Эффективность и безопасность применения мирабегрона
Об эффективности мирабегрона говорится в результатах многоцентрового исследования Chapple и соавт. (2012) [16]. На протяжении года приема мирабегрона отмечено стойкое снижение симптомов ГМП – количества эпизодов ургентного недержания мочи и мочеиспусканий у больных, согласно данным дневников мочеиспусканий и опросников [16]. Это исследование позволило также выявить наиболее частые побочные эффекты препарата: гипертензия, сухость во рту, запоры и головная боль. Все эти состояния одинаково часто наблюдались у больных, принимавших мирабегрон или холинолитики. Исключение составила лишь частота возникновения сухости во рту, которая намного чаще присутствовала у больных, получавших холинолитики. При длительном приеме мирабегрона удлинения QT интервала на ЭКГ отмечено не было [11].
Влияние на сердечно-сосудистую систему
Вследствие того, что все подтипы β-адрено-рецепторов участвуют в регуляции сердечной функции человека, существует вероятность побочных эффектов со стороны сердечно-сосудистой системы при приеме мирабегрона. При использовании больших его доз в рамках 1-й фазы клинических исследований отмечено дозозависимое повышение артериального давления на 3–4 мм ртутного столба при достижении максимальной концентрации препарата в крови. В то время как в 3-й фазе исследований, когда применялись терапевтические дозы препарата, повышение давления не превышало 1 мм ртутного столба. Однако, по данным Kaidoh и соавт., сердечно-сосудистые действия β3-адреномиметиков оказались незначительными, а порой и полностью отсутствовали [17]. По результатам проспективного исследования Kopp Kallner и соавт. оценивалась безопасность и эффективность мирабегрона в повседневной клинической практике был обследован 221 пациент с ГМП, из которых 16 (7,2%) больных прекратили терапию из-за побочных явлений. Было отмечено существенное снижение среднего систолического артериального давления, но не было значительного изменения среднего диастолического давления или сердечных сокращений (табл. 2). 92,8% больных отметили значительное улучшение симптоматики и качества жизни, что говорит о возможности применения мирабегрона как препарата 1-й линии терапии больных ГМП [23]. В любом случае при назначении мирабегрона, особенно лицам с сопутствующими сердечно-сосудистыми заболеваниями, следует контролировать показатели пульса, артериального давления и других потенциальных сердечно-сосудистых эффектов препарата.
Фармакоэкономический анализ
В Канаде было проведено исследование по оценке клинической и экономической эффективности препарата мирабегрон по сравнению с лекарствами холинергического ряда [18]. При неадекватном выборе терапии ГМП возникают как прямые затраты на лекарственные препараты, адсорбирующие средства (при ургентном недержании мочи), препараты для лечения сопутствующей патологии (мочевой инфекции, психических состояний), так и косвенные затраты, которые включают сокращение количества рабочих часов. Доказано, что при выборе β3-адреномиметика как 1-й линии терапии ГМП затраты были достоверно меньше, чем при использовании препаратов группы м-холинолитиков.
В 2016 г. в России был проведен сравнительный фармакоэкономический анализ применения препарата мирабегрон в терапии ГМП. Пациенты были разделены на 3 группы: 1-й группе была назначена терапия мирабегроном 50 мг, 2-я группа больных принимала солифенацин 5 мг/сут и 3-я группа – солифенацин 10 мг/сут. При однолетнем наблюдении наименьшими экономическими потерями характеризовалась терапия препаратом мирабегрон, экономические затраты при применении которого оказались на 16% ниже, чем при использовании солифенацина [19]. Также ряд исследований в Великобритании и США показал фармакоэкономическую эффективность терапии 1-й линии препаратом мирабегрон в отличие от терапии холинолитиком, а также существенное улучшение качества жизни пациентов по данным их субъективной оценки ургентной симптоматики и по достоверным изменениям в опросниках QoL [20–22].
В настоящее время мирабегрон – единственный зарегистрированный препарат группы β-адреномиметиков, используемый в урологии для лечения ГМП.
По данным исследований, мирабегрон эффективен как для первичных больных, так и для больных, ранее получавших холинолитики и прекративших их прием по причине недостаточного действия или выраженных побочных реакций.
Доказана возможность комбинированной терапии (сочетание терапии мирабегрона с м-холинолитиками) как альтернативной тактики лечения в отличие от стандартного подхода, когда происходит увеличение дозы или смена препаратов холинергического ряда. Ряд клинических исследований показал эффективность и безопасность применения мирабегрона как препарата 1-й линии больными ГМП. Особенный механизм действия β-адреномиметиков предполагает исключение таких побочных действий, как сухость во рту, повышение внутриглазного давления и запоры.
Это формирует выборку первичной группы больных, которым показана терапия 1-й линии мирабегроном:
- с осложненным соматическим статусом, страдающих миастенией или закрытоугольной глаукомой или принимающих другие препараты с холинолитическим эффектом;
- с наличием запоров, сильной ургентной симптоматики, поллакиурии.
Данные выводы позволят расширить показания к применению препарата мирабегрон в клинической практике специалистов.



