Введение. Хронический простатит является одним из распространенных заболеваний репродуктивной системы мужчин. По данным ряда авторов, около 10% имеют бактериальную этиологию [1, 2]. В отечественной литературе исследователи сообщают о различных показателях встречаемости хронического бактериального простатита (ХБП), варьирующегося в широких пределах, от 5 до 75% наблюдений в зависимости от возраста пациентов [3]. Хронический рецидивирующий бактериальный простатит является распространенным заболеванием простаты [4].
В публикациях последних лет, посвященных этиологии данного заболевания, отмечено появление грамположительной кокковой и неклостридиальной анаэробной флоры при бактериологических исследованиях секрета предстательной железы [3]. Установлено, что в этиологической структуре микроорганизмов, выделенных при заболевании, занимают свое «место» грамположительные кокки, в частности коагулазоотрицательные стафилококки [5] и энтерококки [6–8]. Исследованиями [9, 10] также показано, что возбудителями хронического бактериального простатита могут быть грамположительные бактерии, в частности E. faecalis. Выбор антибактериального препарата для лечения хронического простатита остается сложной задачей, так как резистентность уропатогенов к широко используемым антибактериальным средствам постоянно растет [11]. Для проведения эффективной антибактериальной терапии необходимы достоверные данные об изменении чувствительности патогенов к антибиотикам в каждом регионе [12].
В связи с этим, с одной стороны, представляет интерес фенотипическое исследование антибиотикорезистентности клинических изолятов грамположительных кокков для оценки риска формирования устойчивости к антибактериальным препаратам, с другой – молекулярно-генетическое исследование антибиотикорезистентности.
Цель работы – изучить антибиотикорезистентность штаммов грамположительных кокков, выделенных из секрета предстательной железы мужчин с хроническим бактериальным простатитом, на уровне фенои генотипа.
Материалы и методы. В исследование были включены 26 мужчин репродуктивного возраста (20-45 лет) с ХБП, находившихся на амбулаторном лечении у уролога отделения охраны репродуктивного здоровья Оренбургского областного перинатального центра. Алгоритм обследования пациентов включал сбор анамнеза, оценку жалоб, физикальные методы, в т.ч. трансректальное ультразвуковое исследование (ТРУЗИ) и пальцевое ректальное исследование предстательной железы (ПЖ). Также проводили анкетирование с помощью шкалы оценки симптомов ХБП Национального института здоровья США (NIH-CPSI) [13] и Международного индекса эректильной функции (IIEF– 5) [14].
Критерии постановки диагноза ХБП и включения пациентов в исследование: 1. Клинические признаки (один или несколько); боль различной локализации (в промежности, мошонке, крестце, паховой области и т.д.); расстройства мочеиспускания (учащенное мочеиспускание, вялая или прерывистая струя мочи, чувство неполного опорожнения мочевого пузыря, боль во время мочеиспускания); нарушение эякуляции (преждевременная эякуляция, боли при и после эякуляции, гемоспермия). 2. Увеличение числа лейкоцитов в секрете ПЖ (более 10–15 в поле зрения) или в моче, полученной после массажа ПЖ. 3. Культуральное подтверждение возбудителя ХБП. 4. Длительность заболевания не менее года. 5. Возраст 20–45 лет.
Пациенты с инфекциями, передаваемыми половым путем, исключены из исследования. При обследовании пациентов соблюдены акты национального стандарта РФ ГОСТ Р 52379-2005 о надлежащей клинической практике [15]. Секрет простаты после массажа ПЖ собирали в стерильные емкости и доставляли в лабораторию в течение 15 мин. Выделение бактерий из исследуемого материала проводили общепринятыми методами бактериологического исследования. Исследуемый материал засевали на селективные питательные среды: желточно-солевой агар для выделения стафилококков и Schaedler-агар – энтерококков. Видовую принадлежность микроорганизмов оценивали с помощью масс-спектрометра MALDI-TOF серии Microflex (Bruker Daltonics, Германия), идентификацию микроорганизмов с расчетом коэффициента достоверности проводили с использованием программного обеспечения Maldi BioTyper 3,0.
Чувствительность микроорганизмов к антибактериальным препаратам определяли диско-диффузионным методом, согласно методическим указаниям 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» [16]. В работе использовали стандартные диски промышленного производства (ЗАО «Научно-исследовательский центр фармакотерапии», Санкт-Петербург) с 16 антибиотиками: меропенем, имипенем, эртапенем, цефотаксим, цефтазидим, цефоперазон, цефтриаксон, цефепим, амоксиклав, оксациллин, амикацин, гентамицин, тобрамицин, левофлоксацин, энрофлоксацин, ломефлоксацин.
Выделение ДНК осуществляли из бактериальных суспензий (107 КОЕ/мл) суточной агаровой культуры сорбционным методом с использованием набора реактивов «ДНКсорб-В» («ИнтерЛабСервис», Россия), согласно рекомендации производителя. Гены антибиотикорезистентности обнаруживали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, синтезированных компанией СИНТОЛ (Москва) (см. таблицу), по следующему протоколу: 35 циклов – денатурация 1 мин при 95°C, отжиг праймеров – 1 мин при 50°C, элонгация – 1 мин 30 с при 72°C, заключительный этап – 5 мин при 72°C.

Всего изучено 120 клинических изолятов грамположительных микроорганизмов, среди них 31 штамм E. faecalis и 91 культура коагулазоотрицательных стафилококков (CoNS) разных видов: S. epidermidis (43), S. warneri (21), S. haemolyticus (18), S. saprophyticus (9). Полученные данные обработаны статистически [18].
Результаты. Диско-диффузионным методом установлено, что культуры E. faecalis в 96,8% случаев были резистентными к фторхинолонам, оксациллину, цефтазидиму, цефтриаксону и цефепиму. Высокий процент резистентности у изученных энтерококков наблюдался к гентамицину, карбопенемам и цефотаксиму (по 67,6%).
Среди CoNS абсолютная резистентность к левофлоксацину и энрофлоксацину регистрировалась только у S. saprophyticus. Все изоляты этого вида были также устойчивыми к гентамицину, цефотаксиму, эртапенему; в 88,9% случаев к цефтазидиму и цефепиму; в 89,0% – к тобрамицину и амикацину.
Половина изученных изолятов S. epidermidis продемонстрировала резистентность к карбопенемам, амикацину, оксациллину, цефотаксиму. К гентамицину и цефепиму были устойчивыми 74,4% культур, к цефтазидиму и фторхинолонам – большинство выделенных штаммов (по 95,4% культур). Установлена резистентность всех культур S. warneri к гентамицину, 42,9–47,6% штаммов к карбопенемам, 52,5% к оксациллину и ломефлоксацину, 47,6–57,1% к цефалоспоринам, за исключением цефоперазона. Все штаммы S. haemolyticus оказались резистентными к оксациллину, цефотаксиму и цефтазидиму; около половины изолятов характеризовались устойчивостью к антибиотикам из группы фторхинолонов, карбопенемов и цефепиму. Проведенными исследованиями установлено, что 33% протестированных изолятов CoNS и 40% штаммов E. faecalis характеризовались устойчивостью к антимикробным препаратам, относящимся к трем группам. Культуры E. faecalis в 20% случаев были резистентными к антибиотикам из четырех групп.
Все изученные изоляты стафилококков и 35,5% штаммов энтерококков были чувствительными к амоксиклаву и цефоперазону.
Далее мы изучили распространенность генов, кодирующих антибиотикорезистентность, у выделенных штаммов (см. рисунок). Наиболее часто (в 50% случаев) ген mecA регистрировался у культур S. epidermidis и S. haemolyticus, реже – у E. faecalis (32%); все изоляты S. epidermidis и S. warneri, 50% штаммов S. haemolyticus и 32% культур E. faecalis характеризовались наличием генов резистентности к ампициллину (blaZ).
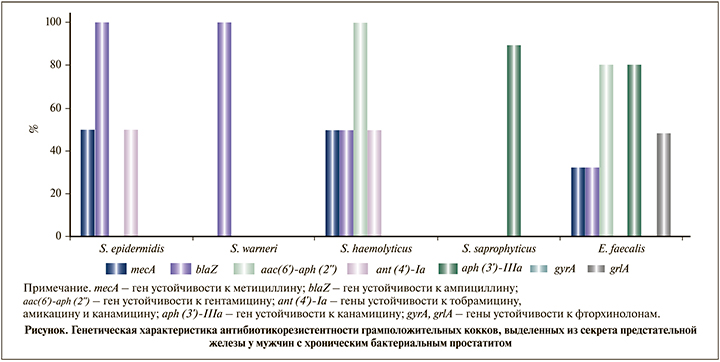
Изучение резистентности к аминогликозидам на генетическом уровне позволило обнаружить ген aac(6’)аph(2’’) у 100% штаммов S. haemolyticus и 80,6% культур E. faecalis; половина изученных стафилококков двух видов (S. epidermidis и S. haemolyticus) характеризовалась наличием гена ant (4’)-Ia. Ген aph(3’)-IIIa зарегистрирован у 80,6% E. faecalis и 89% S. saprophyticus.
Гены резистентности к фторхинолонам (gyrA и grlA) у изолятов CoNS не выявлены, ген grlA обнаружен у 48,3% E. faecalis.
Обсуждение. Антибактериальными препаратами выбора для терапии хронического бактериального простатита являются фторхинолоны [19].
Однако отмечен рост резистентности уропатогенов, в частности энтерококков, выделенных у пациентов с ХБП, к данной группе препаратов [20], что согласуется с полученными нами данными.
Наиболее клинически значимым геном энтерококков является aac(6’)-аph(2’’), кодирующий одноименный бифункциональный фермент, обусловливающий устойчивость к гентамицину [21]. Полученные нами сведения о высокой резистентности энтерококков к гентамицину и наличии генов устойчивости у 60% штаммов подтверждают данные [22, 23]. Корреляционный анализ антибиотикорезистентности культур энтерококков к гентамицину на уровне фенои генотипов выявил достоверную высокую положительную связь между наличием генов резистентности и фенотипическим проявлением признака (r=0,94, р< 0,05). Напротив, среди изученных стафилококков наблюдалась высокая резистентность к гентамицину с отсутствием генов устойчивости у этих штаммов. Исключение составили культуры S. haemolyticus, у которых регистрировался ген aac(6’)-аph (2’’), но фенотипически они были чувствительными к данному препарату. Аналогичный результат отмечен при регистрации гена ant (4’)-Ia у изолятов S.epidermidis и S. haemolyticus. На несоответствие между генетическими и фенотипическими паттернами устойчивости к аминогликозидам у изолятов стафилококков указывают в своей работе L. X. Zhu et al. [24]. Отмечено, что у 33,4% штаммов энтерококков, резистентных к тобрамицину и амикацину фенотипически, генетических детерминант устойчивости к этим антибиотикам нет. Особое значение имеет распространение стафилококков, резистентных к метициллину (или к оксациллину) [25]. Большинство исследований указывает на наличие резистентности, более чем у 50% клинических изолятов коагулазонегативных стафилококков [26], что подтверждают и полученные нами данные. Резистентность стафилококков связана с наличием гена mec A, кодирующего пенициллинсвязывающий белок 2a, который обладает низкой аффинностью к β-лактамам [27]. Его наличие указывает на устойчивость ко всем β-лактамным антибиотикам (пенициллины, цефалоспорины, карбапенемы) и непредсказуемую клиническую эффективность.
Энтерококки демонстрируют относительную устойчивость ко всем бета-лактамам и карбапенемам за счет модификации мишени вследствие сниженного родства к бета-лактамным пенициллинсвязывающим белкам [28]. Генетические детерминанты устойчивости к бета-лактамным антибиотикам (mec A) у культур энтерококков нами выявлены в 32% случаев.
Наряду с геном mec A способствует приобретению и распространению устойчивости бактерий к пенициллинам ген blaZ, кодирующий бета-лактамазу. По данным Т.С. Коменковой и соавт. [29], случаи выявления энтерококков, продуцирующих бета-лактамазу, остаются редкими. Однако проведенное нами молекулярно-генетическое исследование выявило наличие гена, кодирующего беталактамазу, у 33 % изолятов E. faecalis и 50–100% культур коагулазонегативных стафилококков. Данный факт может объясняться способностью горизонтального переноса гена blaZ среди стафилококков и энтерококков [30].
Заключение. При анализе результатов индивидуальных антибиотикограмм оптимального антибактериального препарата, обладающего высокой активностью в отношении всех изученных грамположительных микроорганизмов, не выявлено. На наш взгляд, данная проблема обусловлена множественной лекарственной устойчивостью за счет неоднократно проводимых курсов антибактериальной терапии. Наблюдаемый рост устойчивости к антимикробным препаратам у грамположительных кокков свидетельствует о целесообразности проведения регионального мониторинга антибиотикорезистентности микрофлоры, что является важным дополнением к проведению эффективной терапии хронического бактериального простатита. По результатам нашей работы, наиболее эффективными в отношении изученных энтерококков и стафилококков оказались амоксиклав и цефоперазон.



