Введение. Многочисленные исследования выявили негативное влияние хирургического вмешательства или связанных с ним факторов на риск развития острого повреждения почек (ОПП). Оперативное лечение служит основной причиной возникновения ОПП у госпитализированных пациентов и составляет до 40% случаев ОПП в стационаре. Острое повреждение почек негативно влияет на результаты лечения, ассоциируется с повышением затрат, продолжительности пребывания в стационаре и внутрибольничной смертностью [1]. Тем не менее частота и исход ОПП после радикальной цитэктомии изучены недостаточно, поскольку большинство исследований послеоперационного ОПП проводились у пациентов, перенесших операции на сердце или органах брюшной полости. Кроме того, диагностическая ценность новых биомаркеров, таких как липокалин, ассоциированный с нейтрофильной желатиназой (NGAL), интерлейкин-18 и матричная металлопротеиназа, при раннем выявлении или в прогнозировании исхода ОПП после операций на органах малого таза не оценена из-за недостаточного количества данных [1,2].
ОПП определяется как повышение уровня сывороточного креатинина (SCr) на ≥0,3 мг/дл (≥26,5 мкмоль/л) в течение 48 ч или повышение SCr более чем в 1,5 раза по сравнению с исходным уровнем (если это известно или предполагается, что это произошло в течение предшествовавших 7 дней); или объем мочи менее 0,5 мл/кг/ч за 6 ч наблюдения [2].
В связи с недавним появлением в клинической практике новых биомаркеров почечного повреждения и признанием их в качестве более чувствительного инструмента для ранней диагностики ОПП, чем сывороточный креатинин, возникла концепция субклинического ОПП. Оно определяется как наличие повышенных уровней биомаркеров повреждения почечных канальцев в отсутствие общепринятых критериев ОПП, основанных на уровне креатинина в сыворотке или диурезе. В нескольких исследованиях, посвященных изучению предикторов ОПП, установлено, что у пациентов, отнесенных к группе субклинического ОПП, отмечается увеличение частоты осложнений, поэтому необходимо определить частоту развития данного состояния и риск хронической болезни почек при операциях на органах малого таза [3, 4].
Цель работы: определение факторов риска и исхода ОПП у пациентов с клиническим или субклиническим ОПП через 6 мес. после радикальной цистэктомии. В задачи исследования входило определение частоты возникновения ОПП, сравнение между группами с послеоперационным ОПП (включая пациентов с субклиническим ОПП) и группой без ОПП, а также определение диагностических и прогностических значений липокаина, ассоциированного с нейтрофильной желатиназой (NGAL) мочи и сыворотки крови в каждой группе пациентов.
Материалы и методы. Протокол исследования был одобрен Этическим комитетом ФГБОУ ВО БГМУ Минздрава России. Письменные информированные согласия были получены от всех пациентов. В проспективное одноцентровое исследование включены пациенты, которым планировалось плановое оперативное лечение в объеме радикальной цистэктомии по поводу мышечно-инвазивного рака мочевого пузыря стадии T2а3aN0M0 G1–3 без признаков отдаленного метастазирования. Обследование, лечение и последующее наблюдение проводили в клинике ФГБОУ ВО БГМУ Минздрава России. Пациентов последовательно включали в исследование в период с января 2017 по декабрь 2019 г.
Пациенты с исходной скоростью клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2, пациенты, находившиеся на поддерживающей заместительной почечной терапии (ЗПТ) или с ОПП до операции, были исключены из исследования.
Образцы крови были получены до операции и через 1, 3, 7 и 30 сут. после нее. Образцы мочи собирали через 6, 12 и 24 ч, а также через 3, 7 и 30 сут. после операции. Пациентов наблюдали амбулаторно после выписки, уровень креатинина в сыворотке крови измеряли через 1, 3 и 6 мес. после операции. Полученные от пациентов образцы крови и мочи центрифугировали, супернатанты хранили при -80°C до анализа биомаркера. NGAL в сыворотке и моче измеряли с использованием набора ELISA для NGAL (BioPorto, Gentofte, Дания) в соответствии с инструкциями производителя. Скорость клубочковой фильтрации оценивали, используя уравнение CKD-EPI [5].
Послеоперационное клиническое ОПП констатировали в соответствии с критериями Инициативы по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes – KDIGO). Субклиническое ОПП было определено в процессе построения ROC-кривой как повышение уровня NGAL в сыворотке или моче выше определенного порогового значения без соответствия критериям KDIGO [2].
На начальном этапе исследования оценивали возможность применения NGAL в качестве предиктора клинического ОПП. Далее пациенты были разделены на две группы: пациенты с ОПП (клиническое или субклиническое) и пациенты без ОПП. Межгрупповому сравнению были подвергнуты периоперационные показатели, включая смерть в послеоперационном периоде, длительность пребывания в стационаре и снижение СКФ в течение периода наблюдения. Первичным исходом считали развитие послеоперационного ОПП, вторичным – длительность госпитализации, послеоперационную смерть и снижение СКФ через 6 мес. после операции.
Для статистического анализа использовали программное обеспечение SPSS, версия 19.0. Сравнительный межгрупповой анализ проводили с помощью t-критерия Стьюдента или U-критерия Манна–Уитни для числовых данных, а также критерия χ2 или точного критерия Фишера для категориальных данных. Для проверки диагностической эффективности NGAL в моче для развития клинического ОПП был выполнен ROC-анализ. Проведены многомерный логистический регрессионный анализ с целью выявления факторов риска развития клинического или субклинического ОПП и множественный линейный регрессионный анализ для определения предикторов степени снижения СКФ через 6 мес. после операции.
Результаты. После подписания информированного согласия 186 пациентам (средний возраст 59,5±11,4 года), 127 (68,3%) из которых мужчины, в плановом порядке была проведена радикальная цистэктомия. Все операции выполнены одним хирургом в период с января 2017 по декабрь 2019 г.
В 70 (37,6%) случаях радикальное вмешательство проведено открытым доступом, в 46 (24,7%) – лапароскопически, в 72 (38,7%) – с применением роботической хирургической системы DaVinci. В абсолютном большинстве случаев, 164 (88,2%) пациента, методом отведения мочи была выбрана илеоцистопластика по Бриккеру. При роботических операциях илеокондуит формировали интракорпорально.
Клинически значимое ОПП в послеоперационном периоде выявлено у 43 (23,1%) пациентов: 26 (60,5%) на 1-й стадии KDIGO, 14 (32,6%) на 2-й и 3 (6,9%) на 3-й стадии. Ни одному из пациентов с клинически значимым ОПП не требовалась ЗПТ.
Анализ результатов определения уровня NGAL в моче показал (табл. 1), что у пациентов с ОПП наиболее существенно данный параметр увеличился через 12 ч после операции.
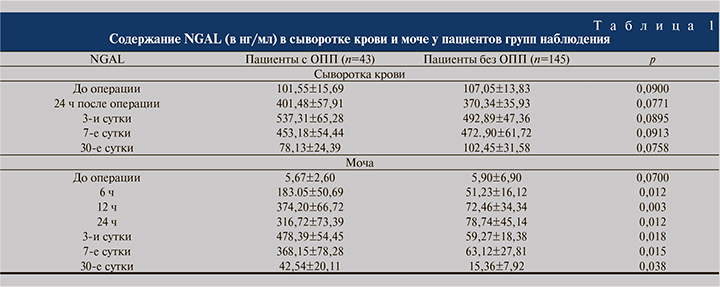
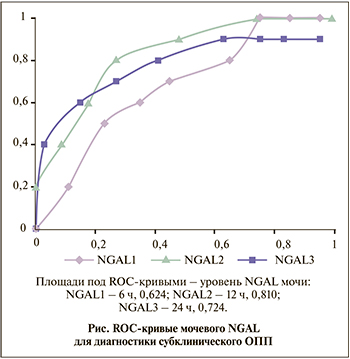 Площадь под ROC-кривой для мочевого NGAL через 12 ч после операции при прогнозировании клинически значимого ОПП составила 0,810 (пороговое значение – 156,87 нг/мл, чувствительность – 80%, специфичность – 73,7%; см. рисунок). Используя это предельное значение и максимальное значение серийных уровней мочевого NGAL в течение 24 ч после операции, мы дополнительно выделили 53 (28,5%) пациента, у которых развился субклинический вариант ОПП, и перераспределили их в группу к пациентам, у которых развилось клинически значимое ОПП.
Площадь под ROC-кривой для мочевого NGAL через 12 ч после операции при прогнозировании клинически значимого ОПП составила 0,810 (пороговое значение – 156,87 нг/мл, чувствительность – 80%, специфичность – 73,7%; см. рисунок). Используя это предельное значение и максимальное значение серийных уровней мочевого NGAL в течение 24 ч после операции, мы дополнительно выделили 53 (28,5%) пациента, у которых развился субклинический вариант ОПП, и перераспределили их в группу к пациентам, у которых развилось клинически значимое ОПП.
В итоге пациенты с субклинической формой ОПП составили 55,2% объединенной группы прооперированных с ОПП.
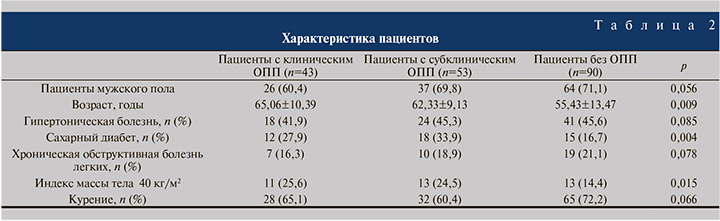
С целью определения дооперационных факторов риска развития клинического и субклинического ОПП проведен многомерный логистический регрессионный анализ. Возраст, ожирение, продолжительность операции и объем кровопотери оказались независимымм предиктором развития послеоперационного ОПП (p=0,009, p=0.015, p=0,009 и p=0,035 соответственно) (табл. 2, 3).

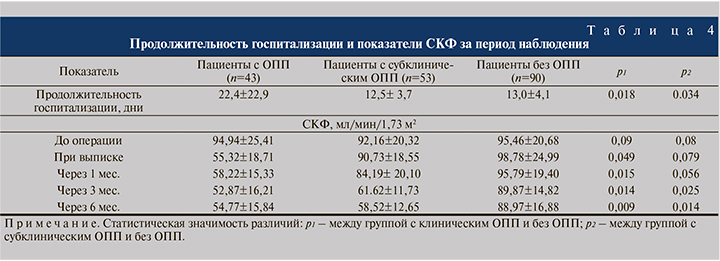
Исходы пациентов с субклиническим и клиническим ОПП существенно не различались. Скорость клубочковой фильтрации у пациентов с ОПП на всех сроках наблюдения была закономерно ниже, чем в группе без ОПП.
В группе с субклиническим ОПП отмечено снижение СКФ в отдаленном послеоперационном периоде через 6 мес.после выписки, несмотря на отсутствие значимых различий с группой без ОПП при выписке. Продолжительность послеоперационного пребывания в стационаре также была значительно больше в группе с ОПП (табл. 4).
Обсуждение. Операция служит основной причиной возникновения ОПП у госпитализированных пациентов, обусловливая до 40% случаев развития данного состояния в стационаре. Частота ОПП среди оперированных зависит от вида хирургического вмешательства и способа определения ОПП, при этом самые высокие показатели отмечаются после операций на сердце (18,7%), органах брюшной (13,2%) и грудной (12,0%) полости [2]. Для пациентов с послеоперационным ОПП характерны значительно более длительное пребывание в стационаре (15,8 против 8,6 дня), более высокая частота повторных госпитализаций в течение 30 дней (21 против 13%), более частое развитие терминальной почечной недостаточности и высокие показатели смертности. Увеличение риска смерти через 30 дней после абдоминальной операции у пациентов с ОПП имеет место даже после восстановления почечной функции [6].
Несмотря на высокую частоту возникновения, ОПП остается одним из самых поздно диагностируемых вследствие недостаточно леченных послеоперационных осложнений. Недавние исследования продемонстрировали связь между послеоперационным увеличением уровня сывороточного креатинина и худшими клиническими исходами, и эта связь наблюдалась при более низких пороговых значениях, чем в определении RIFLE [7]. В отличие от операций на органах грудной и брюшной полости, частота или факторы риска ОПП после вмешательств на органах малого таза изучены мало. В нашем исследовании среди пациентов с исходной СКФ ≥60 мл/мин/1,73 м2, перенесших плановую цистэктомию, у 43 (23,1%) развилась клиническая форма ОПП, диагностированная на основании критериев KDIGO, но никому при этом не потребовалось проведения ЗПТ.
Новым подходом к оценке повреждения почек является анализ сывороточных и/или мочевых биомаркеров. Раннее выявление повреждения почек с использованием сывороточного креатинина проблематично, поскольку креатинин является мерой почечной функции, а не травмы. Наиболее перспективным маркером является липокалин, связанный с желатиназой нейтрофилов в сыворотке крови и моче (NGAL) [8]. В нашем исследовании сывороточный уровень NGAL не показал прогностической ценности, вероятно, потому, что экспрессируется клетками иммунной системы и других органов при повреждении тканей во время операции.
Сведения об оптимальных сроках проведения анализа и пороговых значениях показателя мочевого NGAL в ранее опубликованных исследованиях разнятся. Так, у пациентов, перенесших операции на сердце или органах брюшной полости, уровни мочевого NGAL через 0–6 ч после операции были повышены при развитии ОПП, тогда как другое исследование не показало корреляции уровней NGAL через 2 или 6 ч после операции с развитием ОПП [9, 10]. Мы обнаружили, что показатель содержания NGAL в моче, полученной через 12 ч после операции, был наиболее значимым прогностическим параметром для выявления ОПП с пороговым значением 156,87 нг/мл.
Успехи в изучении биомаркеров позволили выявить пациентов, у которых имело место только повышение уровня маркеров почечного повреждения и отсутствовали согласованные критерии ОПП. Эти пациенты не могли быть распознаны в эпоху до появления биомаркеров, так как диурез и уровень креатинина в сыворотке крови оставались в пределах нормальных значений. Тем не менее несколько недавно проведенных исследований продемонстрировали, что пациенты с субклиническим ОПП составляют 15–20% пациентов, поступивших в отделение интенсивной терапии или отделение неотложной помощи, и для них характерен более высокий риск смерти или потребности в диализе по сравнению с пациентами без повышенных уровней маркеров [4].
В нашем исследовании у 53 (28,5%) пациентов с предельным значением NGAL более 156,87 нг/мл диагностировано субклиническое ОПП. Мы их включили в группу ОПП и сравнили их предоперационные факторы риска с таковыми группы без ОПП.
К ранее выявленным факторам риска послеоперационного ОПП относятся мужской пол, гипертония, сахарный диабет, хроническая обструктивная болезнь легких, метастатический рак, гипоальбуминемия, возраст. Ожирение, особенно с индексом массы тела более 40 кг/м2, также связано с более высоким риском послеоперационного ОПП [11]. Многочисленные исследования выявили негативное влияние хирургического вмешательства или связанных с ним факторов на развитие ОПП при операциях на органах брюшной полости, в частности использование внутривенного контраста для визуализации, использование диуретиков и вазопрессоров, переливание крови, большой объем инфузии во время операции и неотложные хирургические вмешательства [12]. В нашей работе несколько факторов – возраст, ожирение, продолжительность операции и объем кровопотери, которые значительно различались между группами с ОПП и без ОПП, определены нами как независимые факторы риска развития ОПП после цистэктомии.
В то время как проведение ЗПТ является хорошо известным фактором плохого исхода ОПП, такого как более длительное пребывание в стационаре, высокая смертность и предрасположенность к развитию терминальной стадии почечной недостаточности, в нашем исследовании пациенты с ОПП, не требовавшие ЗПТ, значительно дольше находились в отделении и вместе с пациентами группы с субклиническим ОПП имели более низкие показатели СКФ через 6 мес. после операции по сравнению с пациентами без ОПП. Разница была подтверждена результатами сравнительного анализа пациентов с субклиническим ОПП и пациентов без данного осложнения. Насколько нам известно, это первое исследование, которое продемонстрировало, что даже субклиническое послеоперационное ОПП может быть фактором риска развития хронической болезни почек у пациентов после цистэктомии. Кроме того, было показано, что уровень NGAL в моче, который использовался для диагностики субклинического ОПП, ассоциировался со степенью снижения почечной функции через 1, 3 и 6 мес. после операции. Все эти данные указывают на то, что NGAL мочи может выступать в роли чувствительного биомаркера и предиктора исхода послеоперационного ОПП, а также подчеркивают необходимость выявления и оценки пациентов, у которых развивается субклиническое ОПП.
Несмотря на полученные новые данные, наше исследование имеет ряд ограничений. Это одноцентровое проспективное исследование, и небольшой размер выборки ограничил достоверность модели для прогнозирования послеоперационного ОПП или отдаленного почечного исхода. Кроме того, мы включили в исследование только пациентов с нормальной функцией почек, что может ограничить широкое применение результатов этого исследования. Включение пациентов независимо от типа цистэктомии, включая открытую, также можно расценивать как ограничение. Кроме того, мы наблюдали пациентов всего 6 мес. Хотя наше исследование позволило сделать несколько важных выводов, они должны быть дополнительно подтверждены на большей когорте пациентов с более длительным периодом наблюдения.
Заключение. Согласно полученным в ходе работы данным, факторами риска развития послеоперационного ОПП являются возраст, ожирение, продолжительность операции и объем кровопотери. Установлено, что мочевой NGAL – информативный маркер как ранней диагностики послеоперационного ОПП, так и прогнозирования исхода ОПП через 6 мес. после операции. Понимание и коррекция факторов риска ОПП, его ранняя диагностика могут обеспечивать эффективную профилактику, уменьшение прогрессирования уже развившегося послеоперационного ОПП, снижение негативного влияния на другие органы и облегчение восстановления почек у пациентов с установленным ОПП.



