Введение. Аутосомно-доминантная поликистозная болезнь почек (АДПБП) – наиболее распространенная наследственная болезнь почек и причина терминальной хронической почечной недостаточности (ТХПН) у 10–15% пациентов с ТХПН [1]. Инфицирование или нагноение содержимого кист считается наиболее частым осложнением. У пациентов с ТХПН, особенно после трансплантации почки, инфицированные кисты (ИК) служат показанием к нефрэктомии, в связи с чем точная диагностика крайне актуальна, так как предполагает выполнение большой органоуносящей операции пациентам с повышенным риском анестезиолого-хирургических осложнений. Помимо этого важность своевременной диагностики обусловлена еще и тем, что при ТХПН и на фоне иммуносупрессивной терапии существенно повышается риск сепсиса [2].
Лабораторное бактериологическое исследование аспирата является «золотым» стандартом диагностики ИК, однако пункция кисты не всегда технически выполнима из-за больших размеров почек, сложной визуализации при ультразвуковой (УЗ) навигации и риска травмы органов брюшной полости [3].
Неинвазивные методы диагностики, такие как УЗ-исследование (УЗИ), мультиспиральная компьютерная томография (МСКТ), обладают крайне низкой чувствительностью и специфичностью и не могут рутинно использоваться в диагностики ИК [4].
Позитронно-эмиссионная томография (ПЭТ) имеет высокую диагностическую ценность в верификации ИК [5], но недостатки метода включают ограниченную доступность и высокую стоимость. Кроме того, сообщалось, что доза облучения может быть увеличена пациентам с почечной недостаточностью [6].
Магнитно-резонансная томография (МРТ) – более доступный и безопасный метод диагностики ИК. Для ИК характерно снижение или изоинтенсивность сигнала на Т1-взвешенном изображении (ВИ), усиление сигнала на Т2-ВИ и его повышение на дифузионно-взвешенном изображении (ДВИ) [7]. T. Suwabe et al. [8] выделяют четыре патогномичных МР-признака ИК: рестрикция диффузии, наличие газа в полости кисты, осадка и утолщение стенки кисты. По данным этих авторов, рестрикция диффузии при 100%-ной чувствительности обладает низкой специфичностью (не более 40%).
Для количественной оценки МР-диффузии определяют измеряемый коэффициент диффузии (ИКД), который с успехом используют в дифференциальной диагностике острого пиелонефрита, абсцессов почек, пионефроза [9, 10]. Однако в настоящее время не определены пороговые значения ИКД для ИК у пациентов с поликистозом почек.
Цель исследования: улучшить дифференциальную диагностику ИК у пациентов с АДПБП, сократить число ложноположительных заключений МРТ почек.
Материалы и методы. Проведено ретроспективное одноцентровое исследование, в которое включены 33 пациента с АДПБП, в период с 2015 по 2020 г. перенесших билатеральную нефрэктомию. Показанием к операции во всех случаях было подозрение на ИК. Пациенты были разделены на две группы. Первую группу (n=17) составили прооперированные с гистологически подтвержденной ИК, 2-ю (n=16) – пациенты, у которых при патоморфологическом исследовании не выявлено признаков воспаления в кисте. Одним из основных критериев включения было отсутствие экстраренальной септической патологии. Кроме этого критериями включения в исследование были наличие ТХПН и результатов МРТ почек до операции.
Средний возраст исследуемых составил 53,0±10,2 года. Мужчин было 17 (51,5%). На момент оперативного вмешательства все больные получали лечение гемодиализом. Медиана длительности диализа на момент операции составила 4 мес. (Q1–Q3: 1–36).
Диагноз ИК ставили на основании клинической картины, лабораторных данных (повышение уровня СРБ, лейкоцитов в крови и моче), результатов посева мочи и данных МРТ. Боль в животе отмечена у 25 (75,8%) пациентов, лихорадка выше 38°С – у 17 (51,5%), лейкоцитурия – у 23 (69,7%), макрогематурия – у 13 (39,4%). Бактериологическое исследование мочи проведено 22 больным.
Магнитно-резонансная томография с использованием протоколов ДВИ выполнена всем пациентам. Заключение о наличии ИК делали при снижении или изоинтенсивном сигнале на Т1-ВИ, усилении сигнала на Т2-ВИ и при повышении сигнала на ДВИ (рис. 1).
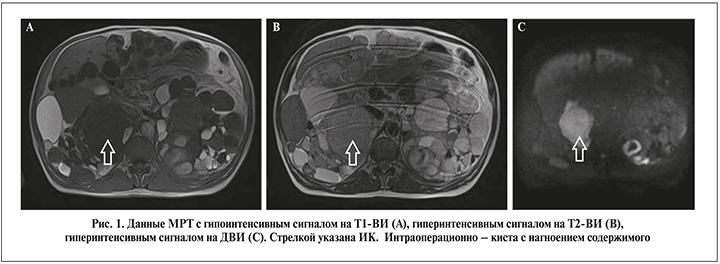
Лапароскопическая билатеральная нефрэктомия выполнена 7 (21,2%) пациентам, лапаротомия – 26 (78,8%). При лапароскопии почки извлекали через минилапаротомный доступ целиком. При направлении на гистологическое исследование локализацию ИК обозначали в соответствии с данным МРТ-ДВИ. Патоморфологические критерии для постановки диагноза ИК: скопление нейтрофилов в содержимом кисты, наличие лейкоцитарной инфильтрации в стенке кисты.
Расчет ИКД проводили после оперативного лечения и получения гистологических данных.
Объем ИК рассчитывали по формуле: объем=длина×латеральный диаметр×переднезадний диаметр×(π/6).
Для статистической обработки данных использовали программу SPSS, версия 26 (IBM, США). При нормальном распределении количественных данных для сравнения использовали Т-критерий Стьюдента, при распределении, не соответствовавшем нормальному, – критерий Манна–Уитни (группирующий признак всегда был бинарным). Номинальные данные оценивали с помощью критерия Фишера, так как минимальное предполагаемое число всегда было менее 10. Различия показателей считали статистически значимыми при p<0,05. Силу связи номинальных признаков оценивали по критерию Крамера (V), связь считали сильной при V>0,4, согласно рекомендациям Rea и Parker [11]. Для оценки зависимости события от количественных факторов использован метод бинарной классификации объектов – ROC-(Receiver Operator Characteristic)-анализ. ROC-анализ – метод, используемый для предоставления результатов бинарной классификации, позволяющий оценивать качество (диагностическую эффективность) прогностической модели, а также находить оптимальное значение порога классификации. ROC-кривая показывает прямую зависимость количества верно классифицированных положительных исходов от количества неверно классифицированных отрицательных исходов. Чем больше выгнута ROC-кривая, тем более точно прогнозирование результатов теста. Индикатором этого свойства служит площадь под кривой ROC (AUC – «area under curve»), которая для теста с нулевой степенью прогнозирования равна 0,5, а для случая с максимальной степенью прогнозирования 1.
С целью оценки влияния факторов на результирующую переменную, измеренную по количественной шкале, использовался корреляционный анализ. Теснота корреляционной связи оценивалась по шкале Чеддока.
Построение прогностической модели риска события выполнялось при помощи метода бинарного логистического регресса (многофакторный анализ), когда зависимая переменная была дихотомической, а независимые переменные – как качественные, так и количественные. Отбор независимых переменных производился методом пошаговой прямой селекции с использованием в качестве критерия исключения статистики Вальдовского. Статистическая значимость полученной модели определялась с помощью критерия χ2.
Результаты. При сравнении клинических проявлений в двух группах пациентов наличие ИК статистически значимо ассоциировалось с болью в животе со стороны почки (V=0,583, p<0,001) и с лихорадкой (V=0,393, p<0,038).
 В 1-й группе средний уровень лейкоцитов составил 13,8×109±8,1×109/л (95% доверительный интервал [ДИ]: 9,7–18), во 2-й – 7,8±2,8×109/л (95% ДИ: 6,2–9,2; p=0,009). Медиана СРБ в 1-й группе составила 155 (Q1–Q3: 110–190), во 2-й – 53,5 мг/л (Q1–Q3: 1,5–83), различия были статистически достоверными (p=0,001). Корреляционный анализ связи между уровнем СРБ и объемом ИК выявил статистически значимую прямую связь высокой тесноты по шкале Чеддока (ρ=0,627, p<0,001), сила связи лейкоцитоза с ИК была слабее (ρ=0,412, p<0,017).
В 1-й группе средний уровень лейкоцитов составил 13,8×109±8,1×109/л (95% доверительный интервал [ДИ]: 9,7–18), во 2-й – 7,8±2,8×109/л (95% ДИ: 6,2–9,2; p=0,009). Медиана СРБ в 1-й группе составила 155 (Q1–Q3: 110–190), во 2-й – 53,5 мг/л (Q1–Q3: 1,5–83), различия были статистически достоверными (p=0,001). Корреляционный анализ связи между уровнем СРБ и объемом ИК выявил статистически значимую прямую связь высокой тесноты по шкале Чеддока (ρ=0,627, p<0,001), сила связи лейкоцитоза с ИК была слабее (ρ=0,412, p<0,017).
Положительный посев мочи не ассоциировался с ИК (р=0,187). Из 17 пациентов 1-й группы анализ проведен 14. Положительный посев мочи имел место у 10 (71,4%) человек. Наиболее частым патогеном была Escherichia coli, выделенная в 8 случаях. Во 2-й группе посев мочи был взят у 8 из 16 больных. Рост флоры отмечен в 3 случаях.
В то же время лейкоцитурия была фактором, достоверно связанным с ИК (p<0,026, V=0,416).
По результатам сопоставления гистологических заключений с результатами МРТ чувствительность МРТ в диагностике ИК составила 88,2%, специфичность – 43,8%, т.е. имелось много ложноположительных заключений.
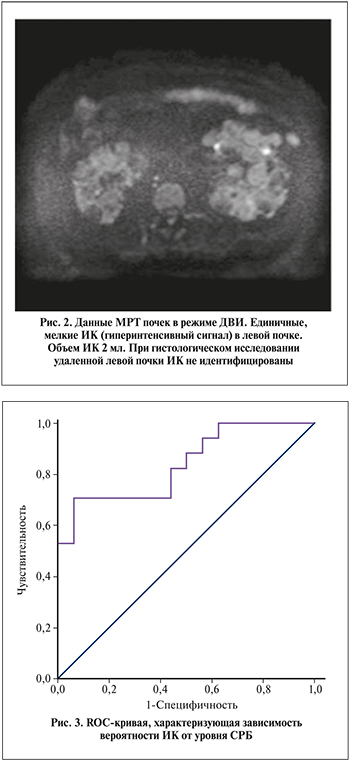
При ROC-анализе объем ИК в точке cut-off составил 13 мл (чувствительность – 81,3%, специфичность – 75,0%). Инфицированные кисты объемом менее 13 мл с высокой долей вероятности не будут идентифицированы при гистологическом исследовании (рис. 2).
При сравнении ИКД в кистах с рестрикцией диффузии в двух группах пациентов установлено, что в 1-й группе ИКД был достоверно меньше, чем во 2-й (p=0,004): 0,67±0,21×10-3мм2/с (95% ДИ: 0,56–0,79), во и 1,2±0,59×10-3 мм2/с (95% ДИ: 0,89–1,5) соответственно. При ROC-анализе значение ИКД в точке cut-off составило 0,83×10-3 мм2/с (p=0,001).
У пациентов с ИКД ниже этого уровня предполагался повышенный риск ИК. Чувствительность параметра составила 78%, специфичность – 80%.
При многофакторном анализе, включившем клинические данные, лабораторные изменения и результаты МРТ, установлено, что только уровень СРБ достоверно (р=0,03) ассоциировался с ИК. Повышение уровня СРБ на 1 мг/л увеличивало риск ИК в 1,02 раза (AOR – 1,02, 95% ДИ: 1,0–1,03) (рис. 3).
Прогностическая модель была статистически значимой (p=0,001). Значение уровня СРБ в точке cut-off составило 83 мг/л. У пациентов с более высоким содержанием СРБ предполагался повышенный риск ИК, при более низких значениях риск наличия ИК считался незначительным. Чувствительность показателя составила 70,6%, специфичность – 75,0%.
Обсуждение. Диагностика ИК у пациентов с АДПБП сопряжена с трудностями из-за неспецифической клинической картины, неоднозначных лабораторных изменений, низкой чувствительности и специфичности УЗИ, МСКТ, большого числа ложноположительных прогнозов при МРТ и ограниченном использовании диагностической пункции под УЗ-контролем [3, 4, 13].
Лихорадка и боль в области почки – важные клинические проявления ИК, однако эти симптомы, особенно боль, могут наблюдаться и при кровоизлиянии в кисты [4, 13].
Уровень лейкоцитов крови и СРБ не всегда указывают на наличие ИК. При нормальном уровне лейкоцитов крови могут наблюдаться ИК. При интерпретации показателя СРБ необходимо учитывать не только сам факт повышения, но и его степень, количественную характеристику параметра. По нашим данным, предполагать наличие ИК можно при уровне СРБ более 83 мг/л. Похожие результаты получили и другие авторы. В работе [14] пороговое значение СРБ для ИК было равно 70 мг/л с чувствительностью 92% и специфичностью 81%. По данным T. Suwabe et al. [8], пороговый уровень СРБ составляет 150 мг/л [8], по данным M. Sallee et al. [3] – 50 мг/л.
Считаем, сравнительно высокое пороговое значение СРБ для ИК связано с несколькими причинами. Во-первых, ИК малого объема, которые ведут к умеренному повышению СРБ, трудно верифицируются при гистологическом исследовании, а диагностическая чрескожная пункция этих кист технически невыполнима. Во-вторых, во многих работах убедительно показано, что ТХПН, диализ ведут к хроническому, неинфекционному воспалению и это отражается на уровне СРБ [15, 16]. Так, например, в исследовании [16] средний уровень СРБ у 802 пациентов с ТХПН, получавших лечение гемодиализом без инфекционных заболеваний, составил 12,2±9,6 мг/л. И в-третьих, несмотря на отсутствие научных данных о том, что асептическое кровоизлияние в кисты почек может сопровождаться повышением уровня СРБ, мы, учтя наши данные, имеем основания предполагать и эту причину.
Несмотря на массу публикаций, утверждающих, что лейкоцитурия у пациентов с ТХПН не релевантна и не объективно отражает наличие инфекции мочевыводящих путей [17–19], мы отметили, что повышенный уровень лейкоцитов в моче достоверно ассоциировался с ИК, при этом связь двух факторов была относительно сильной (V=0,42).
В отличие от лейкоцитурии положительный посев мочи не являлся достоверно связанным фактором, что отмечено и в других работах. В исследовании [3] лишь в 39% случаев подтвержденной ИК был идентифицирован возбудитель в моче, в работе [13] – в 53% случаев. Таким образом, идентификация возбудителя ИК важна для назначения адекватной антибиотикотерапии, но диагностическая ценность этого метода ограниченна. Наиболее частым патогеном, вызывающим воспаление содержимого кист, является Escherichia coli, что необходимо учитывать при выборе антибактериальной терапии.
В связи с неоднозначными данными клинической картины, лабораторных методов, принимая во внимание далеко не всегда выполнимую диагностическую пункцию подозрительной ИК, методы визуализации остаются основополагающими в принятии решения о хирургической тактике в отношении пациентов с ТХПН. При этом в условиях ТХПН хирургическая тактика в большинстве случаев предусматривает нефрэктомию.
В настоящей работе мы не рассматривали диагностические характеристики УЗИ и МСКТ почек, так как, с одной стороны, во многих публикациях убедительно показано, что эти методы обладают низкой диагностической ценностью [3–5, 20], с другой – по протоколу нашего учреждения при подозрении на ИК у пациентов с АДПБП диагностика начинается с МРТ.
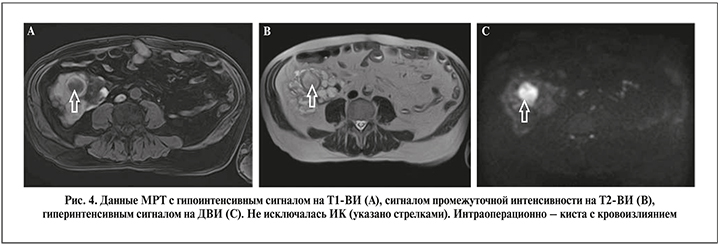
Оценку ДВИ при МРТ изначально стали использовать для идентификации ишемического инсульта [21]. В диагностике заболеваний почек, органов брюшной полости метод начал применяться с начала 2000-х гг. [21, 22]. Заключение о наличии ИК, как правило, делают при снижении интенсивности МР-сигнала на Т1-ВИ, повышении интенсивности на Т2-ВИ и рестрикции диффузии или, говоря другими словами, повышении сигнала на ДВИ [21, 22], однако данные изменения могут наблюдаться и при массе ложноположительных прогнозов [8]. В нашей работе специфичность МРТ составила всего 43,8%. С одной стороны, низкая специфичность была связана с тем, что снижение МР-сигнала на Т1-ВИ, повышение на Т2-ВИ и рестрикция диффузии были характерны не только для ИК, но и для кровоизлияния в кисту. При этом кровоизлияние, судя по клинической картине и результатам гистологического исследования, было либо острое, либо очень старое (рис. 4). Старое кровоизлияние макроскопически представляло собой желеобразную коричневую массу в просвете кисты. С другой стороны, низкая специфичность МРТ могла быть обусловлена невозможностью гистологической идентификации маленькой ИК в значительно увеличенной поликистозной почке.
Количественная интерпретация ИКД в практике широко не используется; оценивается, как правило, только категориальная характеристика: есть или нет снижения ИКД. Во многих работах показано, что воспалительные изменения в почках приводят к снижению ИКД.
J. H. Chan et al. [13] установили, что среднее значение ИКД при пионефрозе составило 0,64±0,35×10-3, при гидронефрозе – 2,98±0,65×10-3 мм2/с. R. Faletti et al. [12] сравнили ИКД в нормальной паренхиме трансплантированной почки и в воспалительных очагах, выявив 2-кратное снижение ИКД в воспалительных очагах до 1,43±0,32×10-3 мм2/с. По нашим данным, ИКД у пациентов с ИК также был достоверно ниже по сравнению с теми, у кого ИК не выявлено. Чувствительность параметра составила 78%, специфичность – 80%. Можно предположить, что количественная интерпретация ИКД может увеличивать специфичность МРТ, однако этот вопрос требует дальнейшего изучения.
Выводы
1. Лихорадка и боль в животе при пальпации почки пациентов с АДПБП служат поводом для обследования и исключения ИК. Для гистологически подтвержденной ИК характерно наличие лейкоцитурии, лейкоцитоза и повышение уровня СРБ более 83 мг/л.
2. При оценке результатов МРТ необходимо учитывать, что последовательность в виде снижения МР-сигнала на Т1-ВИ, повышения сигнала на Т2-ВИ и ДВИ обладает высокой чувствительностью (88,2%) и низкой специфичностью (43,8%). Повысить специфичность, вероятно, можно посредством дополнительной количественной оценки ИКД, чувствительность и специфичность которого составляют 78 и 80%.
3. При объеме кисты ИК менее 13 мл, особенно при локализации кисты внутри почки, вероятность обнаружения ИК при патоморфологическом исследовании крайне мала.
В таких ситуациях нефрэктомия должна выполняться только после информирования пациента о вероятности отсутствия признаков ИК при гистологическом исследовании.



