Введение. Мочекаменная болезнь (МКБ) занимает одно из ведущих мест по распространенности среди урологических заболеваний. Пик приходится на молодой и трудоспособный возраст – от 20 до 60 лет. Более 40% больных, проходящих лечение в урологических стационарах, страдают именно МКБ [1].
Широкая распространенность МКБ, регистрируемая за последние десятилетия, сопровождается значительным прогрессом в развитии хирургической техники лечения МКБ: внедрением перкутанной нефролитотрипсии (ПНЛТ), интраренальной ретроградной хирургии, дистанционной литотрипсии [2, 3].
Развитие инфекционно-воспалительных осложнений после ПНЛТ зачастую обусловлено наличием биопленок снаружи и внутри камня, что способствует высвобождению эндотоксина и других факторов патогенности возбудителей во время дробления камня [4]. Немаловажную роль играет и повышение внутрилоханочного давления во время выполнения ПНЛТ [5]. В процессе ПНЛТ запускается каскад межмолекулярных взаимодействий с участием провоспалительных и профибротических цитокинов, хемокинов, факторов роста, неоангиогенеза и эндотелиальной дисфункции, в том числе VEGF, IL-8, MCP-1, GM-CSF, G-CSF [6].
Остеопонтин (ОПН) получил широкое распространение в связи с возможностью его использования в качестве маркера с диагностической или прогностической ценностью, поскольку его секретируемые уровни могут быть измерены и сопоставимы с содержанием в тканях.
Остеопонтин был впервые идентифицирован в 1985 г. [7]. Название указывает на то, что белок экспрессируется в костях, но он также выделяется в плазму и мочу и обнаруживается в некоторых других тканях. Остеопонтин участвует в нескольких физиологических и патологических процессах, таких как обновление костной ткани [8], выживание клеток [9], иммунная регуляция и ответная реакция [10], воспаление [11], ишемия [12], ремоделирование тканей [13], прогрессирование опухоли [14] и заживление ран [15]. При воспалении остеопонтин действует как провоспалительный цитокин, модулируя иммунный ответ путем усиления экспрессии цитокинов Th1 [16].
Oстеопонтин экспрессируется в различных типах клеток и тканях, включая почки [17]. Внеклеточный ОПН функционирует посредством своего взаимодействия с множеством рецепторов клеточной поверхности, включая различные интегрины (avβ1, avβ3, avβ5, avβ6, α4β1, α5β1, α8β1 и α9β1) и CD44 [18, 19], тем самым регулируя клеточные процессы, такие как биоминерализация, ремоделирование тканей и иммунная регуляция [20–22].
Материалы и методы. В исследование включены 110 пациентов, находившихся на лечении в клинике урологии СарГМУ, с МКБ, а именно с конкрементами лоханки размером до 20 мм в максимальном измерении без значимых клинических признаков обструкции, плотность конкремента составляла от 720 до 1200 HU. С целью исключения ложноположительных результатов, обусловленных сопутствовавшей патологией, при включении пациентов в исследование мы придерживались строгих критериев: в исследование вошли лица обоих полов в возрасте от 20 до 48 лет без заболеваний сердечно-сосудистой системы, клинических проявлений атеросклероза, заболеваний опорно-двигательного аппарата, сахарного диабета. Все пациенты были оперированы в объеме ПНЛТ. Всем пациентам интраоперационно проводился мониторинг внутрилоханочного давления по предложенной авторами методике. Забор биологического материала (сыворотки крови и мочи) для иммуноферментного анализа выполняли на 0-е, 7-е и 30-е сутки после проведения оперативного вмешательства.
Оперативные вмешательства в случае классической ПНЛТ выполняли через кожух 30 Ch, предварительно проводили катетеризацию мочеточника торцевым катетером. При мини-ПНЛТ использовали мини-нефроскоп с диаметром рабочего канала 16 Ch. Пункцию полостной системы выполняли под сочетанным рентгеновским и ультразвуковым контролем через нижнюю группу чашек. Фрагментацию конкрементов осуществляли при помощи пневматического литотриптера Swiss LithoClast Master (производитель EMS) или воздействия тулиевым лазером FiberLase U2 IPG. Время работы в полостной системе почки составило от 6 до 32 мин. Все оперативные вмешательства заканчивали установкой нефростомического дренажа pig tail диаметром 10 Сh, который удаляли на 3–5-е послеоперационные сутки в зависимости от клинической ситуации.
Мониторинг интраоперационного давления осуществляли при помощи разработанной авторами методики (патент на изобретение № 2 788 282 C1). При создании пункционного хода помимо струн основной и страховой в полостную систему почки устанавливали гибкий датчик диаметром 550 нм в проводнике и таким образом напрямую мониторировали внутрилоханочное давление (рис. 1); конец датчика при этом находился у внутреннего среза кожуха, что позволяло наиболее точно оценивать внутрилоханочное давление, а также исключало повреждение датчика при тракции крупных фрагментов камня или воздействии энергии литотриптера. Мочеточниковый катетер оставался открытым, что являлось дополнительным каналом для дренирования лоханки.
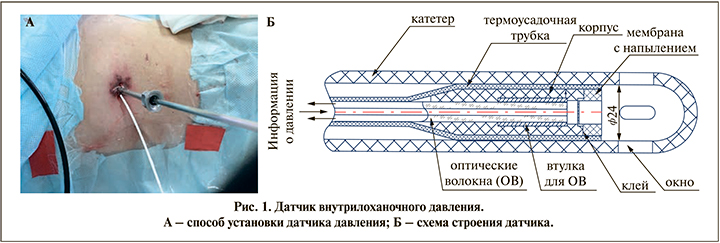
На основании результатов интраоперационного мониторинга в дальнейшем пациентов разделяли на две группы: с повышением внутрилоханочного давления (2-я группа) и без повышения внутрилоханочного давления (1-я группа). Критичным считали повышение давления выше 30 мм рт.ст., кроме того, регистрировали время превышения внутрилоханочного давления. В каждой группе в равных долях присутствовали пациенты, которым выполнялась ПНЛТ или мини-ПНЛТ. Содержание ОПН в плазме и моче измеряли с использованием коммерческого набора для иммуноферментного анализа Human Osteopontin ELISA Kit (Abcam, Великобритания), каталожный номер – ab 269374, чувствительность – 88 пг/мл. Лабораторное тестирование было проведено вслепую без информации о клинических данных.
Для статистического анализа данных применяли программу STATISTICA 10.0 и IBM SPSS Statistics 17. Распределение значений в выборках отличалось от нормального, поэтому в процессе статистической обработки использовались методы непараметрического анализа, которые включали вычисление медианы, квартилей вариационного ряда, максимальных и минимальных значений.
В качестве критерия достоверности различия между двумя независимыми группами использовался непараметрический критерий (U) Манна–Уитни.
Результаты. Клинически в группе пациентов с превышением внутрилоханочного давления интраоперационно в послеоперационном периоде имело место развитие пиелонефрита, сопровождавшееся явлениями гипертермии от 3 до 7 сут. у 70% пациентов, лейкоцитозом и лейкоцитурией у 100%. Количество геморрагических осложнений при ретроспективном анализе результатов лечения в обеих группах не различалось.
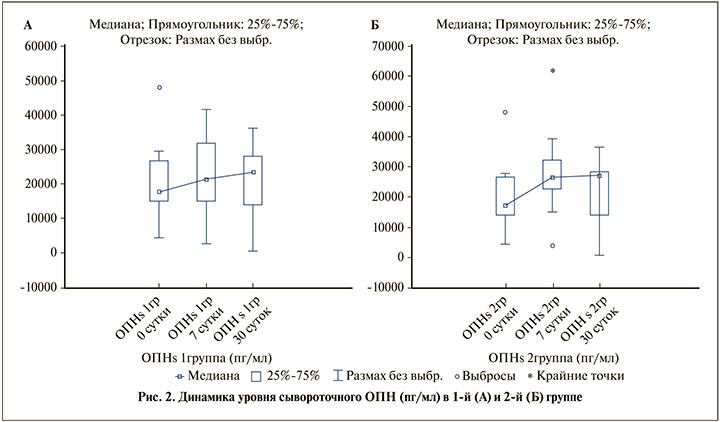
В 1-й группе отмечено повышение уровня сывороточного ОПН к 7-м и 30-м суткам, различия достоверны (р≤0,05) (рис. 2А). Во 2-й группе отмечено увеличение уровня сыворочного ОПН к 7-м суткам (р≤0,05) с дальнейшим незначимым нарастанием (р>0,05) (рис. 2Б).
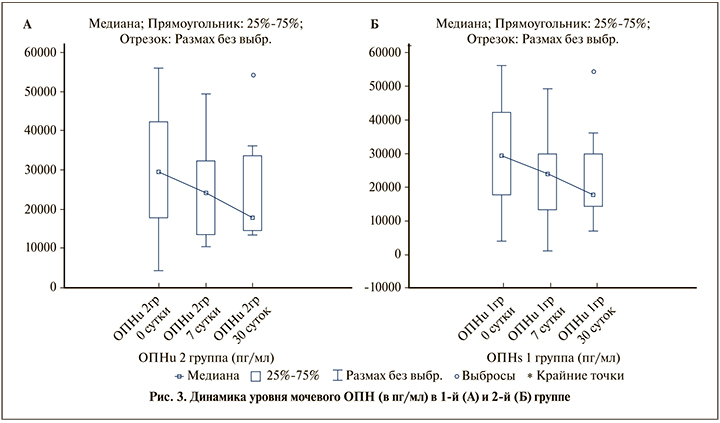
Мочевой ОПН имеет тенденцию к достоверному снижению к 7-м и 30-м суткам после операции в обеих группах (р≤0,05) (рис. 3А, Б).
В табл. 1 представлены медианы значения сывороточного ОПН 1-й и 2-й групп.
Помимо определения уровня маркера в моче для исключения влияния разведения (концентрирования) оценивали соотношение уровня исследуемого маркера к креатинину в той же порции мочи (в 1 мл). Информативность этого способа обусловлена тем, что концентрация креатинина в моче коррелирует со степенью гломерулярной фильтрации, а креатинин является мерой оценки концентрации мочи.

В динамике отмечено снижение мочевого ОПН, достоверно более выраженное в 1-й группе (р≤0,05) (табл. 2).
Обсуждение. При анализе полученных данных выявлено, что при исходно сопоставимых показателях сывороточного ОПН у пациентов 1-й группы имеется тенденция к повышению содержания данного маркера, которое сохраняется до 30 сут. послеоперационного периода. При этом достоверной зависимости полученных результатов от диаметра нефростомического хода не получено (р>0,05). Во 2-й группе уровень сывороточного ОПН достоверно превышал значения в 1-й группе также без зависимости от диаметра нефростомического хода. Уровень мочевого ОПН снижается после удаления конкремента из полостной системы почки от 0 до 30 сут. При этом также имеется достоверная зависимость показателей от величины интраоперационного внутрилоханочного давления (р≤0,05). Зависимости показателей мочевого ОПН от диаметра нефростомического хода не выявлено. Таким образом, вполне вероятно, что ОПН в моче в основном отражает локальное повреждение почек. Так, в работе [23] показана диагностическая роль мочевого ОПН в развитии тубулярного почечного повреждения. Динамика снижения данного маркера свидетельствует о стабилизации процессов повреждения и восстановлении почечной функции после ПНЛТ.
Напротив, ОПН плазмы крови является частью системной воспалительной реакции. Анализ показывает, что ОПН плазмы является частью сложной сети межбелковых взаимодействий в соответствии с существующими биоинформационными данными. Так, например, в группе про-оперированных пациентов по поводу колоректального рака повышенный послеоперационный уровень сывороточного ОПН был связан с развитием послеоперационных воспалительных осложнений, что свидетельствует об иммунных функциях ОПН [24]. В нашем исследовании также отмечено увеличение уровня сывороточного ОПН, коррелирующее с обострением пиелонефрита.
Заключение. Динамика снижения уровня мочевого остеопонтина свидетельствует о стабилизации процессов повреждения и восстановлении почечной функции после перкутанной нефролитотрипсии. Повышение содержания сывороточного остеопонтина связано с развитием послеоперационных воспалительных осложнений, что свидетельствует об иммунных функциях сывороточного остеопонтина.



