Введение. Бесплодие – неспособность сексуально активной, не использующей контрацептивы пары достичь беременности в течение 1 года [1]. За последние 20 лет количество инфертильных мужчин выросло с 30 до 50% [1–3].
Оксидативный стресс сегодня рассматривается как один из основных механизмов снижения мужской фертильности [4–6].
С учетом возможного этиопатогенеза мужского бесплодия в многочисленных исследованиях оценивалась эффективность терапии препаратами, содержащими вещества с антиоксидантной активностью, результаты этих работ оказались противоречивыми [7–12].
В последние годы активно изучается роль липидного состава мембран сперматозоидов в физиологических процессах оплодотворения [13–15]. Липиды являются структурным компонентом клеточных мембран и играют важную роль в функционировании клеточных систем [16]. Они выполняют структурную, сигнальную, транспортную и регуляторную функции в клетках [17–19]. Наиболее распространенной полиненасыщенной жирной кислотой (ПНЖК), содержащейся в мембране сперматозоидов, является докозагексаеновая кислота (ДГК), образующая до 30% ее липидного состава [13]. Уровень ДГК в клетках в значительной степени зависит от ее потребления с пищей [20].
В ряде исследований низкое содержание ДГК в сперматозоидах было ассоциировано с субфертильностью и бесплодием [21, 22]. Было показано, что терапия ДГК приводила к повышению текучести и гибкости мембран сперматозоидов [23] – качеств, необходимых для капацитации и акросомальной реакции [15]. Терапия препаратом ДГК приводила к снижению уровня фрагментации ДНК сперматозоидов [24].
Таким образом, применение ДГК в качестве терапии может улучшить функциональные параметры сперматозоидов посредством улучшения липидного состава их мембраны сперматозоидов [13].
Одной из функциональных характеристик сперматозоида является устойчивость к криогенному повреждению. Криоконсервация сперматозоидов является методом сохранения фертильности у ряда пациентов и находит свое применение в программах ВРТ [24, 25]. Общеизвестно, что криоконсервация сперматозоидов сопровождается повреждением сперматозоидов, что может сказываться на эффективности их применения в программах ВРТ [24].
Криоконсервация приводит к снижению содержания омега-3 ПНЖК, в т.ч. ДГК, и увеличению насыщенных жиров в мембране сперматозоидов, что в свою очередь приводит к повышению ригидности и снижению текучести мембран сперматозоидов и как следствие – к снижению оплодотворяющей способности [22, 26].
Таким образом, насыщение мембраны сперматозоида ДГК может приводить к увеличению его криотолерантности.
Бруди ПЛЮС («Бруди Технолоджи», Испания) – комплекс, содержащий стабилизированное и дезодерированное масло тунца с концентрацией ДГК не менее 70%, специально разработан для лечения идиопатических форм мужского бесплодия.
Целью настоящего исследования стала оценка влияния приема продукта Бруди Плюс на структуру сперматозоидов, фрагментацию ДНК сперматозоидов у инфертильных мужчин, а также оценка эффекта его приема на криотолерантность.
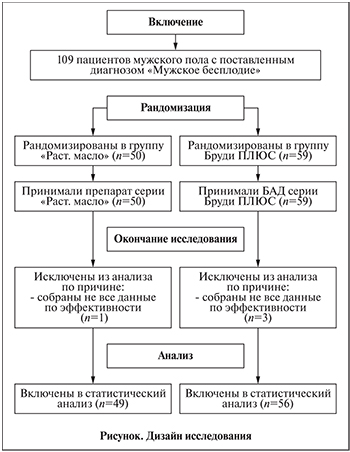
Материалы и методы. Дизайн исследования. Многоцентровое двойное слепое плацебо-контролируемое исследование. Для участия в исследовании были набраны 109 пациентов мужского пола в возрасте от 18 до 45 лет, которым ранее был установлен диагноз «мужское бесплодие».
Критерии включения:
- установленный диагноз – «мужское бесплодие».
Критерии исключения:
- наличие активных и хронических воспалительных процессов или проводимая терапия с применением антибиотиков в течение предшестовавших 3 мес.;
- олигоспермия;
- установленный диагноз «варикоцеле» или соответствующее лечение в течение последних 3 мес.;
- некрозооспермия;
- ранее перенесенные операции по поводу водянки яичка или лечения крипторхизма в анамнезе;
- наличие опухолевых процессов;
- генетические заболевания;
- вискозипатия, иммунное бесплодие.
В ходе исследования проводили регистрацию демографических, клинических и лабораторных данных пациентов, давших письменное согласие на обработку и использование в целях изыскательной работы своих персональных данных. Клинические методы диагностики включали сбор анамнеза, осмотр и физикальное обследование. Выполняли следующие лабораторные исследования: спермограмму в соответствии с требованиями ВОЗ от 2010 г., МАР-тест, оценку уровня фрагментации ДНК сперматозоидов, тест криотолерантности сперматозоидов, электронную микроскопию сперматозоидов (ЭМИС).
На визите 0 определяли возможность включения пациента в исследование в соответствии с обозначенными критериями включения/исключения. Проводили сбор жалоб, анамнеза жизни, демографических данных, физикальное обследование. Уточняли результаты предшествовавших медицинских обследований, верифицированные диагнозы, сведения о приеме лекарственных препаратов. Пациент получал направление в центральную лабораторию на сдачу материала. Результаты анализа оценивали в ходе визита 1 (рандомизация, день 1). В ходе визита врач также проводил опрос, подтверждал возможность участия пациента в исследовании и проводил процедуру рандомизации.
Рандомизацию осуществляли с помощью конвертов. Перед началом исследования врач получал два комплекта конвертов, один из которых был предназначен для рандомизации пациента, второй – для раскрытия группы терапии при необходимости.
В день рандомизации врач-исследователь выбирал конверт для рандомизации с наименьшим номером. Пациенту выдавался БАД с номером, указанным внутри конверта.
В случае необходимости раскрытия группы терапии врач-исследователь мог ознакомиться с информацией из конверта (комплект для раскрытия группы терапии) с номером, совпадающим с тем, что был выбран для выдачи БАД пациенту. В ходе исследования необходимости в раскрытии группы лечения пациента не возникало.
На визитах 2 (45-й день лечения ±4 дня) и 3 (90 дней лечения, завершение лечения) проводили оценку безопасности и приверженности пациента терапии. По завершении курса лечения пациент также получал направление в центральную лабораторию на сдачу материала.
 Результаты анализа регистрировали в ходе контрольного визита 4 (105±4 дня), в ходе которого также оценивали безопасность проведенной терапии.
Результаты анализа регистрировали в ходе контрольного визита 4 (105±4 дня), в ходе которого также оценивали безопасность проведенной терапии.
Таким образом, в ходе участия в программе максимальный срок наблюдения пациента врачом-исследователем составлял 113 дней.
В связи с потерей связи с пациентами и неявкой для сдачи контрольных анализов из исследования были исключены 4 пациента (см. рисунок).
Исследуемый комплекс и схема лечения. Бруди ПЛЮС («Бруди Технолоджи», Испания) – биологически активная добавка. Капсулы состоят из очищенного, стабилизированного и дезодорированного масла тунца. Одна капсула содержит 350 мг ДГК, до 500 мг других омега-3 жирных кислот, 0,45 мг антиоксиданта (смеси токоферолов [Е307]), 126,41 мг желатина, 48,14 мг глицерина (Е422).
Капсулы с плацебо содержали растительное масло производства компании «Бруди Технолоджи» (Испания).
Пациенты группы активного лечения принимали БАД по 1 капсуле 3 раза в сутки в течение 90 дней. Таким образом, суточная доза ДГК составила 1050 мг. Пациенты из конт-рольной группы принимали плацебо по аналогичной схеме.
Статистические методы. Обработку данных и все статистические расчеты проводили с использованием статистического пакета R v.3.3.3. Нормальность распределения оценивали посредством теста Колмогорова–Смирнова. Для сравнения показателей, имевших нормальное распределение, использовали Т-тест Стьюдента, показатели, распределение которых не соответствовало нормальному, сравнивали с помощью теста Манна–Уитни. Различие между сравниваемыми величинами признавали статистически значимым при р<0,05.
Результаты. Влияние на криотолерантность сперматозоидов. По окончании курса лечения в группе пациентов, принимавших Бруди ПЛЮС, прогрессивная подвижность сперматозоидов после теста на криотолерантность увеличилась. Средние изменения между группами статистически значимо не различались. Медианные изменения от визита 1 к визиту 4 между группами статистически неразличимы (табл. 1).

После проведенного лечения в группе пациентов, принимавших Бруди ПЛЮС, наблюдалось увеличение жизнеспособности после теста на криотолерантность. Средние и медианы изменения между группами статистически значимо различаются (табл. 2).
Влияние на ультраструктуру сперматозоидов. Влияние терапии на количество интактных головок нормальной формы с нормальным строением хроматина и акросомы. При анализе показателя было выявлено, что, несмотря на исходную разницу по данному показателю в начале лечения в 18,3%, после проведения терапии показатель достиг нормального значения лишь в группе Бруди ПЛЮС, тогда как в группе плацебо он имел отрицательную динамику и снизился на 45,3% (табл. 3).
Влияние терапии на количество сперматозоидов с недостаточно конденсированным незрелым хроматином. Исходно в группе плацебо определялся нормальный средний показатель числа сперматозоидов с незрелым хроматином, в группе Бруди Плюс он был превышен в среднем на 4,13. После курса лечения исследуемыми продуктами в группе Бруди Плюс он, напротив, нормализовался, тогда как отсутствие активного лечения в группе плацебо привело к увеличению показателя на 8,43 единицы и выходу его за границы допустимых значений (табл. 4).

Влияние на стандартные параметры эякулята и целостность генетического материала сперматозоидов. При сравнении данных группы активного лечения и плацебо по показателям объема, консистенции, pH, количества сперматозоидов в 1 мл эякулята, общего количества сперматозоидов в эякуляте, прогрессивной подвижности, непрогрессивной подвижности, неподвижных сперматозоидов, нормальных форм, патологических форм, незрелых клеток спермотозодов, уровня фрагментации ДНК сперматозоидов и процента сперматозоидов, связанных антиспермальными антителами, статистически значимой разницы выявлено не было.
Обсуждение. В ходе настоящего исследования с участием 105 пациентов была проведена оценка эффективности продукта Бруди ПЛЮС для пациентов с мужским бесплодием.
Результаты исследования показали положительное влияние Бруди ПЛЮС на прогрессивную подвижность и жизнеспособность сперматозоидов в криотолерантном тесте, что безусловно является следствием криопротективных свойств ДГК. Эти данные согласуются с результатами, полученными в исследованиях на животных моделях, где применение ДГК приводило к увеличению криотолернатности сперматозоидов [27, 28].
Анализ первых двух показателей может также говорить о том, что ДГК способствует восстановлению структуры митохондрий, которые обеспечивают сперматозоиды энергией, необходимой для их движения, а также стабилизирует фосфолипидные мембраны сперматозоидов. Такой эффект может быть обусловлен и антиоксидантной активностью этого вещества.
По данным ЭМИС и в нашем исследовании было выявлено положительное влияние терапии ДГК на целостность генетического материала сперматозоидов и их морфологию. В ходе лечения отмечалась выраженная положительная динамика количества интактных головок нормальной формы с нормальным строением хроматина и акросомы, количества сперматозоидов с недостаточно конденсированным незрелым хроматином.
В целом в данном исследовании получены результаты, которые могут говорить о положительном эффекте продукта Бруди Плюс на мужскую фертильность.
Заключение. Терапия с применение биологически активной добавки Бруди Плюс повышает криотолерантность, способствует нормальному формированию генетического материала и снижает частоту ультраструктурных нарушений сперматозоидов, что говорит о целесообразности применения данного продукта в лечении мужского бесплодия.



