Введение. Начиная со второй половины XX в. мировые демографические процессы в гендерном аспекте характеризуются двумя основными негативными трендами: более низкими продолжительностью и качеством жизни мужчин по сравнению с женщинами и увеличением «вклада» мужского бесплодия в браке. Доля мужского бесплодия с неизвестной причиной остается самой весомой среди причин бесплодия и составляет 30–40%. Такое бесплодие может быть вызвано несколькими факторами, включая в том числе и эндокринные дизрапторы (endocrine dysruptors, EDs) [1]. К наиболее известным эндокринным дизрапторам относятся диоксины, полихлорированные бифенилы, полибромированные дифениловые эфиры, пластификаторы – фталаты, а также такие нестойкие убиквитарные ксенобиотики, как бисфенол А (BPA), триклозан (TCS) и 4-нонилфенол (4-NP) [2].
Биомониторинг BPA, TCS и 4-NP осуществляется главным образом по образцам мочи. Вместе с тем уровень присутствия этих соединений в других тканях организма и эффект воздействия на них остаются малоизученными. В своих предыдущих работах мы показали негативное влияние ВРА и TCS, измеренных в семенной жидкости, на качество эякулята и отсутствие статистически значимых корреляционных связей между концентрацией 4-NP, измеренной в семенной жидкости, и параметрами спермограммы (концентрация, подвижность и морфология сперматозоидов) [3–5]. Следует отметить, что в литературе изучение эффектов ксенобиотиков на репродуктивную функцию представлено главным образом без учета их возможного совместного влияния [6–8]. В связи с этим представляется интересным оценить риск развития патозооспермии в зависимости от концентрации эндокринных дизрапторов в семенной жидкости при их совместном влиянии.
Материалы и методы. Проведено обсервационное одноцентровое одномоментное (поперечное) неконтролируемое исследование. В исследовании, проведенном в «ДНК-клинике» (Челябинск) с ноября 2017 по сентябрь 2018 г., приняли участие 84 мужчины. Пациенты обратились в клинику с целью выполнения спермограммы в связи с бесплодием в браке, невынашиванием беременности партнершей, а также планированием беременности или донорством спермы. Все пациенты были жителями Челябинска или Челябинской области.
Критерии включения в исследование: мужчины в возрасте 22–40 лет, наличие бесплодия неустановленной природы, репродуктивные потери в супружеской паре с патозооспермией, планирование беременности в супружеской паре с нормозооспермией, доноры спермы, подписанное информированное добровольное согласие на включение в данное исследование.
Критерии исключения из исследования: варикоцеле, инфекционно-воспалительные заболевания урогенитального тракта, вызванные патогенными и/или условно-патогенными микроорганизмами, лейкоцитоспермия, МАР-тест (mixed antiglobulin reaction, смешанный антиглобулиновый тест) выше 10%, азооспермия, дефицит тестостерона, другие эндокринные и онкологические заболевания любой локализации, ВИЧ-инфекция, системные заболевания, неподписанное информированное добровольное согласие на участие в исследовании.
Всем пациентам выполнено лабораторное исследование эякулята после 3–4 дней воздержания от семяизвержений. Спермиологическое исследование проводили согласно рекомендациям ВОЗ (2010). Заключение по спермограмме, нормозооспермия или патозооспермия, основывалось на критериях, изложенных в тех же рекомендациях ВОЗ (2010) [9].
В ходе спермиологического исследования оценивали общее количество, концентрацию, подвижность, морфологию нормальных форм сперматозоидов по Крюгеру. Для оценки индекса фрагментации ДНК сперматозоидов использовали метод дисперсии хроматина сперматозоидов (spermchromatin dispersion, SCD) с помощью набора GoldCytoDNAAssistKit. Нормативным значением степени фрагментации ДНК сперматозоидов считали менее 15% (низкий риск нарушения фертильности и вынашивания в супружеской паре). ВРА, TCS и 4-NP в семенной жидкости определяли на газовом хроматографе с масс-спектрометром Shimadzu GCMS-QP2010Ultra («Shimadzu Corporation», Япония). Полученные данные обрабатывали с помощью программы GCM Ssolution 4,3 («Shimadzu Corporation», Япония). Ультразвуковое исследование органов мошонки выполняли на аппарате Mindray DC-7 (Китай) в положении пациента лежа и стоя во время андрологического приема.
Исследование одобрено Локальным комитетом по этике ФГБОУ ВО ЮУГМУ Минздрава России.
Размер выборки предварительно не рассчитывался. Статистический анализ полученных данных выполнялся с помощью программы IBM SPSS Statistics v.21 (IBM Corp., Armonk, NY, США). Проверка нормальности распределения переменных проводилась с учетом объема выборки с использованием критерия Колмогорова–Смирнова или Шапиро–Уилка. Результаты исследования представлены как медиана с интерквартильным размахом Me (Q1-Q3) или как средняя со стандартным отклонением (M ± σ) при нормальном распределении выборки. Для определения статистически значимых различий между группами использовался U-критерий Манна–Уитни. Для построения прогностической модели совместного влияния эндокринных дизрапторов (ВРА, TCS и 4-NP) на риск развития патозооспермии и оценки ОШ (отношение шансов) для каждого эндокринного дизраптора использовался метод множественной логистической регрессии. Различия между группами считались статистически значимыми при р<0,05 и/или отсутствии единицы в ДИ (доверительный интервал) при расчете ОШ.
Результаты. Из 84 пациентов, принявших участие в исследовании, 42,9% были с нормозооспермией – планировали беременность партнерши в браке или являлись донорами спермы, и 57,1% с формой бесплодия неустановленной природы и/или репродуктивными потерями в супружеской паре при различных вариантах патозооспермии: тератозооспермии (28,6%), астенотератозооспермии (14,3%), олиготератозооспермии (8,3%), ОАТ-синдроме (3,6%) и олигоастенозооспермии (2,4%). Средний возраст пациентов (±σ) составил 30,8±3,9 года, средний индекс массы тела (ИМТ) – 25,4±2,9 кг/м2, при этом 42% пациентов были с избыточной массой тела и 11% – с ожирением I степени (ИМТ >30 кг/м2).
По результатам оценки качества образцов эякулята мужчины были разделены на две группы: в первую вошли пациенты с нормозооспермией (n=36), во вторую – с патозооспермией (n=48). Группы для сравнительного анализа были сопоставимыми по возрасту, периоду воздержания от семяизвержений, ИМТ, курению и приему алкоголя (табл. 1).

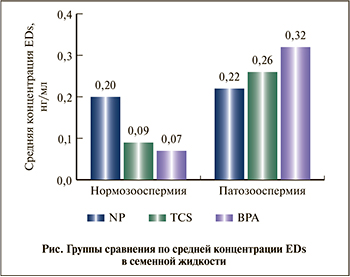
В 100% образцов эякулята был обнаружен ВРА со срединной концентрацией 0,150 (0,06–0,29) нг/мл. Триклозан и 4-NP были обнаружены в 84,3 и 98,1% образцов эякулята соответственно со срединной концентрацией 0,11 (0,05–0,21) и 0,16 (0,06–0,40) нг/мл соответственно. Группы пациентов статистически значимо различались по концентрации ВРА и TCS в семенной жидкости, а также по индексу ДНК-фрагментации сперматозоидов (табл. 1).Так, у мужчин с нормозооспермией концентрация ВРА и TCS в семенной жидкости оказалась меньше, чем у мужчин с патозооспермией (табл. 1, рисунок). То же было справедливо и в отношении индекса фрагментации ДНК сперматозоидов – 14,0 (8,0–15,0) против 18,0 (14,5–25,0). По содержанию 4-NP в семенной жидкости группы статистически значимо не различались (р=0,766).
 С целью оценки совместного влияния эндокринных дизрапторов (ВРА, TCS и 4-NP) на риск развития патозооспермии у мужчин мы использовали метод множественной логистической регрессии. Наблюдаемая зависимость может быть описана следующим уравнением:
С целью оценки совместного влияния эндокринных дизрапторов (ВРА, TCS и 4-NP) на риск развития патозооспермии у мужчин мы использовали метод множественной логистической регрессии. Наблюдаемая зависимость может быть описана следующим уравнением:
z = -3,13 + 32,36ВРА + 6,86TCS - 5,19NP,
где p – вероятность наличия патозооспермии; е (экспонента) – постоянная приблизительно равная 2,7; z – мера полного вклада всех факторов риска (BPA, TCS и 4-NP), используемых в прогностической модели; ВРА – концентрация бисфенола А в семенной жидкости (нг/мл);
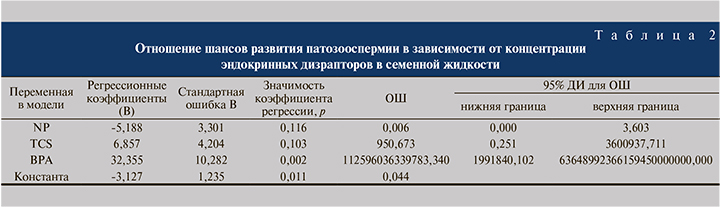
TCS – концентрация триклозана в семенной жидкости (нг/мл); 4-NP – концентрация 4-нонилфенола в семенной жидкости (нг/мл). Исходя из значений регрессионных коэффициентов, факторы ВРА и TCS имеют прямую связь с вероятностью развития патозооспермии, 4-NP – обратную связь. Полученная модель статистически значима (p<0,001). Однако в данном уравнении только коэффициент для ВРА вместе с константой оказался статистически значимым. Исходя из значения коэффициента детерминации Найджелкерка, модель учитывает 69,4% факторов, определяющих вероятность развития патозооспермии. Диагностическая эффективность модели составила 86% с 82%-ной чувствительностью и 88%-ной специфичностью. Отношение шансов (ОШ) позволяет оценивать шанс развития патозооспермии при изменении концентрации одного из эндокринных дизрапторов на единицу при фиксации остальных переменных модели. Так, при увеличении концентрация ВРА в семенной жидкости на 0,1 нг/мл при фиксации концентраций других дизрапторов шанс развития патозооспермии возрастает в 24,9 раза (е(0,1×32,355)). При увеличении концентрации TCS в семенной жидкости на 0,1 нг/мл при фиксации концентраций других дизрапторов шанс развития патозооспермии возрастает только в 1,98 раза (е(0,1×6,857)), при этом ДИ для ОШ включает единицу. С увеличением концентрации 4-NP в семенной жидкости на 0,1 нг/мл шанс развития патозооспермии снижается (е(-0,1×5,188)), так как ОШ = 0,59 (95% ДИ – 0,0–3,6), при этом ДИ для ОШ также включает единицу (табл. 2).
Обсуждение. Полученные результаты позволяют предположить, что развитие патозооспермии связано в первую очередь с действием ВРА в семенной жидкости, и сделать заключение об отсутствии синергического эффекта данных ксенобиотиков на качество эякулята у мужчин. Интересно отметить, что влияние трех изученных эндокринных дизрапторов на развитие патозооспермии оказалось разнонаправленным и неодинаковым по силе. В случае ВРА иTCS связь с патозооспермией была прямой, в случае с 4-NP – обратной. Можно предположить, что 4-NP, обнаруживаемый в семенной жидкости в интервале концентраций 0,06–0,40 нг/мл (95% ДИ данного исследования), будет иметь обратную связь с патозооспермией – другими словами, играть «протективную роль».
Известно, что организм человека одновременно подвержен воздействию смеси десятков или даже сотен EDs (коэргизм ксенобиотиков, «токсический коктейль»), в разных дозах и в разные периоды жизни, включая самые ранние и самые чувствительные периоды развития. В одних случаях обнаруживается взаимопотенцирующий эффект, в других – его ослабление вследствие антагонизма отдельных ксенобиотиков [10–12].
В настоящее время известно, что и чрезвычайно малые дозы EDs могут приводить к биологическим изменениям, а последствия воздействия малых доз EDs нельзя экстраполировать на ситуацию с воздействием больших доз EDs на организм, и наоборот. В связи с этим выдвигается гипотеза о немонотонном ответе на дозу EDs (NMDR, non-monotonicdose-response). Это означает, что ответ (негативный) не всегда повышается/снижается при повышении/снижении дозы и имеет форму U-образной или перевернутой U-образной кривой [12, 13]. Отсутствие так называемой безопасной дозы EDs необходимо иметь в виду при установлении связи между влиянием EDs и возникновением заболевания или функциональных дисбалансов, что представляется более корректным, в противовес связывания возникновения болезни с воздействием одного конкретного ксенобиотика в определенной дозе.
Заключение. Влияние эндокринных дизрапторов может иметь прямую и обратную зависимость с патологическим процессом (патозооспермией), что, вероятно, связано в том числе с концентрацией ксенобиотика в тканях организма. Риск развития патозооспермии у мужчин в первую очередь связан с влиянием бисфенола А, а не триклозана и 4-нонилфенола. Вместе с этим можно предположить отсутствие синергического эффекта бисфенола А, триклозана и 4-нонилфенола с точки зрения повышения риска развития патозооспермии у мужчин.



