Введение. Пиелонефрит остается самым частым заболеванием почек во всех возрастных группах, причем в 25–30% случаев течение острого пиелонефрита осложняется развитием гнойно-деструктивных форм (апостематозный пиелонефрит, абсцесс и карбункул почки), которые нередко (до 50%) приводят к нефрэктомии. Послеоперационная летальность при этом достигает 28,4% [1].
На фоне имеющейся тенденции к увеличению заболеваемости пиелонефритом и его септических проявлений в виде гнойно-деструктивных форм проблема адекватной диагностики поражений почек остается весьма актуальной [2]. Для дифференциальной диагностики острого пиелонефрита разработан диагностический алгоритм [3, 4]. С целью упрощения дифференциальной диагностики серозной и гнойной стадий острого пиелонефрита Л. А. Синяковой были разработаны критерии, включившие клинические симптомы, результаты лабораторных исследований мочи и крови, рентгенологического и ультразвукового исследований [5]. В настоящее время широкое применение находят современные высокотехнологичные методы исследования, которые позволяют оценивать структурно-функциональное состояние почечной паренхимы на принципиально ином, максимально приближенном к морфологическому уровню диагностики. К ним относят УЗ-допплерографию, магнитно-резонансную (МРТ), мультиспиральную компьютерную томографии (МСКТ) [6]. Однако, к сожалению, не всегда с полной уверенностью на основании результатов объективного осмотра и анализа лабораторно-инструментальных данных можно дифференцировать серозную и гнойную стадии острого пиелонефрита [7].
Цель исследования: разработать дополнительный критерий для объективизации гнойно-деструктивной формы острого пиелонефрита.
Материалы и методы. Были обследованы 35 пациентов (26 женщин, 9 мужчин) с острым пиелонефритом в возрасте от 19 до 85 лет (средний возраст – 52 года). Обследование включило сбор анамнеза, выявление клинических симптомов, в том числе болезненности в области почек, общие анализы крови и мочи, а также рентгенологическое и ультразвуковое исследования. Наряду с этим у всех пациентов брали кровь из локтевой вены стерильным одноразовым шприцем и переливали ее в пробирку с антикоагулянтом. Изучение образцов крови проводили с помощью классического бактериологического метода и молекулярно-генетической флуоресцентной in situ гибридизации (FISH). При бактериологическом методе для идентификации гемокультур использовали тест-системы Enterotest-24, Staphytest («Lachema», Чехия). При FISH использовали ДНК-зонды, комплементарные видоспецифическим участкам гена 16S рРНК микроорганизмов Oligo 1 (Enterobacteriaceaе), Oligo 3 (Staphylococcus aureus), Oligo 5 (S. epidermidis) Oligo 6 (Staphylococcus spp.)). Данные зонды синтезировали в ООО «ДНК-синтез» (Москва) и на 5’-конце пометили флуоресцеинаизотиоцианатом (FITC). Кровь больных обрабатывали по методу, описанному в работе Е. А. Щупловой и соавт. [8]. Далее с помощью конфокального лазерного сканирующего микроскопа (КЛСМ) определяли количество адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий.
Статистический анализ полученных результатов проводили с помощью программы Statistica 6.0. Для оценки различий (р) использовали критерий (t) Стьюдента, различия считали значимыми (достоверными) при р<0,05.
Результаты. У всех 35 обследованных пациентов наблюдали гипертермию. В клиническом анализе крови отмечали лейкоцитоз (12,4±3,8×109/л) со сдвигом лейкоцитарной формулы влево, в анализе мочи – лейкоцитурию, бактериурию. При УЗИ у всех пациентов выявлены признаки острого пиелонефрита. Полученные клинические и лабораторно-инструментальные результаты служили показанием к микробиологическому исследованию крови, по результатам которого только у 1 (2,9%) пациента удалось выделить гемокультуру (монокультуру), которую с помощью биохимических тестов идентифицировали как Escherichia coli.
Однако недостатком бактериологического метода является длительность культивирования посевов до 5–7 сут., длительное время для идентификации чистой культуры с помощью различных биохимических тестов, а также проведение теста на выявление резистентности к антибиотикам. Кроме того, известно, что эффективность бактериологического метода даже при уросепсисе составляет около 45% [2, 9].
В связи с этим в данной работе для обнаружения микроорганизмов в образцах крови обследуемых больных параллельно был использован современный молекулярно-генетический метод флуоресцентной in situ гибридизации. Чувствительность данного метода составляет 95% [10], время для исследований сокращается до 8–12 ч, не требуется выделения гемокультуры, можно сразу использовать образец крови. Метод FISH позволяет одновременно проводить идентификацию микроорганизмов, так как ДНК и рРНК бактерий гибридизируются с ДНК-зондами, комплементарными таксонспецифическим участкам гена 16S рРНК [10].
С помощью люминесцентной микроскопии исследовано 35 образцов крови от больных острым пиелонефритом. Результаты исследования показали, что только у 5 (14,3%) из 35 обследуемых больных выявили свечения от ДНК-зондов в образцах крови, причем было обнаружено 207 специфических свечений от разных ДНК-зондов, что свидетельствовало о развитии полимикробной инфекции. В образцах крови обследуемых больных выявляли одновременно свечения от двух зондов (т.е. двух ассоциантов бактерий), свечения одновременно трех зондов не встречалось. В результате исследования оказалось, что в 2,4 раза чаще в образцах крови обследуемых больных острым пиелонефритом встречались ассоциации представителей семейства Enterobacteriaceaе с S. aureus, чем представителей семейства Enterobacteriaceaе с S. epidermidis (24,8±5,6 против 10,2±4,5% соответственно, р<0,05).
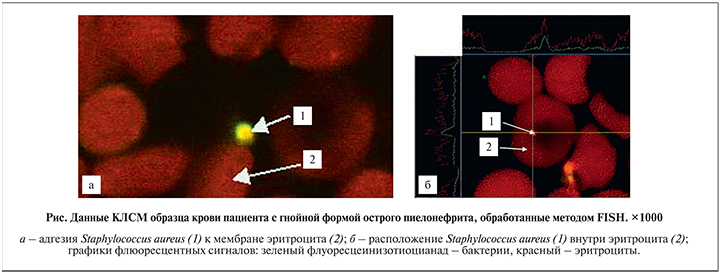
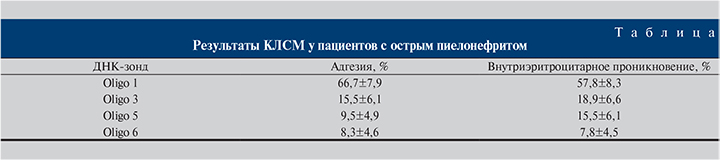
На следующем этапе работы с использованием КЛСМ выявили количество адгезированных бактерий к поверхности эритроцитов, а также их внутриэритроцитарное проникновение в образцах крови больных острым пиелонефритом (см. таблицу).
В результате исследования 35 образцов крови оказалось, что в 30 свечений не обнаружено, т.е. бактерии в образцах крови отсутствовали, тогда как у 5 обследованных наблюдали как свечение адгезированных бактерий на поверхности эритроцитов, так и их внутриэритроцитарное расположение. При изучении процесса адгезии бактерий к поверхности эритроцитов оказалось, что в 8 раз чаще наблюдали свечение от ДНК-зонда, характерного для представителей семейства Enterobacteriaceaе (Oligo 1), чем от Oligo 6 (р<0,05). В 1,6 раза чаще было выявлено свечение с Oligo 3 (S. aureus) (см. рисунок, а), чем с зондами, комплементарными таксон-специфическим участкам гена S. еpidermidis, и в 1,9 раз чаще, чем с представителями рода Staphylococcus spp.
При изучении внутриэритроцитарного расположения бактерий (см. рисунок, б) в образцах крови больных острым пиелонефритом оказалось, что в 57,8±8,3% случаев наблюдали внутриэритроцитарное расположение бактерий – представителей семейства Enterobacteriaceaе, что в 3 раза чаще, чем S. aureus (Oligo 3), и в 7,4 раза чаще, чем представителей рода Staphylococcus spp.
По результатам исследования провели статистический анализ, который показал, что если в образцах крови больных острым пиелонефритом обнаруживают ≥5 адгезированных на поверхности эритроцитов и ≥2 внутриэритроцитарно расположенных бактерий, то у больных выявляют развитие гнойной стадии острого пиелонефрита. Если в крови отсутствует специфическое свечение от ДНК-зондов, то у больных – серозная стадия острого пиелонефрита.
В дальнейшем у пятерых обследуемых больных, у которых с помощью метода FISH обнаружены и идентифицированы микроорганизмы, через 3 сут. было выполнено повторное ультразвуковое исследование и компьютерная томография почек. В результате исследования у пациентов наблюдали неоднородные гипоэхогенные образования, окруженные эхогенными контурами инфильтрированной паренхимы. Чашечно-лоханочная система у всех обследуемых больных была деформирована. Выставлен клинический диагноз «острый гнойный пиелонефрит»: абсцесс почки (n=1), карбункул почки (n=1), апостематозный нефрит (n=3). Всем больным было проведено оперативное вмешательство, в результате которого диагноз был подтвержден.
Таким образом, результаты данной работы показали, что использование метода FISH позволяет дифференцировать серозную и гнойную стадии острого пиелонефрита с возможностью обнаружения и одновременной идентификации микроорганизмов (по известным ДНК-зондам), находящихся как на поверхности, так и внутри эритроцитов в образцах крови больных острым пиелонефритом.
Обсуждение. Дифференциальная диагностика серозной и гнойной стадий острого пиелонефрита достаточна сложна. Несмотря на существующие диагностические критерии, далеко не всегда врач может вовремя поставить точный диагноз. По мнению З. С. Вайнберга [11], каждый больной с подозрением на наличие гнойного процесса в почках «в известной степени есть кроссворд, и от умения врача находить единственно правильные ответы и решения зависит жизнь пациента».
Результаты работы показали, что существующие критерии в диагностике острого пиелонефрита не достаточно объективные и точные, необходимо использовать дополнительные методы для дифференциации серозной и гнойной стадий данного заболевания.
Классический бактериологический метод в диагностике острого пиелонефрита применяют для обнаружения колониеобразующих единиц в 1 мл (КОЕ/мл) свежевыпущенной мочи [7] и крайне редко используют для исследования образцов крови пациентов. Результаты данной работы показали, что при диагностике острого пиелонефрита имеется необходимость применения дополнительных методов для выявления микроорганизмов в кровотоке обследуемых больных, причем для обнаружения гемокультуры более точный и быстрый по времени оказался современный молекулярно-генетический метод FISH. По этиологической значимости первостепенное место занимали представители семейства Enterobacteriaceaе, на втором месте оказался S. aureus. Полученные результаты нашли подтверждение в литературе [7, 12], где отмечается, что при гнойном пиелонефрите основными возбудителями являются грамотрицательные условно-патогенные микроорганизмы (76,9%).
Таким образом, использование современного молекулярно-генетического метода флуоресцентной in situ гибридизации в диагностике острого пиелонефрита можно рекомендовать как дополнительный критерий для дифференциации серозной и гнойной стадий заболевания.
Заключение. Предложен дополнительный диагностический критерий для выделения пациентов с серозной и гнойной формами острого пиелонефрита, заключающийся в определении количества адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий, обнаруженных с помощью современного молекулярно-генетического метода флуоресцентной in situ гибридизации. Метод FISH позволяет обнаружить и одновременно провести идентификацию микроорганизмов, так как ДНК и рРНК бактерий гибридизуется с ДНК-зондами, комплементарными таксонспецифическим участкам гена 16S рРНК микроорганизмов. Другим преимуществом FISH является возможность проведения дифференциальной диагностики серозной и гнойной стадий острого пиелонефрита по образцам крови обследуемых больных без выделения гемокультуры.



