Введение. Инфекции мочевыводящих путей (ИМП) не теряют актуальности и являются одними из наиболее распространенных инфекций в повседневной клинической практике [1]. К примеру, по данным Французского национального агентства по безопасности лекарственных средств и изделий медицинского назначения, ИМП в настоящее время занимают третье место среди амбулаторных назначений антибиотиков во Франции [2]. В Российской Федерации за последние годы эпидемиологических исследований по циститу не проводилось.
ИМП является частой причиной обращения за медицинской помощью и назначения противомикробных препаратов. Около 60% женщин хотя бы раз в жизни перенесли ИМП, у 30–40% ИМП имеют рецидивирующий характер (РИМП) и значительно снижают качество жизни [3].
В частности, в Австралии ежегодно по поводу РИМП госпитализируют более 76 тыс. пациентов, что влечет расходы в размере 909 млн австралийских долларов [4, 5]. Назначения антибиотиков при бессимптомной бактериурии людям без специфических факторов риска в настоящее время повсеместно не рекомендуется, однако происходит с удручающей частотой, что вызывает опасения по поводу роста глобальной множественной антибиотикорезистентности уропатогенов [6–8]. Во многих клинических руководствах в профилактике ИМП рекомендуется обходиться без антибиотиков, используя вагинальные эстрогены у женщин в постменопаузе, препараты клюквы, иглоукалывание и иммуноактивную профилактику [9–11].
Неоправданно широкое применение антибиотиков, нередко не оптимальное, идущее вразрез с клиническими рекомендациями, не только приводит к селекции устойчивых штаммов уропатогенов с повышенной вирулентностью, но и маскирует туберкулез мочеполовой системы [12, 3].
В структуре ИМП отмечено преобладание хронического рецидивирующего цистита с частыми обострениями [14, 15]. По данным ранее проведенного нами исследования из 3459 пациенток амбулаторного урологического приема по поводу острого цистита обратились 284 (8,2%) пациентки, а по поводу хронического цистита – более чем в 2 раза больше (655 больных – 18,9%) [15]. Возникают закономерные вопросы. Почему у некоторых женщин острый цистит возникает однократно, а у других переходит в хроническую форму заболевания? От чего зависит частота рецидивов цистита? Являются ли антропометрические особенности предпосылкой развития цистита, влияют ли на его течение и частоту рецидивов? Стандартно факторами риска развития хронического цистита являются эктопия наружного отверстия уретры, сахарный диабет, эстрогенодефицит. Но только ли эти факторы влияют на частоту рецидивов и результаты терапии? И как продлить безрецидивный период заболевания?
Не пытаясь объять необъятное, в настоящем исследовании мы попытались найти ответ на вопрос: достаточно ли антибактериальной терапии, или необходимы меры патогенетического воздействия?
Перспективным направлением в лечении ИМП является применение отечественного препарата Суперлимф®, представляющего собой коктейль природных антимикробных пептидов и цитокинов; его эффективность подтверждена рядом исследований [16, 17]. В нашей работе мы оценивали непосредственные результаты применения Суперлимф® в проспективном многоцентровом рандомизированном сравнительном контролируемом исследовании, в которое была включена 91 пациентка [17].
Цель настоящей работы – определить отдаленные результаты комбинированной этиопатогенетической терапии больных хроническим циститом, включившей ректальные суппозитории Суперлимф® в дозе 10 и 25 ЕД.
Материалы и методы. В проспективное многоцентровое (клинические базы Новосибирского, Алтайского, Омского медицинских университетов, отделенческая клиническая больница РЖД, Барнаул) рандомизированное сравнительное контролируемое исследование была включена 91 пациентка. Когорта больных случайным методом была распределена в три группы: первая группа сравнения (контрольная) ГС-1 – 32 человека, все пациентки этой группы получали только базовую антибактериальную терапию в течение 5 дней, 2-я группа сравнения ГС-2 – 28 человек (больные этой группы получали базовую терапию плюс Суперлимф® в виде ректальных суппозиториев в дозе 25 ЕД однократно в день в течение 10 дней) и основная группа ОГ – 31 человек, который получал базовую терапию в сочетании с применением ректальных суппозиториев Суперлимф® в дозе 10 ЕД 1 раз в день в течение 20 дней.
Базовая антибактериальная терапия во всех трех группах была идентичной: фосфомицина трометамол 3,0 г на ночь однократно и фуразидин по 100 мг трижды в день после еды в течение 5 дней. Комбинация антибиотика фосфомицин с антибактериальным химиопрепаратом фуразидин обусловлена следующими соображениями. Если при остром неосложненном цистите хороший и быстрый эффект можно получить при антибактериальной монотерапии препаратом первого выбора (фосфомицин или нитрофуран), то в случае развития хронического цистита, который вызывается реинфекцией и суперинфекцией, необходим комплексный подход. Монотерапия при хроническом цистите вследствие формирования биопленок, тем более внутриклеточной персистенции E. coli может оказаться недостаточно эффективной, о чем свидетельствует большая частота рецидивов у женщин, больных хроническим циститом, получающих стандартную терапию. Одновременный прием больной хроническим циститом фосфомицина трометамола 3,0 г однократно и фуразидина в течение 5 дней в качестве эмпирической терапии имеет ряд преимуществ, поскольку покрывает весь возможный спектр возбудителей, а также перекрывает потенциально возможную лекарственную устойчивость уропатогена у больных хроническим циститом, уже получавших много курсов антибактериальной терапии. Кроме того, комбинация антибиотика и химиопрепарата действует на патоген с разных позиций, что минимизирует риск образования биопленки и ухода возбудителя в состояние персистенции. Клинические рекомендации дают четкие и недвусмысленные указания по лечению больных острым неосложненным циститом, в отношении же хронического цистита рекомендации более осторожные.
Оценку непосредственной эффективности лечения проводили путем анализа лабораторных показателей (общий анализ мочи, посев мочи на микрофлору), анализа самостоятельно заполненной шкалы симптомов острого цистита Acute Cystitis Symptom Score (ACSS); также определяли в динамике показатели локальной микроциркуляции, измеренной при помощи лазерной допплерфлоуметрии (ЛДФ) в области наружного отверстия уретры и на уровне ее середины трансвагинально. Для оценки отдаленных результатов пациентки приглашались на контрольное обследование через 6 мес. после окончания терапии.
Результаты исследования были обработаны с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office, 2007. Все количественные данные описывались как среднее (М)±стандартное отклонение (SD). При описании качественных данных использовали абсолютные значения (n) и проценты (%). Гипотеза об отсутствии статистически значимого влияния фактора отвергалась при р>0,05.
Результаты. Через полгода для оценки отдаленных результатов на прием пришли 82 (90,1%) женщины из 91, включенной в исследование. Уточнить причину неявки остальных не представилось возможным.
Среди 82 больных 28 (87,5% от исходного количества) были из первой группы сравнения (ГС-1); эти пациентки получали комбинацию антибактериальных препаратов без патогенетической поддержки. Остальные 54 пациентки в равном количестве относились ко 2-й группе сравнения (ГС-2) – 27 больных (96,4% от исходного количества) и к основной группе (ОГ) – также 27 больных (87,1% от исходного количества).
Контрольное обследование установило картину, представленную в таблице.
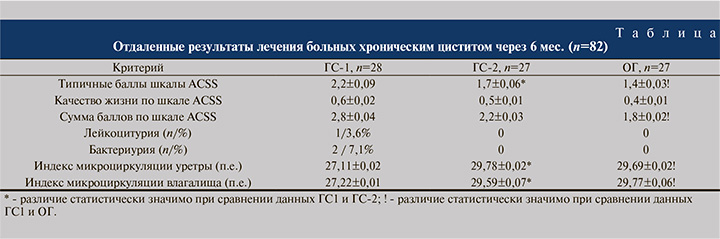
У всех пациенток на момент включения в исследование заболевание отвечало критериям понятия «рецидивирующий (хронический) цистит», то есть обострение развивалось как минимум дважды за последние полгода или трижды за год. После терапии в ГС-1 за истекшие полгода рецидив заболевания развился у 17 (60,7%) больных в среднем через 67,3±9,4 дня, а у 9 пациенток в течение 6 мес. проявлений заболевания не наблюдалось. В ГС-2 рецидив цистита наблюдался у 12 (44,4%) пациенток, причем безрецидивный период был дольше – в среднем 84,3±9,2 дня.
У 15 пациенток за время наблюдения обострений цистита не возникло. Наилучшие результаты продемонстрировали пациентки ОГ, которые помимо базовой терапии дополнительно получали Суперлимф® в дозе 10 МЕ ректально в течение 20 дней. Безрецидивный период у них продолжался в среднем 123,5±8,7 дня, и рецидив развился всего у 8 (29,6%) пациенток. У 19 (70,4%) больных этой группы признаков заболевания после завершения лечения в течение полугода не наблюдалось, хотя до получения комбинированной этиопатогенетической терапии с использованием ректальных суппозиториев Суперлимф® они обращались к врачу по поводу обострения цистита как минимум дважды за последние полгода или трижды в течение года. Различия между группами высокодостоверны (p<0,001). Во всех группах ни у одной больной за период наблюдения не было более одного обострения заболевания.
Сравнительная частота появления рецидива цистита показана на рис. 1.

При развитии рецидива цистита пациентки получали ту же терапию, в том же объеме, что и при включении в исследование. Среднюю продолжительность «холодного» безрецидивного периода в группах демонстрирует рис. 2.
Обсуждение. Инфекции мочевыводящих путей, в частности РИМП, лечат специалисты различных специальностей, включая терапевтов, педиатров, гериатров, инфекционистов, гинекологов и урологов. Различные руководства профессиональных сообществ были разработаны и опубликованы, чтобы помочь стандартизировать лечение, основанное на доказательствах. Однако остаются значительные области неопределенности, а также различия в силе и содержании рекомендаций.
Был проведен сравнительный анализ рекомендаций по ведению больных рецидивирующими инфекциями мочевыводящих путей основных девяти урологических и неурологических организаций [11]:
1. Европейская Ассоциация урологов (European Association of Urology, EAU);
2. Национальный институт здравоохранения и передового опыта (National Institute for Health and Care Excellence, NICE);
3. Общество акушеров и гинекологов (Society of Obstetricians and Gynecologists, SOGC) Канады;
4. Американская академия семейных врачей (American Academy of Family Physicians, AAFP);
5. Мексиканский колледж специалистов по гинекологии и акушерству (Mexican College of Gynecology and Obstetrics Specialists, COMEGO);
6. Швейцарское общество гинекологов и акушеров (Swiss Society of Gynecology and Obstetrics, SSGO);
7. Испанское общество инфекционных заболеваний и клинической микробиологии (Spanish Society of Infectious Diseases and Clinical Microbiology, SEIMC);
8. Немецкая Ассоциация научных медицинских обществ (German Association of Scientific Medical Societies, Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften, AWMF);
9. Совокупно Американская урологическая ассоциация (American Urological Association)/Канадская урологическая ассоциация (Canadian Urological Association)/ Общества уродинамики, женской тазовой медицины и реконструкции мочеполовой системы (Society of Urodynamics, Female Pelvic Medicine and Urogenital Reconstruction (AUA/CUA/SUFU).
Определение и оценка рецидивирующих ИМП (РИМП), а также стратегии их антибиотикопрофилактики в основном были едины и подчеркивали важность получения культур мочи, ограничения цистоскопии и визуализации верхних мочевыводящих путей у женщин без факторов риска. Однако выявлены различия в отношении рекомендаций симптоматического лечения, самостоятельного назначения антибиотиков (так называемая пациент-индуцированная терапия) и неантибактериальной профилактики рецидивов, куда вошли препараты клюквы, D-манноза, вагинальные эстрогены, иммуноактивная профилактика с помощью препарата OM-89, внутрипузырные инстилляции гликозаминогликанов и фитотерапевтические средства [11, 18]. Недавние рандомизированные данные подтверждают использование метенамина гиппурата. Все руководства поддерживали либо непрерывную, либо посткоитальную профилактическую антибиотикотерапию. Но! Все руководства в основном ограничивались рекомендациями для здоровых небеременных женщин с неосложненным циститом, который, являясь доброкачественным заболеванием, в ряде случаев склонен к самоизлечению. Ни одно из руководств не давало рекомендаций по ведению рецидивирующих осложненных ИМП.
Определение РИМП во всех руководствах определяется как два или более эпизода симптоматической ИМП в течение последних 6 мес. или три или более эпизодов ИМП в течение 12 мес. Рекомендации AUA/CUA/SUFU дополнительно включают «культурально подтвержденные эпизоды острого бактериального цистита и связанные с ним симптомы». Положительный результат посева был определен в Руководстве SOGC как 105 и более колониеобразующих единиц (КОЕ)/мл при бессимптомной бактериурии, или >103 КОЕ/мл для пациентов с симптомами, в то время как рекомендации AAFP определяли положительный результат посева у пациенток с симптомами при росте 103/мл известного уропатогена. SEIMC допускает диагноз «цистит» у женщин с симптомами при более низком пороговом значении данных микробиологического исследования (≥102 КОЕ/мл). Во всех руководствах, кроме NICE, подчеркивалась важность посева мочи для первоначальной диагностики РИМП. Определение неосложненного цистита, согласно EAU, звучит так: «Острый спорадический или рецидивирующий цистит у небеременных женщин без соответствующих анатомических и функциональных аномалий в мочевыводящих путях или сопутствующих заболеваний» [10, 11]. Рекомендации по диагностике каждого острого эпизода РИМП различались. В руководствах AUA/CUA/SUFU и COMEGO рекомендуется использовать тест-полоски и проводить посев мочи при каждом остром эпизоде ИМП. Напротив, EAU и AAFP показали, что повторного посева мочи обычно не требуется, если присутствуют типичные симптомы и пациенты адекватно реагируют на антибиотики. Такой подход поддерживают и рекомендации SOGC. Однако при наличии атипичных симптомов или в случае отсутствия ответа на антибактериальную терапию EAU и AAFP рекомендуют выполнять посев мочи.
Многие руководства (AUA/CUA/SUFU, SOGC и AAFP) рекомендуют проводить гинекологический осмотр женщин с РИМП, особенно при наличии признаков атрофии слизистой влагалища или пролапсе тазовых органов. Большинство руководств согласны с тем, что дополнительное обследование, включая цистоскопию, ультразвуковое исследование (УЗИ) и урографию, как правило, имеют низкую диагностическую ценность и поэтому не должны рутинно проводиться женщинам без факторов риска [19]. Однако сила этих рекомендаций была переменной. Под маской цистита может скрываться уротелиальный рак, и при наличии соответствующих подозрении показано дальнейшее обследование. Поэтому руководства SOGC и AWMF рекомендуют цистоскопию и визуализацию верхних мочевыводящих путей пациенток с гематурией и персистирующим ростом микрофлоры, отличной от E. coli (мнение экспертов; недостаточно доказательств). SSGO рекомендовало цистоскопию при трех и более ИМП в год и компьютерную томографию почек с контрастным усилением при двух и более эпизодах пиелонефрита в год.
Все руководства рекомендуют короткие (менее 7 дней) курсы антибиотиков для лечения острых эпизодов РИМП. Для антибиотикопрофилактики все руководства поддерживают как непрерывный, так и посткоитальный режимы. В руководствах SSGO и AWMF подчеркивается, что профилактическое назначение антибиотиков должно быть последним средством после исчерпания других профилактических мер. Руководства EAU, AUA/CUA/SUFU и AAFP не рекомендуют лечение бессимптомной бактериурии. Самостоятельная диагностика ИМП и самостоятельное назначение антибиотиков для пациенток, соблюдающих режим лечения, является умеренно-сильной рекомендацией в руководствах EAU, AUA/CUA/SUFU, SOGC и SSGO. AAFP предлагает применять эту стратегию лечения тем, кто отказывается от профилактического назначения антибиотиков, а SEIMC рекомендует ее только тем, у кого имеют место менее трех эпизодов ИМП в год. COMEGO считает, что нет достаточных доказательств в поддержку этой практики. Симптоматическое ведение пациенток с подозрением на ИМП до получения результатов посева мочи поддерживают AUA/CUA/SUFU. SSGO рекомендует на 48 ч ограничиться назначением анальгетиков и нестероидных противовоспалительных препаратов небеременным женщинам в возрасте <65 лет с неосложненной ИМП и добавлять антибиотикотерапию только в случае отсутствия эффекта. Той же тактики придерживается AWMF при неосложненном цистите с симптомами легкой и средней степеней тяжести и в зависимости от предпочтений пациентки после оценки риска. Руководство NICE рекомендует начинать с симптоматического лечения всех пациенток, но беременным женщинам также сразу назначать антибиотики; прочим пациенткам антибактериальную терапию проводить отсроченно, если симптомы стабильны или ухудшаются через 48 ч. AAFP, хотя и признает, что эта стратегия может ограничивать использование антибиотиков, не рекомендует откладывать их назначение. EAU полагает, что симптоматическое лечение может обсуждаться в качестве альтернативы для отдельных пациенток, но антибиотики по-прежнему рекомендуются на основании результатов рандомизированных клинических испытаний.
После успешного лечения острого эпизода важны профилактические меры для предупреждения рецидива ИМП. EAU (у женщин в постменопаузе), SSGO и SEIMC (особенно у женщин в постменопаузе или с вагинальной атрофией) настоятельно рекомендуют заместительную терапию вагинальными эстрогенами для профилактики РИМП, в то время как в других руководствах сила таких рекомендаций оценивается от слабой до умеренной. Добавки с препаратами клюквы были настоятельно рекомендованы руководством SOGC, в то время как другие дали только слабую-умеренную рекомендацию. В большинстве руководств содержится слабая рекомендация по изменению поведения для профилактики РИМП (за исключением AWMF: сильная рекомендация). В частности, руководства AUA/CUA/SUFU рекомендуют увеличить потребление пероральной жидкости и изменить способ контрацепции, в первую очередь отказаться от спермицидов. Наши данные также подтверждают зависимость частоты рецидивов цистита от метода контрацепции; в проведенном исследовании показано, что женщины, использующие презерватив, имели большую частоту обострений, чем те, кто принимал оральные комбинированные контрацептивы [20]. Рекомендации NICE также предлагают посткоитальное мочеиспускание, применять душ после дефекации, не задерживать мочеиспускание, не носить окклюзионное белье. Однако в руководствах EAU и AUA/CUA/SUFU подчеркивается отсутствие доказательств эффективности этих мер. Все руководства согласились с тем, что недостаточно доказательств, чтобы рекомендовать пробиотики и продукты лактобактерий. D-манноза была настоятельно рекомендована SEIMC из-за ее эффективности, сходной с нитрофурантоином [11]. EAU, SSGO и AWMF также поддерживают использование D-маннозы (слабые-умеренные рекомендации), в то время как NICE рекомендует применять D-маннозу небеременным женщинам в качестве самопомощи [21]. SOGC, COMEGO, SSGO и AAFP рекомендовали избегать использования спермицидов. Руководства EAU, COMEGO, SEMIC, SSGO и AWMF рекомендовали иммуноактивную профилактику с помощью препарата OM-89. В рекомендациях SOGC предлагалось рассмотреть возможность применения иглоукалывания для профилактики РИМП у женщин, которые не реагируют или не переносят профилактику антибиотиками [22, 23], хотя иглоукалывание не было включено в другие руководства. Гиппурат метенамина – уроантисептик, представляет собой пролекарство, из которого в кислой среде высвобождается формальдегид, оказывающий противомикробное действие.
В организме расщепление метенамина происходит в почках, а также в очаге воспаления (т.к. развитие воспаления сопровождается изменением реакции среды в кислую сторону). Гиппурат метенамина был рекомендован SSGO для краткосрочной терапии, в то время как SEIMC не рекомендовало его использование, а другие руководства (EAU, AUA/CUA/SUFU) сообщали о противоречивых/недостаточных доказательствах для вынесения рекомендации его применения. Фитотерапевтические средства были кратко включены в руководства SSGO и AWMF.
Таким образом, различные международные руководства по ведению РИМП содержат разные рекомендации. Определение и оценка РИМП в основном едины. Различия касаются симптоматического лечения и отсроченной антибиотикотерапии при острых эпизодах ИМП. Рекомендации по неантибиотикопрофилактике различались, особенно в отношении продуктов из клюквы, вагинального эстрогена и образа жизни. Гиппурат метенамина широко не рекомендовался, но ожидается, что он будет включен в будущем. Иммуноактивная профилактика эффективна, но используется недостаточно часто. Большинство руководств ограничивали свои рекомендации здоровыми небеременными женщинами с неосложненным циститом, но по ведению хронического цистита рекомендации детально не разработаны.
Патогенетическая терапия в лечении больных РИМП имеет важное значение, и особое место в широком списке средств патогенетического воздействия занимают антимикробные пептиды (AMП) в комплексе с противовоспалительными пептидами. По своей сути АМП – соединения, продуцируемые прокариотическими и эукариотическими клетками; низкомолекулярные белки, обладающие антимикробной активностью в отношении как грамположительных и грамотрицательных бактерий, так и вирусов и грибов. В борьбе организма с инфекцией принимают участие и цитокины – собирательное название белковых, полипептидных, гормоноподобных модуляторов, продуцируемых клетками иммунной системы. Отечественный препарат Суперлимф® представляет собой коктейль АМП и противовоспалительных цитокинов, что позволяет ему стимулировать фагоцитоз, способствовать гибели внутриклеточных паразитов, регулировать миграцию клеток в очаг воспаления, увеличивать активность естественных киллеров [24]. Ряд диссертационных исследований показал, что препарат обладает антиоксидантной активностью, снижает развитие воспалительных реакций, стимулирует регенерацию и эпителизацию раневых дефектов [25, 26].
Заключение. Сочетанная антибактериальная терапия привела к отсутствию рецидива в течение полугода у 39,3% больных хроническим циститом. Комплексная этиопатогенетическая терапия, включившая ректальные суппозитории Суперлимф®, позволила статистически значимо сократить число обострений и удлинить безрецидивный период. Среди пациенток, получавших курс локальной цитокиновой терапии в дозе 25 ЕД в течение 10 дней, в 55,6% случаев не было обострений хронического цистита в течение 6 мес. В группе больных, получавших наряду с этиотропной терапией ректальные суппозитории Суперлимф® в дозе 10 ЕД в течение 20 дней, рецидив заболевания в течение полугода отсутствовал у 70,4% пациенток. Таким образом, пролонгированный курс препарата Суперлимф даже в более низкой дозировке более перспективен в плане предотвращения рецидивов РИМП.



