Введение. Тестостерон играет одну из ключевых ролей в развитии и поддержании мужской репродуктивной функции, строения тела, эритропоэза, состояния мышечной и костной ткани и когнитивной функции [1–7]. Его низкий уровень может вызывать снижение фертильности, нарушение роста мышц и минерализации костей, расстройства метаболизма жиров и когнитивные нарушения. Кроме того, тестостерон играет основную роль в становлении сексуальной функции и формировании полового поведения, поэтому снижение его уровня сопровождается уменьшением либидо и эректильной дисфункцией [1].
Около 90% тестостерона у мужчин синтезируется в яичках (в клетках Лейдига), 10% – в надпочечниках [2, 3]. Клетки Лейдига составляют небольшую долю от массы яичка, но именно они выделяют половые гормоны, влияющие на половое поведение мужчин [1–3]. Примерно 62% циркулирующего тестостерона связано с сексстероидсвязывающим глобулином (СССГ), 36% – с альбумином или другими белками, свободный тестостерон составляет лишь 2% [2].
Основными факторами риска развития андрогенной недостаточности служат ожирение и сопутствующие заболевания [4, 5]. Кроме того, с возрастом и у здоровых мужчин распространенность андрогендефицита увеличивается [6]. Наиболее высокий уровень общего тестостерона характерен для мужчин 25–35 лет, затем он постепенно снижается на 1–2% в год. Уровень СССГ с возрастом повышается, уровень свободного тестостерона уменьшается [7].
Так, по данным Массачусетского исследования по изучению вопросов старения мужчин (MMAS), количество общего тестостерона снижается с 30–35-летнего возраста на 0,8%, свободного тестостерона и связанного с альбумином – на 2% в год, при этом уровень глобулина, связывающего половые гормоны, повышается на 1,6% в год [6, 7].
В продолжительном Балтиморском исследовании с участием пожилых мужчин снижение показателя общего тестостерона отмечено у 20% лиц старше 60 лет, у 30% – старше 70 лет и у 50% лиц – старше 80 лет, а при учете свободного биологически активного тестостерона доля мужчин с андрогендефицитом оказалась еще выше [3].
В норме содержание сывороточного тестостерона у мужчин варьируется в диапазоне 10–35 нмоль/л. Приводимые в литературе показатели гипотестостеронемии колеблются от 10,4 до 13,9 нмоль/л, что соответствует интервалу от 300 до 400 нг/дл [3, 4]. Отсюда в практике в настоящее время рекомендуют не считать «нормальным» нижний предел сывороточною уровня тестостерона в 10–12 нмоль/л, безусловно с учетом возрастных особенностей мужчи и клинических симптомов, которые врач связывает с данным состоянием.
Все физиологические процессы в организме, в том числе и выработка тестостерона, имеют свои хронобиологические особенности [8–11]. Их регуляция осуществляется гипоталамо-гипофизарной осью, которая определяет согласованность работы всех систем [3, 8–11]. Так, у здорового человека отмечается циркадный ритм секреции тестостерона: наивысший уровень данного гормона выявляется с 6.00 до 11.00, значительно более низкий — в вечерние часы и наименьший – ночью, с 2.00 до 3.00. С возрастом и при патологических состояниях происходит нарушение регуляции хронобиологических процессов, развивается десинхроноз [8–11].
У здоровых мужчин 55 лет и старше нарушается циркадианный ритм секреции тестостерона, а его концентрация в течение дня соответствует таковой молодых мужчин в вечернее и ночное время суток. При андрогендефиците подобные изменения встречаются в любом возрасте [4, 5].
Как известно, на данный момент существует несколько вариантов терапии, которые можно предложить пациентам с андрогендефицитом, а именно: использование внутримышечных эфиров тестостерона, трансдермальной его формы и препаратов гонадотропных гормонов [4]. Назначение внутримышечных препаратов ведет к повышению уровня тестостерона до супрафизиологических значений и, соответственно, к компенсаторному снижению уровня лютеинизирующего гормона (ЛГ); при этом блокируется выработка эндогенного тестостерона в клетках Лейдига и фолликулостимулирующего гормона (ФСГ), что ведет к нарушению сперматогенеза [3, 4]. Так, в работе C. Wang et al. [3] назначение 20 здоровым мужчинам внутримышечных инъекций тестостерона приводило к резкому снижению уровня ЛГ и ФСГ, что сопровождалось снижением концентрации сперматозоидов. Более того, через 24 нед. приема у 60% мужчин концентрация сперматозоидов была менее 3 млн в 1 мл.
Среди трансдермальных форм тестостерона на сегодняшний день на рынке широкую популярность имеет тестостерон-гель для наружного применения (Андрогель) [6, 7], обеспечивающий постоянное поступление тестостерона в течение суток после однократного нанесения на неповрежденную чистую сухую кожу надплечья, плеча или живота.
Преимущества трансдермального геля заключаются в неинвазивности, безболезненности, возможности самостоятельного применения в домашних условиях [6]. Местные реакции при использовании препарата минимальны. Степень абсорбции тестостерона через кожу варьируетcя в пределах от 9 до 14% от нанесенной дозы. Концентрация тестостерона в сыворотке возрастает с первого часа после применения препарата, достигая постоянного значения со второго дня лечения [7]. Суточные колебания концентраций тестостерона при приеме препарата имеют такую же амплитуду, как и наблюдаемые в циркадных ритмах изменения содержания эндогенного тестостерона. Важно, что при наружном пути введения препарата отсутствуют супрафизиологические пики концентрации тестостерона в крови, что позволяет избегать ряда побочных эффектов, а также обеспечивать уровень тестостерона в рамках физиологической нормы [6, 7].
Рекомендованная суточная доза составляет 5 г геля (т.е. 50 мг тестостерона), применяемого 1 раз в сутки примерно в одно и то же время, предпочтительно утром. Индивидуальная дневная доза может корректироваться врачом в зависимости от клинических и лабораторных показателей пациентов, но не должна превышать 10 г геля в сутки. Дозировку можно также и уменьшать, если содержание тестостерона в плазме повышено.
Цель исследования: оценить эффективность и хронобиологические особенности различных режимов терапии тестостерон-гелем для наружного применения мужчинами с андрогендефицитом.
Материалы и методы. В исследование включены 90 мужчин в возрасте от 45 до 60 лет с дефицитом тестостерона, находящихся на амбулаторном лечении.
Всем пациентам были проведены лабораторные исследования с определением гематокрита, а также уровня общего тестостерона, СССГ, пролактина, ЛГ, ФСГ, тиреотропного гормона (ТТГ), простатоспецифического антигена (ПСА) и глюкозы крови, после чего они были осмотрены андрологом. У всех пациентов были исключены заболевания предстательной железы, органов мошонки при осмотре, рак молочной железы. Кроме того, критериями исключения служили наличие эндокринных заболеваний, ведущих к снижению секреции тестостерона (гипотиреоз, тиреотоксикоз, гиперпролактинемия, сахарный диабет; гиперкортицизм), хронической обструктивной болезни легких, ожирения 2–3-й степени, приобретенных дефектов (травма, облучение, аутоиммунные заболевания) или тяжелых соматических заболеваний (почечная или печеночная недостаточность, тяжелые сердечно-сосудистые заболевания и т.д.), а также прием препаратов, влияющих на андрогенный статус; высокие значения гематокрита; повышение уровня ПСА, алкоголизм и употребление наркотических средств.
Пациенты были рандомизированы на 3 группы по 30 человек.
Группе I (контрольной) назначена базовая терапия, включившая занятия спортом, диету, прием витаминных комплексов.
Группе II базовая терапия была назначена в сочетании с тестостерон-гелем для наружного применения в дозе 5 г (1 саше) однократно утром в течение 6 мес. с первого дня терапии.
Пациенты группы III получали базовую терапию в комплексе с тестостерон-гелем в дозе 10 г (2 саше) однократно утром в течение 6 мес. с первого дня терапии.
Всем больным с эректильной дисфункцией были назначены ингибиторы фосфодиэстеразы 5-го типа по требованию.
Эффективность лечения оценивалась через 3 (визит 2) и 6 мес. (визит 3). По результатам визита 2 проводили корректировку терапии. В ходе каждого визита всем пациентам определяли гематокрит, уровни ФСГ, ЛГ, пролактина, тестостерона, СССГ крови, а также измеряли антропометрические показатели: окружность талии, масса тела. Кроме того, мониторировали содержание ПСА в крови и проводили пальцевое ректальное исследование с целью выявления признаков рака простаты.
Помимо этого всем пациентам было предложено заполнить опросник «Международный индекс эректильной функции» (МИЭФ-5). С целью оценки психоэмоционального состояния проведен анализ показателей тяжести тревожно-депрессивных расстройств и качества жизни с помощью шкал Гамильтона для оценки депрессии (HDRS), тревоги (HARS) и шкалы оценки качества жизни (SF-36). Пациентов c выраженными психоэмоциональными нарушениями (по данным опросников HDRS и HARS) направляли на консультацию к психоневрологу.
Также у всех мужчин регистрировали хроноритмы с использованием компьютерного комплекса «Динамика» (ООО Лаборатория «Динамика», Санкт-Петербург, Россия) для оценки хронобиологического статуса и выявления десинхроноза. Под хроноритмом в данном исследовании подразумевали зависимость интегрального показателя здоровья H (Т) от времени суток Т.
При этом суточный прогноз включает три зоны функциональных состояний в зависимости от расположения хронограммы:
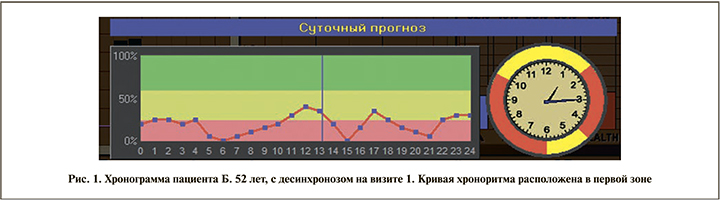
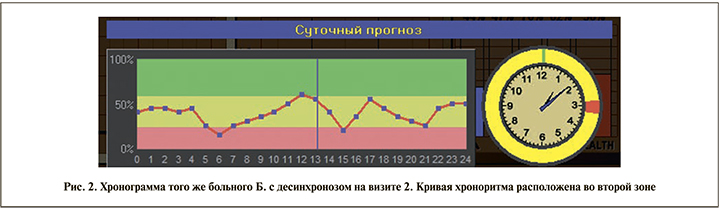
- первая зона – 25–0%, «срыв адаптации», истощение механизмов регуляции;
- вторая зона – 75–25%, «преморбидное состояние», выраженное нарушение регуляторных механизмов;
- третья зона – 100–75%, «физиологическая норма», оптимальный уровень функционирования систем регуляции организма.
Расположение кривой хроноритма в первой и второй зонах свидетельствует о десинхронозе.
Статистическую обработку результатов проводили с помощью программы MSExel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Cтьюдента) статистики. При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты. При обследовании больных в ходе первого визита была подтверждена исходная однородность исследуемых групп. Масса тела пациентов варьировалась от 80 до 104 кг, окружность талии – от 90 до 119 см. У всех мужчин выявлены снижение уровня общего тестостерона в анализе крови, а также эректильная дисфункция легкой и умеренной степени, психоэмоциональные нарушения легкой и средней степени тяжести и снижение качества жизни по данным опросников. Регистрация хронобиологических ритмов выявила наличие десинхроноза у всех пациентов (рис. 1).
Динамика изучаемых показателей в группах к концу 3-го месяца терапии была различной (табл. 1–3).
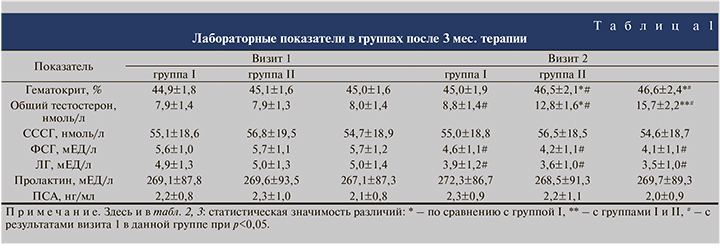
При анализе результатов лабораторных исследований отмечено статистически значимое (р<0,05) увеличение уровня общего тестостерона крови во всех группах (см. табл. 1). При этом наиболее выраженное изменение данного показателя отмечено в группе III, где среднее значение составило 15,7±2,2 нмоль/л, что выше (р<0,05), выше, чем в группах I и II. При анализе отдельных случаев в группе III у 4 (13,3%) пациентов через 3 мес. терапии уровень тестостерона был ниже 12 нмоль/л, тогда как у остальных 86,7% он варьировался в пределах от 12 до 17 нмоль/л.
В группе II средний показатель общего тестостерона крови увеличился на 4,9 нмоль/л и составил 12,8±1,6 нмоль/л, что также статистически значимо выше, чем в группе I (р<0,05; см. табл. 1). При этом у 9 (30%) пациентов, несмотря на прирост его уровня на 4–5 нмоль/л, он составил менее 10 нмоль/л, что связано с исходно более низким его уровнем (менее 6 нмоль/л).
В группе I уровень общего тестостерона крови к визиту 2 в среднем составил 8,8 нмоль/л (см. табл. 1). Только у 5 (16,7%) мужчин данной группы показатель превысил 10 нмоль/л.
Кроме того, было выявлено достоверное (р<0,05) снижение уровней ЛГ и ФСГ крови во всех трех группах и повышение гематокрита в группах II и III (см. табл. 1). Все изменения происходили в пределах нормальных значений. Остальные исследуемые лабораторные показатели значимо не менялись.
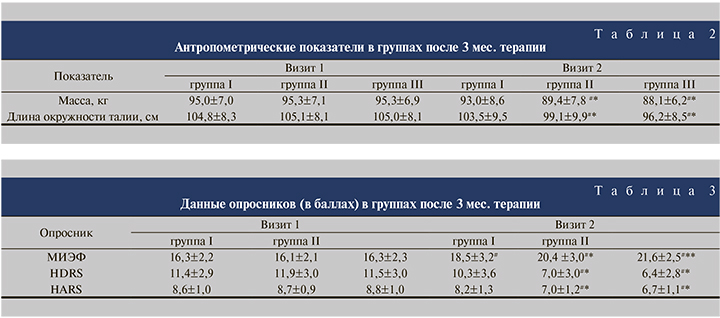
При анализе динамики изучаемых антропометрических данных через 3 мес. терапии отмечено достоверное (р<0,05) снижение массы тела и окружности талии в группах II и III (см. табл. 2). Также средние значения указанных показателей в группах пациентов, получавших тестостерон-гель для наружного применения, были достоверно ниже (р<0,05), чем в группе I, где не было выявлено значимых изменений к концу 3-месячной терапии.
Средний балл опросника МИЭФ-5 во всех группах достоверно вырос на 2–5 баллов по сравнению с оценкой, полученной на визите 1 (см. табл. 3). При этом показатели трех групп статистически значимо отличались друг от друга (р<0,05). Следует отметить, что в группе I у 5 (16,7%) пациентов с наиболее высокими значениями тестостерона крови показатель по шкале МИЭФ был самым высоким – более 21, что свидетельствовало о восстановлении эректильной функции. В свою очередь у 9 (30%) пациентов групы II и у 4 (13,3%) – группы III показатель по шкале был ниже 20 – сохранялась эректильная дисфункция.
При оценке психоэмоционального статуса больных групп II и III отмечено достоверное (p<0,05) снижение среднего балла по шкалам HDRS и HARS (табл. 3). Результаты в этих группах значимо отличались от показателей группы I, тогда как между собой группы II и III не различались. При этом легкая степень депрессии и субклинические проявления тревоги сохранялись в группе I у 25 (83,3%) пациентов, в группе II – у 9 (30%), в группе III – у 4 (13,3%). Данные шкалы SF-36 свидетельствовали об улучшении качества жизни по шкалам физического и психического компонента здоровья во всех трех группах, но более выраженная динамика была выявлена в группах пациентов, получавших тестостерон-гель для наружного применения.
При оценке хронобиологического статуса пациентов после 3 мес. терапии в группе I у 25 (83,3%) пациентов кривая хроноритма располагалась в первой и второй зонах – десинхроноз сохранялся. В группах II и III признаки десинхроноза имелись у 9 (30%) и 4 (13,3%) мужчин соответственно (рис. 2).
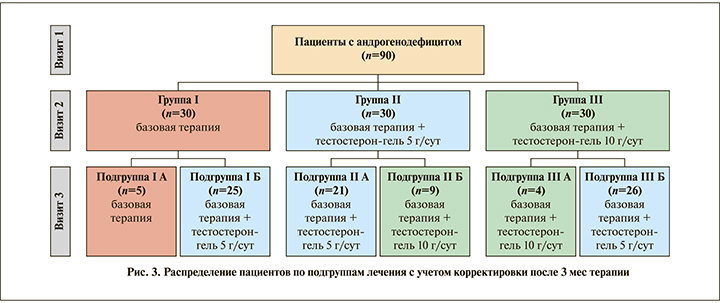
С учетом результатов, полученных в ходе визита 2, была проведена коррекция терапии, в связи с чем больные в группах были дополнительно разделены на подгруппы А и Б (рис. 3). В подгруппе А пациенты продолжали получать текущую терапию, в подгрупе Б лечение было скорректировано.
Пациенты в подгруппе IА (n=5) имели исходно более высокий уровень тестостерона (от 8 до 10 нмоль/л). У них была отмечена более выраженная положительная динамика изменения исследуемых показателей по сравнению с остальными пациентами данной группы, в связи с чем они продолжили получать базовую терапию.
В подгруппе IБ (n=25), учитывая низкую эффективность начальной терапии, больные были переведены на базовую терапию в сочетании с тестостерон-гелем для наружного применения в дозе 5 г (1 саше) однократно утром.
Больные в подгруппе IIА (n=21) отмечали положительный эффект от проводимого лечения и продолжили получать базовую терапию в сочетании с тестостерон-гелем в дозе 5 г (1 саше) однократно утром.
В подгруппе IIБ (n=9) мужчины имели изначально более низкий уровень тестостерона (< 6 нмоль/л), отмечали недостаточную эффективность лечения, в связи с чем им была увеличена доза препарата тестостерона до 10 г (2 саше).
В подгруппе IIIА (n=4) пациенты продолжили получать базовую терапию в сочетании с тестостерон-гелем в дозе 10 г (2 саше) однократно утром, так как изменения показателей у них была менее выражены. Исходный уровень тестостерона был меньше 6 нмоль/л, а динамика его прироста не позволила достичь нормальных значений за 3 мес. терапии.
Мужчинам подгруппы IIIБ (n=26) доза препарата была снижена до 5 г (1 саше) в связи с высокой эффективностью лечения и достижением целевого уровня тестостерона уже к визиту 2.
Результаты обследований, полученные после 6 мес. терапии с учетом проведенных корректировок, представлены в табл. 4–6.
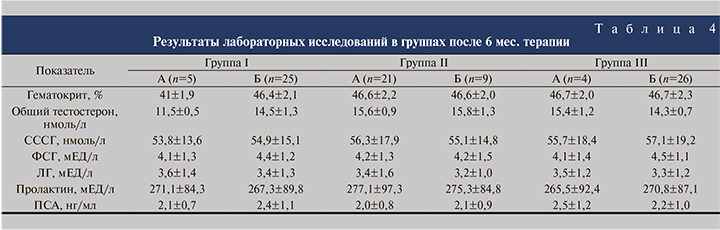
Анализ лабораторных показателей после 6-месячной терапии с учетом проведенных корректировок выявил, что уровень общего тестостерона достиг нормальных значений (более 12 нмоль/л) во всех подгруппах, кроме подгруппы IА, где среднее значение составило 11,5±0,5 нмоль/л (см. табл. 4). Наибольшие средние значения данного показателя отмечены в подгруппах IIА, IIБ и IIIА и составили 15,6±0,9, 15,8±1,3 и 15,4±1,2 нмоль/л соответственно. В подгруппе IБ, где пациенты получали тестостерон-гель в дозе 5 г в сутки с 3-го по 6-й месяц, результаты были несколько ниже – 14,3±1,3 нмоль/л. В подгруппе IIIБ средний уровень общего тестостерона составил 14,5±0,7 нмоль/л.
Все остальные изучаемые лабораторные показатели достоверно не изменились и варьировались в пределах нормальных значений (см. табл. 4).
При оценке массы тела пациентов наименьшие значения были отмечены в подгруппах IА, IIА и IIIБ. Сходная динамика наблюдалась и в отношении длины окружности талии (см. табл. 5). В этих подгруппах она в среднем составила менее 90 см, тогда как в остальных подгруппах – более 90 см.
Согласно опроснику МИЭФ-5, средний балл во всех группах варьировался от 21,4 до 22,8 (см. табл. 6). Тем не менее в подгруппе IБ у 3 пациентов, в подгруппе IIБ у 2 и в подгруппе IIIА у 1 мужчины балл по шкале составил менее 20 – сохранялась эректильная дисфункция легкой степени.
При оценке психоэмоционального статуса в исследуемых группах II и III отмечено достоверное (p<0,05) снижение среднего балла по шкалам HDRS и HARS (см. табл. 6). Несмотря на то что средние показатели во всех группах не превышали 8 баллов, у 3 пациентов подгруппы IБ, у 2 – подгруппы IIБ и у 1 – подгруппы IIIА были выявлены субклинические проявления тревоги. Результаты тестирования по шкале SF-36 указывали на улучшение качества жизни по шкалам физического и психического компонента здоровья во всех подгруппах. Наиболее значимое улучшение выявлено в подгруппах IА, IIА, IIIБ.
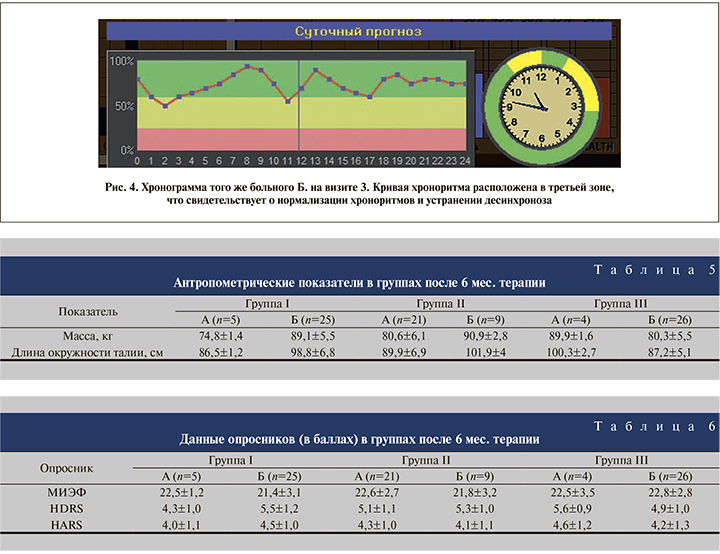
При оценке хронобиологического статуса больных после 6 мес. терапии десинхроноз сохранялся у 3 пациентов подгруппы IБ, у 2 –подгруппы IIБ и у 1 – подгруппы IIIА. Кривая хроноритма остальных обследованных мужчин располагалась в третьей зоне – десинхроноз отсутствовал (рис. 4).
Заключение. Применение трансдермального тестостерон-геля позволило устранить проявления андрогендефицита, повысить уровень общего тестостерона, снизить массу тела и уменьшить длину окружности талии, восстановить эректильную функцию, а также нормализовать психоэмоциональное состояние больных и повысить качество жизни.
При анализе хронобиологического статуса пациентов подгрупп 1А, 2А и 3Б выявлено наиболее быстрое восстановление хроноритмов, что, на наш взгляд, связано с более ранним достижением ими индивидуального целевого уровня тестостерона. У мужчин подгрупп 1Б, 2Б и 3А, получавших базовую терапию в сочетании с трансдермальным препаратом тестостерона, отмечены более высокие результаты терапии.
Пациентам с исходным уровнем тестостерона менее 6 нмоль/л назначение тестостерон-геля для наружного применения в дозе 10 г позволило более эффективно и в более короткие сроки устранить проявления заболевания, а также восстановить хронобиологические ритмы.
Таким образом, мы рекомендуем применение трансдермального тестостерон-геля при андрогендефиците в дозе 5 г однократно утром с целью купирования клинических проявлений заболевания и устранения десинхроноза. Пациентам с низким исходным уровнем тестостерона целесообразно назначение препарата в дозе 10 г 1 раз в день.



