Введение. В настоящее время трехмерная 3D-печать используется в различных областях медицины. Эти технологии имеют значительные преимущества как при планировании, так и при выполнении челюстно-лицевых, ортопедических и нейрохирургических вмешательств, в частности, позволяют обеспечивать лучшую интраоперационную навигацию для хирурга, который в любой момент вмешательства может обратиться к печатной модели с целью уточнения отдельных анатомических особенностей [1–4]. Небиологические 3D-печатные модели также применяются в урологии для планирования операции и улучшения кривой обучения как врачей, так и клинических ординаторов [5–9]. Перкутанная нефролитотрипсия – безопасный и эффективный метод лечения пациентов с крупными и множественными камнями почек [10, 11]. Знание анатомии чашечно-лоханочной системы (ЧЛС) и правильно выполненный доступ через соответствующую чашечку служат одним из основных факторов, определяющих успех выполнения ПНЛ. Компьютерная томография с внутривенным контрастированием и без него является современным методом визуализации камней почек [12]. Достижения в области технологии КТ позволяют получать реконструированные 3D-изображения ЧЛС, которые могут быть использованы для повышения эффективности ПНЛ с минимизацией осложнений [13–15]. Кроме того, можно сконструировать точную модель ЧЛС с помощью технологии 3D-печати и использовать ее в качестве учебного пособия для клинических ординаторов, планирования хода предстоящей ПНЛ [7, 9, 14, 15]. Получаемые методом 3D-печати на основе данных пациента могут служить в качестве адекватной визуализации структур почки, позволяя лучше охарактеризовать ту или иную патологию, что, несомненно, улучшит процесс обучения молодых специалистов [6–9, 14, 15].
 Цель исследования: определить эффективность применения небиологической разборной цветной сегментированной 3D-печатной модели ЧЛС в улучшении понимания ординаторами ее анатомии и определения оптимальной тактики ПНЛ.
Цель исследования: определить эффективность применения небиологической разборной цветной сегментированной 3D-печатной модели ЧЛС в улучшении понимания ординаторами ее анатомии и определения оптимальной тактики ПНЛ.
Материалы и методы. Разборные цветные 3D-модели ЧЛС (патент РФ №193069) были созданы нами на основе данных КТ с контрастированием 5 больных с коралловидным камнем, которым была показана ПНЛ. Исходные КТ-снимки троих больных в режиме 2D и 3D спереди, сзади и сбоку представлены на рис. 1–3. КТ-сканы записывали на диск в формате DICOM. Для изучения результатов и подтверждения их корректности использовали RadiAnt DICOM Viewer. Полученные данные сохраняли в формате файла, совместимого с программным обеспечением 3D-принтера. Наиболее часто используемым среди них является формат стереолитографии. Для решения данной задачи мы использовали программу slicer 4.8.1. Затем файлы STL отправляли биоинженеру для проведения виртуальной сегментации ЧЛС в соответствии с уровнем каждой группы чашечек, определяемым опытным урологом. Кроме того, каждая группа была разделена пополам для облегчения дальнейшего процесса разборки и внутрипросветного исследования печатных моделей. После этого выполняли цветную обработку сегментированных виртуальных моделей красным, синим и зеленым цветами, соответствовавшими верхней, средней и нижней группам чашечек соответственно.
Последние достижения в технологии трехмерной печати позволяют использовать различные материалы. В нашем исследовании для печати отдельных сегментов ЧЛС мы использовали акрилонитрил-бутадиен-стирол. К наиболее важным его свойствам относятся высокая плотность, устойчивость к ударам и низкая цена. Модели создавали путем печати каждого участка методом послойного наплавления с помощью 3D-принтера Picaso designer X.
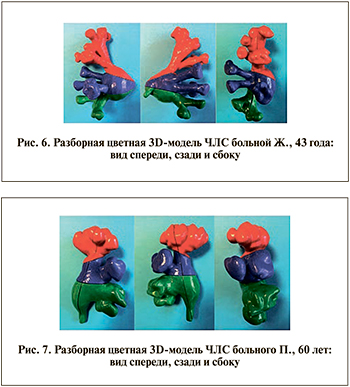
В таких принтерах используется полимерная нить, которая нагревается до жидкого состояния в его печатной головке и осаждается в заранее определенных местах, соответствующих исходной типовой форме. Напечатанные отдельные элементы разборной цветной 3D-модели ЧЛС представлены на рис. 4. Для фиксации цельной модели применяли метод магнитного крепления, который позволяет изолировать отдельно выбранную деталь без потери конфигурации всей остальной модели ЧЛС. В каждой субъединице были установлены магниты размером 4×1 мм круглой формы с усилием разрыва 320 г, что при массе всей модели в 150 г обеспечивает более прочное крепление. Виды напечатанных 3D-моделей ЧЛС спереди, сзади и сбоку представлены на рис. 5–7.
Апробация моделей и анкетирование. Для оценки эффективности 3D-моделей как в обучении, так и в прогнозировании ПНЛ была разработана анкета, использованная для проведения опроса 10 клинических ординаторов кафедры урологии (группа А). Вопросы: 1) число передних чашечек верхней группы; 2) число задних чашечек верхней группы; 3) число передних чашечек средней группы, 4) число задних чашечек средней группы, 5) число передних чашечек нижней группы; 6) число задних чашечек нижней группы; 7) оптимальная чашечка для основного доступа; 8) оптимальная чашечка для второго доступа.
 Опрос проводили до и после изучения 3D-моделей с промежутком в 10 мин. Помимо этого ординаторы дополнительно описывали КТ-данные других 5 пациентов с камнями почек с целью предотвращения возможного сопоставления изучаемых КТ-снимков пациентов с соответствующими печатными моделями ЧЛС почки. Также опрос по данной анкете после изучения КТ-данных прошли 10 практикующих урологов, имеющих опыт выполнения 50 ПНЛ и более (группа Б). Следует упомянуть, что урологи не изучали печатные 3D-модели собирательной системы почки, в свою очередь направленные на возмещение недостатка опыта ординаторов и улучшение их понимания основных анатомических особенностей ЧЛС почек каждого конкретного пациента во время обучения. Далее результаты анкетирования ординаторов сравнивали с ответами врачей. Правильные ответы определялись урологом, выполнившим более 250 ПНЛ.
Опрос проводили до и после изучения 3D-моделей с промежутком в 10 мин. Помимо этого ординаторы дополнительно описывали КТ-данные других 5 пациентов с камнями почек с целью предотвращения возможного сопоставления изучаемых КТ-снимков пациентов с соответствующими печатными моделями ЧЛС почки. Также опрос по данной анкете после изучения КТ-данных прошли 10 практикующих урологов, имеющих опыт выполнения 50 ПНЛ и более (группа Б). Следует упомянуть, что урологи не изучали печатные 3D-модели собирательной системы почки, в свою очередь направленные на возмещение недостатка опыта ординаторов и улучшение их понимания основных анатомических особенностей ЧЛС почек каждого конкретного пациента во время обучения. Далее результаты анкетирования ординаторов сравнивали с ответами врачей. Правильные ответы определялись урологом, выполнившим более 250 ПНЛ.
При оценке гипотез за критический уровень значимости было принято значение 0,05. Ответы в каждой группе были объединены в соответствии с вопросами для сравнения.
В качестве непараметрического критерия использовали χ2 и при наличии значения менее 5 в таблице ожидаемых чисел точный двусторонний критерий Фишера. Сравнение проводили с помощью программы PAST3.
Результаты. В результате сравнения ответов ординаторов и урологов после изучения КТ-данных была выявлена статистическая разница по каждому вопросу. После изучения КТ-снимков в группе ординаторов (группа А) определение числа передних и задних чашечек верхней группы по сравнению с результатами опытных урологов (группа Б) было хуже на 54 и 44%, определение числа чашечек средней группы – на 54 и 34%, ответы касательно количества передних и задних чашечек нижней группы были хуже на 48 и 56% соответственно (рис. 8, 9). Ответы на вопросы касательно выбора чашечки для доступа также оказались хуже. Так, способность выбрать оптимальную чашечку для основного доступа была хуже на 70%, для второго доступа – на 72%. Значение р в каждом вопросе было менее 0,001.
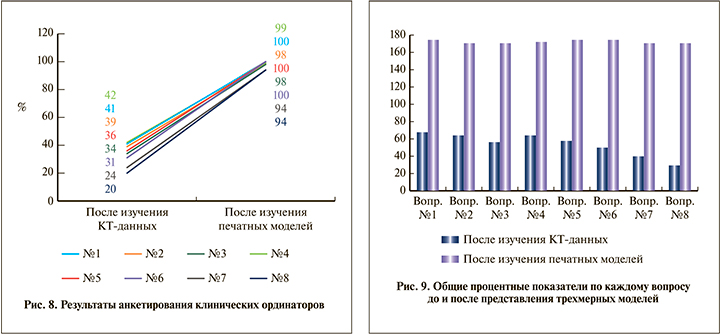
Иная ситуация наблюдалась после изучения ординаторами 3D-моделей и повторном сопоставлении их ответов с таковыми врачей. Определение передних и задних чашечек верхней группы было хуже на 10 (р=0,23) и на 8% (р=0.31), средней группы – на 8 (р=0,2) и на 0% (р=1), нижней группы – на 6 (р=0,4) и на 10% (р=0,1) соответственно (рис. 8, 9). Правильность выбора чашечек для основного и второго доступов отличалась на 12 (р=0,5) и 20% (р=0,009) соответственно.
Обсуждение. Использование стандартных 2D-сканов ограничивает возможности хирургов в анализе интраоперационных сценариев. По этой причине 3D-технологии все активнее внедряются в различные хирургические специальности [1–4, 7–9, 14, 15]. Перкутанная нефролитотрипсия служит эффективным методом лечения нефролитиаза, но показатели ее успеха и частота осложнений определяются воздействием различных факторов. Так, было показано, что по мере увеличения размера камня и количества доступов снижается процент освобождения ЧЛС от камней, а риски кровотечения, напротив, возрастают [16–18]. Коралловидный нефролитиаз нередко требует формирования нескольких доступов для удаления максимального объема камня и снижения частоты резидуальных фрагментов. Конечная цель ПНЛ – это полное избавление ЧЛС от камней c минимальными осложнениями.
В настоящее время 3D-печать используется для предоперационного планирования сложных ортопедических, челюстно-лицевых и нейрохирургических вмешательств [1–4]. Данная технология применяется и в урологии.
В литературе имеются публикации о биомоделировании ЧЛС для планирования эндоурологических вмешательств [7, 9, 14, 19]. Используя 3D-модели в предоперационном периоде, можно добиться не только лучшего понимания строения ЧЛС пациента, но и повышения качества выполнения предстоящего вмешательства.
При 3D-моделировании толщина среза КТ-сканов должна составлять 3–5 мм, поскольку изображения с низким разрешением могут обусловливать расхождения между созданной моделью и фактической анатомией пациента [20]. Большая доза облучения, доставляемая пациентам при выполнении КТ-сканирования с толщиной срезов менее 5 мм, служит причиной их беспокойства. Она может увеличиваться на 75% по сравнению с таковой при использовании низкодозной КТ, более активно применяемой в клинической практике [21].
Имея трехмерную модель, анатомически идентичную ЧЛС пациента, хирург может более подробно анализировать каждый конкретный случай и выбирать оптимальный доступ по сравнению с тем, как это может быть реализовано при наличии только 2D-изображений. Оригинален тренажер, представленный Ю. Г. Аляевым и соавт. [9], состоящий из двух частей: небиологической 3D-печатной мягкой модели почки с воспроизведенными интраренальной сосудистой и полостной системами и напечатанной с помощью 3D-принтера модели туловища человека. На данном тренажере в условиях рентгеноперационной под ультразвуковым и рентгенологическим наведением проводилась пункция ЧЛС напечатанной почки. Несомненным преимуществом данного подхода является детальная симуляция всех основных этапов ПНЛ с учетом всех возможных осложнений в каждом конкретном случае. Наличие почечных сосудов позволяет предоперационно отработать наиболее безопасный путь к собирательной системе почки, что в свою очередь способствует снижению интра- и постоперационных осложнений. К недостаткам данной модели, на наш взгляд, можно отнести трудности 3D-печати этой сложной конструкции, высокую стоимость и невозможность ознакомления клинических ординаторов с 3D-анатомией ЧЛС конкретного пациента.
H. Atalay et al. [7] использовали персонализированные 3D-печатные модели ЧЛС при консультировании больных, которым предстояла ПНЛ. Они представляли собой цельную бесцветную копию ЧЛС почки, напечатанной на 3D-принтере с использованием КТ-данных пациентов. Их использование обеспечило достоверно лучшее понимание пациентами как основных параметров анатомии пораженной почки, так и возможных осложнений, которые могут возникать в результате предстоящего вмешательства. Однако эти модели были одноцветными, что может затруднять понимание клиническим ординатором или пациентом анатомии ЧЛС, локализацию разных групп чашечек (нижняя, средняя и верхняя), а также направление задних и передних чашечек. Кроме того, время для изготовления может быть слишком большим, особенно с учетом того, что готовая к использованию модель может быть напечатана не с первой попытки.
В настоящем исследовании мы показали, что возможность частичной или полной разборки согласно цветовой сегментации групп чашечек позволяет не только точно определять количественные признаки ЧЛС конкретного пациента, но и получать ответы на важные для планирования и прогнозирования результатов ПНЛ вопросы. При использовании данной методики формирования 3D-модели все опрошенные нами клинические ординаторы лучше понимали анатомию ЧЛС и определяли оптимальную чашечку для основного доступа. Выбор ординаторами чашечки для второго доступа после изучения печатных моделей значимо не улучшился, что может быть связано с отсутствием опыта, играющего существенную роль в данном вопросе.
Следует отметить пользу цветового кодирования каждой группы чашечек. Как мы уже упоминали выше, опытный уролог контролировал этот момент и определял границы сегментации. Таким образом, неопытным ординаторам легче развивать способность определять как точный уровень каждой группы чашечек, так и их ориентацию. Более того, разработанные нами модели потенциально могут быть использованы во время операции с целью внутрипросветной виртуальной навигации, для проведения которой необходимо специальное программное обеспечение.
Среди ограничений нашей работы можно отметить следующее. Во-первых, все ординаторы, включенные в наше исследование, проходили обучение в городских больницах, что могло сказаться на уровне их начальной подготовки. Во-вторых, мы не размещали печатный камень внутри созданной модели, что потенциально могло бы улучшить результаты обучения. В-третьих, полезность 3D-печатных моделей в клинической практике может быть оценена только в сочетании с некоторой визуальной модальностью, такой как КТ, которая используется урологом при выполнении пункции. В результате оценка модели без КТ-изображений может быть малоинформативной.
Заключение. 3D-модели ЧЛС с возможностью частичной и полной разборки перспективны для внедрения в программу обучения молодых специалистов и планирования ПНЛ. Изучение анатомии как отдельно взятой группы чашечек, так и всей ЧЛС позволяет выбирать оптимальную для перкутанной пункции чашечку при ПНЛ. Разработанная небиологическая разборная 3D-модель служит эффективным дополнением процесса обучения молодых урологов и обеспечивает формирование индивидуального подхода к обследованию и лечению пациентов.



