Введение. Использование современного медицинского оборудования в клинической практике не только повышает эффективность уже существующих способов лечения, но и способствует появлению и быстрому развитию новых более эффективных методов диагностики и лечения. Одним из новых направлений в области хирургического лечения является воздействие низких температур хладагента на биологические ткани (криотерапия и криохирургия). Технический прогресс в медицине привел к созданию нескольких типов криоаппаратов, использующих эффект дросселирования газов. В качестве хладагента применяются жидкий азот, углекислый газ, закись азота, гелий или аргон. В современной урологической практике с использованием аргона и гелия в качестве хладагента выполняется криоабляция при раке почки и раке предстательной железы. Для этого используются криоустановки третьего и четвертого поколений [1–3]. Также подробно изучено влияние данных хладагентов на ткань почки и предстательной железы [4–6]. В зарубежной литературе имеются данные о выполнении криобиопсии и криоабляции на основе углекислого газа в колопроктологии, торакальной хирургии и гастроэнтерологии [7–10]. Однако возможность применения в урологической практике углекислого газа в качестве хладагента и его влияние на ткань мочевого пузыря остаются не изученными.
Цель исследования: оценка возможности выполнения трансуретральной карбоксикриобиопсии (ККБ) и карбоксикриоэкстракции (ККЭ) опухоли мочевого пузыря (МП) для патоморфологического исследования, а также проведение сравнительного анализа сохранности (качества) биопсийного материала (ткани опухоли мочевого пузыря) при классической трансуретральной электробиопсии и карбоксикриобиопсии.
Материалы и методы. Экспериментальное исследование проводилось на базе Института урологии и репродуктивного здоровья человека Клинического центра Сеченовского Университета. В данном эксперименте мы проводили карбоксикриобиопсию и карбоксикриоэкстракцию опухоли мочевого пузыря с помощью гибкого криозонда Erbecryo-2 ErbeElectromedizin (Германия), который сконструирован и зарегистрирован для применения в торакальной хирургии для криоэкстракции (опухоль, биопсия ткани, удаление инородного тела, сгустков крови и слизистых пробок), криореканализации, а также для криодевитализации [11–13].
В настоящем эксперименте для проведения карбоксикриобиопсии и карбоксикриоэкстракции опухоли мочевого пузыря нами использован гибкий криозонд Erbecryo-2 диаметром 2,4 мм и длиной 1,15 м. Замораживающий эффект Erberyo-2 основан на эффекте Джоуля–Томсона. Эффект Джоуля–Томсона состоит в изменении температуры газа в результате медленного его протекания под действием постоянного перепада давления сквозь дроссель – локальное препятствие газовому потоку, например через пористую перегородку на пути потока. Температура физического замерзания углекислого газа (CO2) составляет минус 78,5°C [14]. Углекислый газ под высоким давлением подается из газового баллона в криозонд через криохирургическую установку.
Криоустановка позволяет регулировать поток углекислого газа и время замораживания. Проходя через узкую трубку зонда, углекислый газ попадает в полый наконечник зонда. В момент перехода из узкой части трубки криозонда в широкую часть наконечника углекислый газ за счет большой разницы давления подвергается резкой декомпрессии. В тот момент за счет эффекта Джоуля–Томсона газ очень быстро охлаждает кончик зонда. В зависимости от давления СО2 в системе и размера зонда на кончике гибкого криозонда возможно создание температуры от минус 35°C до минус 50°C.
Исходно для оценки возможности проведения карбоксикриоэкстракции в эксперименте нами использовались фрагменты опухоли мочевого пузыря, полученные при плановой трансуретральной резекции (ТУР) стенки мочевого пузыря с образованием.
Клиническое наблюдение № 1. У пациента В. 65 лет, по данным проведенного обследования (ультразвуковое исследование, магнитно-резонансная томография органов малого таза), выявлено объемное образование мочевого пузыря размером 45х24 мм по правой боковой стенке мочевого пузыря.
С целью верификации диагноза и избавления пациента от опухоли мочевого пузыря пациенту выполнена трансуретральная резекция.
Для оценки возможности выполнения криоэкстракции низкими температурами углекислого газа проводилось in vitro экспериментальное исследование.
После завершения оперативного пособия нами были получены фрагменты ткани опухоли мочевого пузыря различного размера. Карбоксикриоэкстракция выполнялась с использованием 5 фрагментов ткани опухоли МП от 4 мм до 23 мм (рис. 1). После размещения фрагментов ткани в емкости с раствором NaCl 0,9% комнатной температуры к ней подводился кончик криозонда с последующей криозаморозкой. Время криозаморозки составляло 5–7 с. Во время криозаморозки происходила фиксация фрагмента ткани к кончику криозонда и последующая его экстракция (рис. 2).

В результате проведенного эксперимента выполнена криоэкстракция всех пяти фрагментов ткани. Продемонстрировано, что для криоэкстракции углекислый газ в качестве хладагента может быть эффективно применен.
По данным патоморфологического исследования, биоптатом во всех представленных фрагментах опухоли мочевого пузыря выражена коагуляция ткани (результат ТУР), отчетливо видны клетки опухоли, местами с выраженными признаками атипии и ядерного полиморфизма, а также клетки перитуморальной воспалительной инфильтрации. Базальная мембрана не прослеживается в связи с инфильтрирующим ростом опухоли (рис. 3).
Клиническое наблюдение № 2. Пациент Б. 57 лет. По данным проведенного обследования (УЗИ, МРТ ОМТ), выявлено три образования мочевого пузыря. По задней стенке определяется образование размером 19х14 мм, по правой боковой стенке – размерои 12х12 мм, по левой боковой стенке – размером12х8 мм без признаков инвазии в мышечную оболочку. С целью морфологической верификации, удаления опухолей мочевого пузыря, а также предотвращения прогрессирования онкологического процесса больному показано эндоскопическое трансуретральное оперативное пособие. Обязательным условием экспериментального исследования было наличие письменного согласия больного.
После проведения спинально-эпидуральной анестезии цистоскоп был проведен через уретру до мочевого пузыря. Использовался цистоскоп компании Karl Storz 25 Ch с рабочим каналом диаметром 4 мм (12 Сh). При цистоскопии выявлено три нежноворсинчатых образования с узкими ножками по правой боковой, левой боковой и задней стенке мочевого пузыря. Далее по рабочему каналу цистоскопа проводился гибкий криозонд диаметром 2,4 мм. Была выполнена карбоксикриобиопсия опухоли по правой боковой стенке. Криозонд подводился к опухоли и далее выполнялась заморозка опухоли с целью биопсии. Время непосредственно криозаморозки и фиксации фрагмента опухоли МП к кончику зонда составило 15 с. Чтобы избежать дефиксации (потери) биоптата при его извлечении по тубусу инструмента, криозаморозка продолжалась до тех пор, пока гибкий криозонд вместе с биоптатом не оказывался вне организма.
Техника карбоксикриобиопсии опухоли МП. После подведения кончика криозонда к ткани опухоли по левой боковой стенке (необходим плотный контакт кончика криозонда с тканью опухоли) выполнена криозаморозка с экспозицией – 15 с (рис. 4а), после чего осуществляется тракция опухоли (как при щипковой биопсии) до получения фиксированного к кончику зонда фрагмента опухоли МП (рис. 4б).
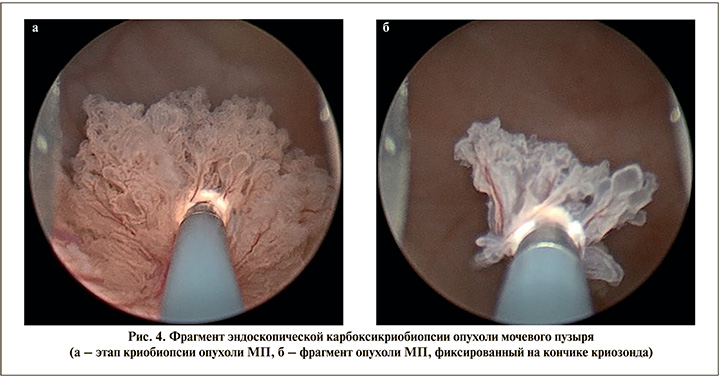
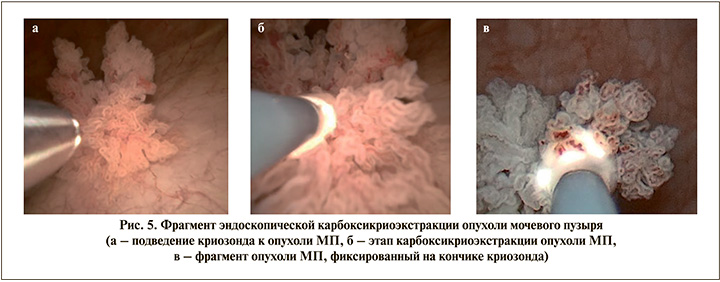
Далее нами была выполнена криобиопсия и тракция крупного фрагмента опухоли МП у этого же пациента для оценки возможности карбоксикриоэкстракции крупного фрагмента опухоли МП (рис. 5).
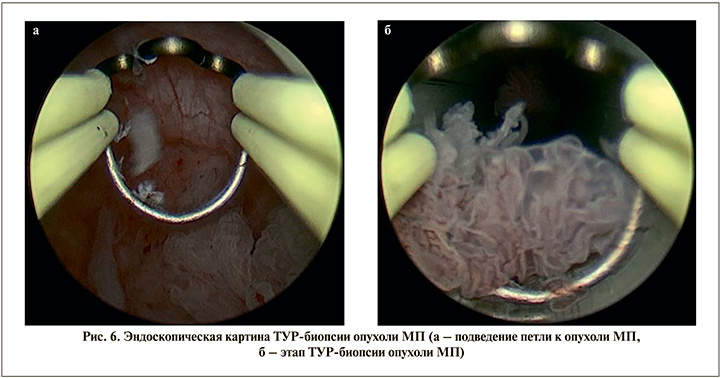
Для сравнительного гистологического анализа фрагмента опухоли МП, полученного путем криозаморозки, с фрагментом опухоли, удаленной с помощью биполярной петли, пациенту выполнена ТУР-биопсия (рис. 6) опухоли, располагающейся по задней стенке. После получения биоптата пациенту выполнена классическая биполярная трансуретральная резекция стенок мочевого пузыря с опухолями с последующим гемостазом в области резекции. По завершении эксперимента полученный материал отправлялся на патоморфологическое исследование (рис. 7)

Результаты исследования. По данным патоморфологического исследования, в исследуемых материалах после карбоксикриобиопсии и карбоксикриоэкстракции (рис. 8, 9) отчетливо определяются сосочковые (папиллярные структуры) опухолевой ткани с признаками слабовыраженного полиморфизма ядер. Отсутствуют признаки коагуляции эпителиального и стромального компонентов. Эпителий частично слущен в связи с мягкой консистенцией и ворсинчатой структурой самой опухоли. Прослеживается преимущественно сохранный поверхностный слой клеток. Строма сосочков опухоли рыхлая, отечная, с множественными тонкостенными сосудами и слабой лимфоидной инфильтрацией. Сохранная базальная мембрана с четкой границей. В подслизистой основе тонкостенные сосуды и лимфо-макрофагальная инфильтрация. При большом увеличении скана стеклопрепарата после карбоксикриоэкстракции можно оценить состав клеточного инфильтрата. В просветах сосудов отчетливо определяются клеточные элементы, такие как эритроциты и лейкоциты.
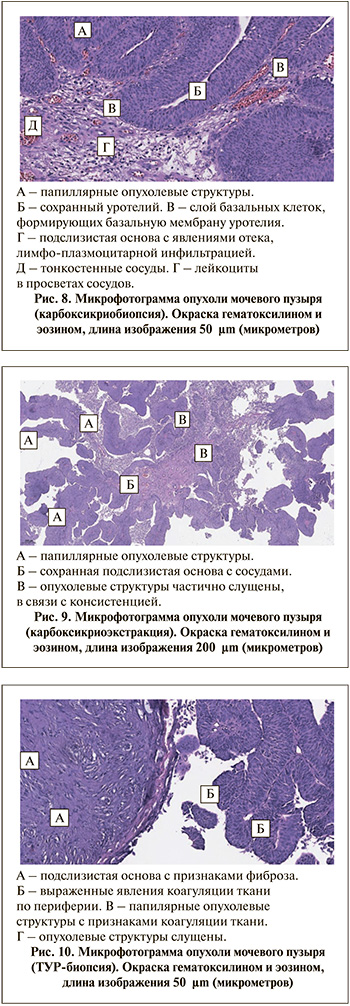
В исследуемом материале после ТУР-биопсии (рис. 10) определяются папиллярные опухолевые структуры с частично слущенным поверхностным слоем уротелия и признаками коагуляции. Подслизистая основа местами с признаками фиброза и выраженными явлениями коагуляции ткани по периферии. Сосочки опухоли прилежат близко друг к другу, между ними отдельные кровоизлияния и сосуды. Также отмечаются артефакты сдавливания.
Обсуждение. Трансуретральная резекция МП по-прежнему является золотым стандартом и самым часто применяемым методом в диагностике и лечении локализованного рака мочевого пузыря [15]. Однако имеют существенные недостатки, а именно интра- и послеоперационные осложнения, такие как обтураторный синдром, который можем приводить к неконтролируемой перфорации мочевого пузыря [16]. Кроме этого к недостаткам относится и воздействие ТУР-биопсии на качество биопсийного материала, что проявляется в виде прижигания и термического воздействия на ткань опухоли, наличия артефактов от сдавливания и разрушения опухолевой ткани, что может существенно осложнять оценку степени дифференцировки опухолевых клеток ввиду их некроза, затрудняет проведение достоверного патоморфологического исследования и верификацию диагноза [17]. Все вышеизложенное послужило причиной поиска новых более эффективных и щадящих методов получения и удаления из МП биопсийного материала при опухоли мочевого пузыря. Наше исследование показало, что применение карбоксикриобиопсии и карбоксикриоэкстракции опухоли не приводит к ее разрушению и позволяет выполнять полноценное гистологическое исследование и осуществлять установление диагноза.
Выводы. Опыта применения карбоксикриобиопсии и карбоксикриоэкстракции опухоли мочевого пузыря на установке Erbecryo-2 на момент проведения данного эксперимента в мире не существует. В проведенных экспериментальных исследованиях мы впервые выполнили карбоксикриобиопсию и карбоксикриоэкстракцию опухоли мочевого пузыря и считаем, что исследования в этом направлении для создания отечественной криоустановки на основе углекислого газа имеют клиническую перспективу.
Криобиопсия и криоэкстракция на основе углекислого газа (карбоксикриобиопсия и карбоксикриоэкстракция) позволяют получать и эвакуировать биопсийный материал опухоли МП без признаков коагуляции ткани и артефактов сдавливания, как в случае ТУР-биопсии. Кроме того, при карбоксикриобиопсии отсутствует обтураторный синдром, а удаление опухолевой ткани из МП (карбоксикриоэкситракция) позволяет лучше сохранять биоптат для проведения патоморфологического исследования и верификации точного диагноза. Данные эксперименты показали, что криобиопсия и криоэкстракция на основе углекислого газа являются выполнимыми процедурами, а также позволили оценить влияние низких температур углекислого газа на ткань мочевого пузыря.



