Введение. Мочекаменная болезнь (МКБ) является одной из наиболее актуальных клинических проблем урологии, так как частота выявления заболевания ежегодно растет. Значительная распространенность уролитиаза (не менее 5% населения индустриально развитых стран) определяет целесообразность изучения этиологии и патогенеза, совершенствования эффективных методов профилактики, методов диагностики и внедрения новых технологий лечения [1].
В последние годы заболеваемость МКБ напрямую связана с глобальными демографическими сдвигами. Постоянное смещение возрастной пирамиды общества развитых стран вследствие увеличения доли пожилых и старческих групп населения приводит к увеличению вероятности заболевания МКБ, которая в возрастной группе 65–69 лет составляет 8,8% у мужчин и 5,6% у женщин, а возрастной группе 30–35 лет – 3,7 и 2,8% соответственно [2].
Распространенность заболеваемости уролитиазом за последние 20 лет удвоилась в таких странах, как США, Италия, Германия, Испания, Япония, причем особенные темпы роста заболевания зафиксированы в последние годы в связи с увеличением продолжительности жизни населения [3]. Так, например, по данным на 2012 г., в США мочекаменной болезнью страдают 10,6% мужчин и 7,1% женщин, тогда как в 1994 г. данные показатели составляли 6,3 и 4,1% соответственно [4]. В Великобритании соответствующие показатели достигают 8 и 4% соответственно. Необходимо отметить, что в течение первых 5 лет заболевания у 25% пациентов наблюдается рецидив камнеобразования [5].
По мнению E. N. Taylor et al. [6] и I. H. Chang et al. [7], основные причины такой неблагоприятной динамики заложены в изменении образа жизни и питания людей, выражающихся в эпидемии метаболического синдрома, а также в глобальных климатических изменениях [8]. Кроме того, МКБ связана с такими заболеваниями, как сахарный диабет, ишемическая болезнь сердца, бронхиальная астма, артериальная гипертензия, болезнями желчного пузыря, желчевыводящих путей и артрозами [9–11].
Абсолютное число зарегистрированных больных МКБ в России с 2002 по 2009 г. увеличилось на 17,3%, причем рост показателя в 2009 г. по сравнению с 2008-м составил 3,5% (с 502,5 до 520,2 зарегистрированного случая на 100 тыс. человек) [12]. Мочекаменная болезнь занимает одно из первых мест среди урологических заболеваний (в среднем по России заболеваемость составляет 34,2%), доля больных МКБ среди всех пациентов урологических стационаров достигает 30–40% [13]. У большинства пациентов МКБ выявляется в наиболее трудоспособном возрасте: 30–50 лет [14, 15].
В настоящее время, когда дистанционная литотрипсия (ДЛТ) и рентген-эндоскопическая хирургия (чрескожная нефролитотрипсия [ЧНЛТ], ретроградная интраренальная хирургия [РИРХ], уретероскопия) широко применяются в лечении больных МКБ, остается открытым вопрос о разработке диагностического алгоритма, позволяющего выбирать оптимальный способ удаления конкремента, а также предупреждения осложнений в послеоперационном периоде. Актуальность совершенствования методов лучевой диагностики для больных МКБ определяется распространенностью заболевания. Точная оценка исходного функционального состояния почки клинически значима для повышения результативности проводимого лечения.
Научно-технический прогресс лучевых методов исследования, а также активное внедрение междисциплинарного подхода к клинической практике открывают новые возможности использования таких методик, как КТ-перфузия, в диагностике гемодинамически значимых изменений у пациентов с МКБ.
Цель исследования: изучить изменения гемодинамики в корковом и мозговом слоях почек пациентов с камнями мочеточника, используя метод КТ-перфузии.
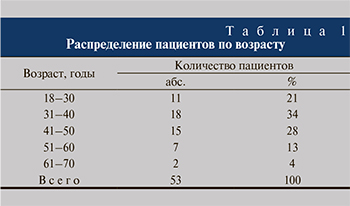 Материалы и методы. За период с декабря 2017 по май 2019 г. в Сеченовском Университете на базе Русско-Японского центра визуализации УКБ № 1 и Института урологии и репродуктивного здоровья человек КТ-перфузия почек выполнена 53 пациентам с диагнозом «МКБ, камень верхней трети мочеточника», подтвержденным данными УЗИ. Исследуемую группу составили 32 (60%) мужчины и 21 (40%) женщина в возрасте от 18 до 70 лет (табл. 1).
Материалы и методы. За период с декабря 2017 по май 2019 г. в Сеченовском Университете на базе Русско-Японского центра визуализации УКБ № 1 и Института урологии и репродуктивного здоровья человек КТ-перфузия почек выполнена 53 пациентам с диагнозом «МКБ, камень верхней трети мочеточника», подтвержденным данными УЗИ. Исследуемую группу составили 32 (60%) мужчины и 21 (40%) женщина в возрасте от 18 до 70 лет (табл. 1).
Пациенты были разделены на три группы в соответствии с результатами клинического обследования (УЗИ, МСКТ):
- без дилатации чашечно-лоханочной системы (ЧЛС) – 18 (34%) человек;
- с уретеропиелоэктазией – 20 (38%) человек;
- с уретерокаликопиелоэктазией – 15 (28%) человек.
Критерии исключения: пациенты с почечной недостаточностью (креатинин сыворотки больше 1,5 мг/дл [114 моль/л]), с двусторонними камнями мочеточника, а также с единственной почкой и несовершеннолетние пациенты (менее 18 лет).
Пациентам проведено оперативное лечение с использованием дистанционной ударно-волновой литотрипсии (ДУВЛ) – 29 (55%) человек, и уретероскопии – 24 (45%).
До операции всем пациентам была выполнена МСКТ с КТ-перфузией с построением перфузионных карт на рабочей станции для получения перфузионных показателей кровотока коркового и мозгового слоев почки.
Перфузионные исследования были выполнены на 640-срезовом спиральном компьютерном томографе Aquilion One («Toshiba Medical Systems», Япония) с толщиной среза 0,5 мм в режиме мягкотканной реконструкции. Чтобы минимизировать дозу облучения, выбран протокол со следующими параметрами: 100 кВ в качестве напряжения в трубке, экспозиция 100 мАс, достаточных для определения зоны динамического сканирования максимальной шириной 160 мм. Другие параметры сканирования: размеры коллиматора – 0,5×320 мм, размеры матрицы – 512×512 мм, поля зрения – 320 – 350 мм и время ротации трубки – 0,5 с.
Ширина поля сканирования пациента составила 160 мм.
Учтя отсутствие в настоящее время стандартизированного протокола исследования КТ-перфузии почек, разработали собственный алгоритм исследования. Через внутривенный периферический кубитальный инъекционный катетер 18 G пациенту внутривенно вводили неионный контрастный препарат Ультравист-370 (из расчета 0,5 мл препарата на 1 кг массы тела пациента) со скоростью 7 мл/с, 50 мл 0,9%-ного физиологического раствора вводили с той же скоростью после внутривенного введения контрастного вещества. Исследование выполняли в объемном режиме через 7 с после начала сканирования и продолжали с интервалом 2 с с 12-й по 30-ю секунду от начала сканирования. После 3-секундной паузы использовали стандартные 3-секундные интервалы с 33-й по 48-ю секунду от начала сканирования. После 7-секундной паузы использованы 10-секундные интервалы с 55-й по 110-ю секунду от начала сканирования. При проведении КТ-перфузии необходимо исключить артефакты движения, поэтому обязательно инструктирование пациента о необходимости сохранения неподвижности и задержки дыхания во время исследования. Цикл динамического сканирования длится около 1 мин, и задерживать дыхание в течение этого времени зачастую представляется довольно сложным для пациента. В подобных ситуациях ему рекомендуют использовать поверхностное дыхание, эффективность которого доказана в исследовании S. Kandel et al. [16].

Обработку полученных данных для получения кривой плотности/времени осуществляли на рабочей станции Vitrea при помощи протокола 4D Single Imput Perfusion, в процессе которого измеряется плотность ткани в двух различных областях исследования – ROI (region of interest): в афферентной артерии (брюшной аорте) и интересующей ткани (корковый и мозговой слои почки). Оценку перфузии ткани осуществляли с помощью метода одиночной наклонной кривой (рис. 1). Суть данного метода в том, что контрастное вещество при внутривенном введении распределяется только в одном объеме (например, в пространстве внутри сосудистого русла). Данный фактор позволяет рассчитывать скорость кровотока – AF (arterial flow), которая определяется как скорость прохождения определенного объема крови через заданный объем ткани за единицу времени и имеет размерность мл/100 г/мин (рис. 2, 3). Также при анализе данных применяли метод Патлака [17–22], в основу которого положено динамическое распределение контрастного вещества между двумя объемами: внутрисосудистым и внесосудистым. Данный метод позволяет рассчитывать эквивалентный объем кровенаполнения – BV (blood volume), определяемый как общий объем крови, проходящий через сосуды выбранного участка ткани и имеющий размерность мл/100 г.
Статистический анализ проведен с использованием PTC Mathcad Prime 5.0. Для параметров перфузии (AF, BV) были рассчитаны средние и стандартные отклонения измерений. Был использован выборочный парный t-критерий для сравнения показателей перфузии в почках с камнями мочеточника с показателями перфузии в контралатеральных почках. С целью изучения взаимосвязи между значениями перфузии и дилатации ЧЛС выполнен корреляционный анализ Пирсона. Уровень значимости p был принят меньшим 0,05.
Результаты. Исследование успешно выполнено всем 53 пациентам без каких-либо технических проблем или побочных реакций на введение рентгенконтрастного вещества.
У пациентов без дилатации ЧЛС средние показатели коркового и мозгового кровотоков (AF), объема крови (BV) находились в пределах нормальных значений (табл. 2). Снижения показателей в контралатеральной почке также не выявлено.
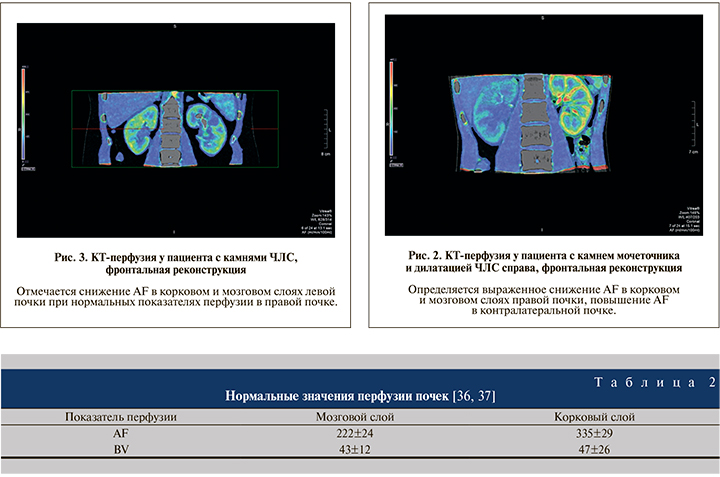
У пациентов с уретеропиелоэктазией выявлены существенные различия показателей кровотока AF в корковом (снижение на 27%) и мозговом (снижение на 34%) слоях в почке с камнем мочеточника относительно значений, полученных для контралатеральной почки. Показатели перфузии BV в корковом и мозговом веществах (табл. 3) были ниже нормальных значений перфузии; снижений значений перфузии в контралатеральной почке отмечено не было.

У пациентов с уретерокаликопиелоэктазией отмечено выраженное снижение показателей перфузии на стороне обструкции по сравнению с показателями контралатеральной почки: AF в корковом и мозговом слое почки снижен на 55 и 58% соответственно, BV – на 58 и 34% соответственно. Однако в контралатеральной почке данные показатели превышали нормальные значения перфузии, что связано со степенью функционального нарушения почки с камнем мочеточника. Снижение показателей перфузии у пациентов с уретерокаликопиелоэктазией более существенно по сравнению с таковым у пациентов с уретеропиелоэктазией, т.е. степень обструкции напрямую влияет на изменение кровотока.
Статистически значимые корреляционные зависимости обнаружены между изменениями значений AF и BV в корковом и мозговом слоях в зависимости от степени нарушения функции ЧЛС. Для корковых AF и BV коэффициент корреляции составил 0,689 и -0,564 соответственно при p<0,001, для мозговых AF и BV значения коэффициента корреляции были равны -0,489 и -0,412 соответственно при р<0,001.
Обсуждение. КТ-перфузия – новая неинвазивная технология, которая позволяет количественно оценивать изменения скорости почечного кровотока, а также функциональные изменения почек [23, 24].
КТ-перфузия основывается на временных изменениях в ткани после введения йодсодержащих контрастных веществ. Расчет стандартных показателей КТ-перфузии осуществим из-за того, что контрастное усиление линейно пропорционально концентрации контраста в ткани. Это линейное отношение служит основным преимуществом КТ перед другими лучевыми методами диагностики. Несколько групп исследователей [25–29] доказали значимость КТ-перфузии для оценки функции почек.
В проведенном нами исследовании метод КТ-перфузии был успешно использован для оценки гемодинамических изменений паренхимы почек пациентов с камнями верхней трети мочеточника, так как объективная оценка анатомического и функционального состояния почек важна для определения оптимального лечения и оценки его эффективности.
Показатели перфузии, полученные на предоперационном этапе в данном исследовании, – одни из независимых факторов, на основании которых можно осуществлять контроль восстановления функции почек у пациентов с различными формами МКБ. Количественная оценка параметров перфузии почек может помочь урологам отслеживать эффективность лечения и влиять на выбор метода лечения. По сравнению с другими методами визуализации КТ-перфузия – это быстрый и безопасный метод визуализации, позволяющий оценивать не только морфологические, но и функциональные характеристики почек. По сравнению с другими методами визуализации КТ-перфузия позволяет быстро и безопасно оценить не только морфологические, но и функциональные характеристики почек.
Результаты исследования продемонстрировали снижение перфузионных параметров пациентов с камнями мочеточника, что свидетельствует об аномально низкой перфузии в корковом и мозговом слоях у пациентов с односторонней обструкцией мочеточника. Длительное существование обструкции сопряжено с высоким риском гломерулярного склероза, уменьшения почечных клубочков и развития интерстициального фиброза [30–33].
В корковом и мозговом слоях среднее значение АF контралатеральных почек у пациентов с дилатацией ЧЛС было статистически больше, чем в контралатеральных почках пациентов другой группы. У пациентов с камнями мочеточника без выраженного расширения ЧЛС значительного компенсаторного увеличения АF не произошло. Данное исследование показало, что компенсаторный рост показателей перфузии контралатеральной почки в основном связан со степенью функционального нарушения почки с камнем мочеточника. Другим возможным объяснением данного феномена могут быть индивидуальные различия в показателях перфузии. Нами были отмечены незначительные уменьшения показателей перфузии у пациентов старше 50 лет. Это означает, что почечный кровоток может изменяться в зависимости от физиологического состояния, в том числе и из-за возрастного фактора.
Таким образом, полученные результаты демонстрируют важность оценки почечного кровотока в предоперационном периоде. Они согласуются с данными, опубликованными L. Pelaez et al. [34] и S. Sheehan et al. [35]. В совокупности эти данные подтверждают, что параметры перфузии могут показывать гемодинамические изменения в оценке нарушений функции почек у пациентов с различными клиническими формами МКБ.
Заключение. В результате проведенного исследования установлено, что КТ-перфузия, выполненная на 640-срезовом компьютерном томографе, позволяет объективно оценивать изменения кровотока в почке у пациентов с камнями мочеточника. Показано, что снижение показателей перфузии (скорость кровотока, эквивалентный объем крови) у пациентов с уретерокаликопиелоэктазией более существенно, чем у пациентов с уретеропиелоэктазией, т.е. степень обструкции напрямую влияет на скорость кровотока. Кроме того, нами установлена обратная зависимость между степенью расширения ЧЛС и показателями перфузии в контралатеральной почке. Таким образом, КТ-перфузия представляет собой информативный и неинвазивный методы, позволяющие количественно оценивать функциональное состояние почки, степень и характер обструкции, что может иметь значение при выборе метода оперативного лечения, прогнозировании осложнений и дальнейшего течения МКБ.



