Введение. Почечно-клеточный рак (ПКР) – наиболее распространенная форма злокачественных новообразований ренальной ткани [1]. Согласно данным Европейской ассоциации урологов, в структуре опухолевых заболеваний паренхимы почки на долю ПКР приходится 2–3% всех видов рака с наибольшей встречаемостью в западных странах [2, 3]. По данным P. Lindblad, опубликованным в 2004 г., в мире встречаемость впервые выявленного ПКР повышается ежегодно в среднем на 2% [4].
В России частота таких случаев за период с 2005 по 2015 г. с каждым годом увеличивалась на 3,97%, при этом у 30–40% заболевших ПКР стал причиной смерти. По данным Министерства здравоохранения Российской Федерации, в 2015 г. число впервые выявленных злокачественных новообразований почки в России составило 15,6 на 100 тыс. населения, в 2016 г. – 16,3, увеличившись на 4,48%. Смертность за тот период выросла на 3,44% [5].
В европейских странах и США в 2012 г. ПКР был впервые диагностирован у 84,4 тыс. человек, для 34,7 тыс. из них болезнь закончилась летальным исходом [6, 7].
Согласно существующим мировым стандартам, тактика лечения опухолей почки зависит от их размеров и распространенности процесса [8]. Исключением служит тубулярная карцинома почки, которая во всех случаях требует скорейшего проведения радикальной нефрэктомии в связи с быстрым метастазированием. Методы органосохраняющей резекции почки (РП) применяются в случаях развития ПКР в единственной функционирующей почке при наличии данных о вероятной в дальнейшем функциональной недостаточности имеющегося парного органа, при стадии опухолевого роста Т1-2N0M0 [9 10, 11]. Иссечение новообразования в пределах здоровых тканей при ПКР позволяет максимально сохранять функциональный объем ренальной паренхимы [12–15], обеспечивать отрицательный хирургический край и отсутствие послеоперационных урологических осложнений [16].
Органосохраняющее удаление новообразования в пределах здоровых тканей представляет сложности при интрапаренхиматозном (эндофитном) варианте роста опухоли в ткани почки, встречающемся примерно в 10–20% случаев ПКР [17].
Dong Soo Park et al. [22] наблюдали 434 пациента с эндофитной формой ПКР. Из них 220 человек перенесли открытую радикальную нефрэктомию (РНЭ), 214 – открытую резекцию пораженной части органа в условиях холодовой ишемии, средняя продолжительность которой составила в среднем 44,5 мин. Согласно представленным данным, после РП уровень почечной функции был более высоким, нежели таковой после РНЭ. Авторы также отметили, что иссечение эндофитных опухолей связано с большей вероятностью развития осложнений по сравнению с результатами операций при экзофитном варианте расположения новообразований [18– 20].
Еще А. С. Переверзев в своих работах, датированных 1997 г., указывал, что онкологические результаты РП аналогичны таковым при РНЭ [21]. Одновременно РП служит фактором риска формирования почечной недостаточности после операции ввиду необходимости интраоперационной ишемизации органа и ишемически-реперфузионной альтерации нефроцитов-эффекторов. Степень риска развития осложнений значительно возрастает при иссечении новообразований, визуально не определяющихся на поверхности органа, что затрудняет интраоперационную идентификацию опухоли [22–25].
Обеспокоенность по поводу риска неадекватной оценки анатомо-топографических особенностей подлежащего удалению эндофитного образования, степени его резектабельности, а также повышенной вероятности развития осложнений, по-видимому, служит причиной того, что при хирургическом лечении пациентов с эндофитным ПКР стадий Т1–Т2 довольно часто применяется радикальная нефрэктомия. Тем не менее резекция почечной паренхимы при эндофитном характере роста в стадии Т1 в настоящее время используется все чаще и чаще [26, 27].
P. Zapala et al. в 2017 г. сообщили о результатах сравнения онкологических и клинических результатов после открытой РП с применением интраоперационной ультразвуковой визуализации, проведенной 46 пациентам с эндофитными и экзофитными (17 и 29 человек соответственно) новообразованиями размером от 25 до 27 мм. Во всех случаях продолжительность ишемии не превысила 20 мин. Течение пери- и послеоперационного периодов в группах с эндо- и экзофитными опухолями существенно не различалось. Положительный хирургический край и рецидив заболевания отмечены у одного пациента с эндофитным ростом и у четырех – с экзофитным. Уровень креатинина в сыворотке крови не изменялся в обеих группах в течение всего периода наблюдения. Авторы отметили, что при хирургическом лечении ПКР безопасность и эффективность открытой РП эквивалентны для эндо- и экзофитных опухолей одинакового размера и типа [28].
Применение интраоперационного ультразвукового (ультрасонографического) исследования в процессе РП позволяет в режиме реального времени получать необходимые сведения о расположении, размере и структуре эндофитного опухолевого разрастания, глубине его инвазии, топографии сосудов, кровоснабжающих новообразование, состоянии внутрипочечной гемодинамики, а также о наличии или отсутствии опухолевых узлов, не выявленных при проведении предоперационного КТ-сканирования [29].
Ряд авторов подчеркивают, что интраоперационный ультразвуковой контроль служит высокоинформативным методом диагностики состояния паренхимы и васкуляризации почек [30]. С целью улучшения визуализации новообразований во время хирургического вмешательства К. Ю. Ивахно и П. А. Карнаух маркировали контур опухоли соноконтрастными иглами, что позволило существенно повысить точность определения границ тканей, подлежащих резекции [31].
Kyung Hwa Choi et al. сообщили об успешном использовании интраоперационного УЗИ в 11 случаях робот-ассистированного иссечения эндофитных новообразований [32].
R. Gunelli et al. [36] продемонстрировали эффективность применения роботизированного ультразвукового зонда для обнаружения и определения местоположения интрапаренхиматозных опухолей малых размеров. Авторы провели 22 интраоперационные ультрасонографические идентификации внутрипочечных новообразований. После установления локализации опухоли была успешно выполнена робот-ассиcтированная энуклеация с ишемией, длившейся не более 13 мин [33].
Целью настоящего исследования стало сравнение результатов эндовидеохирургических органосберегающих вмешательств при эндофитном росте ПКР с использованием интраоперационного ультразвукового контроля и экстракорпоральной лапароскопически асисстированной методики.
Материалы и методы исследования. В рамках данного исследования c июля 2016-го по декабрь 2017 г. мы наблюдали 77 пациентов, находившихся на стационарном лечении по поводу рака почки в стадиях Т1aM0N0, T1bN0M0, T2аN0M0 с интрапаренхиматозной (эндофитной) локализацией (новообразования не контурировали на поверхности паренхимы). Размер опухолей варьировался от 2,5 до 7 см.
Из них лечились в СПбГБУЗ «Клиническая больница Святителя Луки» 49 больных, в клинике урологии СПбГБ № 2 – 28 больных. Размер опухолей варьировался от 2,5 до 7 см. Численность пациентов мужского и женского пола составила 66,2 и 33,8% соответственно. Возраст равнялся в среднем 59 лет у мужчин (43–75 лет) и 60 – у женщин (43–73 года).
В зависимости от применяемой технологии резекции сформировано три группы больных, сопоставимых по основным характеристикам подлежащих удалению новообразований (включая нефрометрические индексы). Различия между группами заключались в следующем: а) в первой группе (n=13) все этапы выполнялись через открытый доступ; б) во второй (n=12) – часть этапов осуществляли лапароскопически, часть – экстракорпорально; в) в третьей группе (n=52) проводили лапароскопические операции с визуализацией в формате 4К (Olimpus Visera 4K UHD) с интраоперационной ультразвуковой поддержкой (Philips CX50 с широкополостным интраоперационным датчиком L10-4lap).
Интраоперационный ультразвуковой датчик обеспечивал получение динамической серии двумерных изображений, на которых отражалась эхогенность различных внутрипочечных структур. Это позволяло установить наличие новообразования, определить его границы, площадь и объем, а также локализацию, в том числе расстояние от поверхности органа.
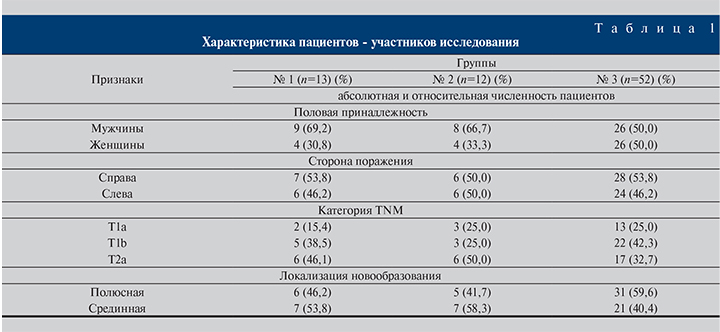
Общие сведения о пациентах – участниках исследования, а именно о гендерном составе групп, стороне поражения почки, стадийности процесса, а также о локализации новообразования представлены в табл. 1.
Результаты нефрометрической оценки резектабельности новообразований по шкале R.E.N.A.L. отображены в табл. 2.

В процессе исследования оценивали встречаемость послеоперационной кровопотери и развития хронической почечной недостаточности (ХПН), частоту положительного хирургического края, установленного при гистологическом исследовании, и другие осложнения, требовавшие повторного вмешательства.
Результаты. Кровотечение в раннем послеоперационном периоде наблюдалось у 5 пациентов. Трое из них относились к первой группе (23,1%) и перенесли экстракорпоральную резекцию с последующей аутотрансплантацией оперированной почки. Два случая были зарегистрированы в группе № 2 (16,7%).
Развитие хронической почечной недостаточности после вмешательства отмечено в группе № 1 (n=13) у двух (13,4%) больных и в группе № 2 (n=12) также у двух (16,7%) пациентов.
При гистологическом исследовании удаленной опухоли наличие положительного хирургического края констатировали в 2 случаях из 13 (13,4%) для участников первой группы и в 1 случае из 12 (8,3%) в группе № 2.
У 1 (7,7%) больного первой группы, в которой резекцию почки производили через открытый доступ, в раннем послеоперационном периоде была выявлена обструкция анастомоза, что потребовало повторного вмешательства.
Обсуждение. В настоящее время благодаря широкому внедрению современных методов лучевой диагностики чаще выявляют опухоли почки на стадиях Т1–T2, при которых возможно выполнение органосохраняющих операций.
В ситуациях, связанных с необходимостью хирургического лечения злокачественных новообразований почек, органосберегающее иссечение пораженного участка позволяет не только обеспечить радикальность лечебных мероприятий, но и максимально возможно сохранить функциональный потенциал ренальной ткани и функции организма в целом, облегчить возвращение человека к полноценной трудовой и социальной деятельности [34].
Удаление эндофитных опухолей технически более сложное по сравнению с таковым при экзофитном росте. При распространении процесса внутрь пораженной почки затруднениями для лапароскопического резекцирования пораженного органа могут стать глубинное расположение узла, его локализация в синусе, верхнем сегменте или по дорсальной поверхности почки. Все эти ситуации при применении лапароскопического доступа чреваты увеличением продолжительности вмешательства, периода тепловой ишемии почки, объема интраоперационной кровопотери [35].
Неполное выздоровление пациента после хирургического лечения методом ЛРП (рецидивы заболевания, формирование [усугубление] функциональной недостаточности сохраненной почечной паренхимы и др.) могут быть связанными с существующей вероятностью некорректной предоперационной оценки анатомо-топографических характеристик новообразования и степенью его резектабельности. По-видимому, именно поэтому при планировании хирургического вмешательства в случаях эндофитного роста, проблемных с клинической и технической точек зрения, отдается предпочтение радикальной нефрэктомии.
Одним из факторов, определяющих успех вмешательства при интрапаренхиматозном расположении опухоли, становится информированность хирурга об индивидуальных особенностях строения оперируемой почки, объеме, локализации, конфигурации подлежащего иссечению новообразования, характере его васкуляризации, в целом кровоснабжения почки и т.д. [36]. Следовательно, большое значение имеет не только качество визуального интраоперационного контроля границ опухоли, анатомии сосудов и чашечно-лоханочной системы в ходе вмешательства, но и предоперационная лучевая диагностика, которая позволяет планировать ход оперативного вмешательства и снижать вероятность неожиданной хирургической находки [37].
Интраоперационное УЗИ позволяет в режиме реального времени идентифицировать даже небольшие эндофитные разрастания, предоставляет необходимые данные и информацию об их размере, строении и масштабах инвазии, а также при использовании функции цветного картирования, особенностях васкуляризации опухоли.
Согласно данным, полученным в настоящем исследовании, в группе № 3, где хирургическое лечение проведено лапароскопически совместно с интраоперационной ультразвуковой навигацией, послеоперационный период протекал без кровотечений. Не отмечено случаев развития почечной недостаточности, нарушений оттока мочи.
Необходимо подчеркнуть, что при выполнении технически трудных нефронсберегающих вмешательств нами использованы совместно с ультразвуковой интраоперационной поддержкой видеосистемы с объемным изображением 3D или 4К, которые создавали наиболее реалистичное изображение зоны хирургического интереса, но не являлись определяющими успеха в этих клинически сложных случаях.
Заключение. Резекция почки – эффективный метод лечения пациентов с опухолями ренальной паренхимы, позволяющий добиться полного удаления всей опухолевой массы и сохранения почечной функции. Сведения, полученные в процессе интраоперационного УЗИ, обеспечивают рациональный выбор тактики хирургического лечения эндофитных образований, что существенно влияет на онкологические и клинические результаты хирургического вмешательства.
Анализ полученных данных позволил с высокой вероятностью предположить, что интраоперационное УЗ-сканирование в процессе нефронсберегающих вмешательств с достаточной точностью обеспечивает определение локализации эндофитных опухолей почки, позволяет минимизировать вероятность положительного хирургического края, определяет топографо-анатомическое взаимоотношение с чашечно-лоханочной системой, что важно для эффективной резекции эндофитных разрастаний без необходимости применения экстракорпоральной методики.
С учетом современных достижений ультразвуковых визуализационных технологий (в том числе интраоперационных) следует признать, что применение методики экстракорпорального иссечения пораженного фрагмента почки, пораженного эндофитными злокачественными разрастаниями, на сегодняшний день постепенно утрачивает свою целесообразность. Техническая сложность и продолжительность вмешательства, необходимость последующего точного гетеротопического расположения почки – все это повышает риск развития осложнений. Оптимальным методом радикального органосохраняющего удаления интрапаренхиматозных новообразований ренальной ткани служит лапароскопическая резекция ренальной ткани, выполняемая на фоне интраоперационного УЗИ пораженного органа.



