Введение. Несмотря на значительный прогресс в медицинской практике, более раннюю диагностику заболеваний, а также появление новых способов лечения урологических и онкологических пациентов, вопрос о таком патологическом состоянии в урологии как стриктуры и облитерации мочеточника по сей день остается актуальным.
Основные причины повреждения мочеточников: онкологические, гинекологические и урологические операции. Это связано с улучшением диагностики и выявляемости онкологических заболеваний, расширением показаний к оперативному и комбинированному лечению, появлению новых технических средств и оперативных пособий для органосохраняющих операций [1–4]. Наиболее часто травмы мочеточников возникают в акушерско-гинекологической практике: до 30% [5–7]. Из них 86% – при онкогинекологических процессах после абдоминальной гистерэктомии и сальпингоофорэктомии. Повреждения мочеточника в 5–15% являются следствием оперативных вмешательств в сосудистой и абдоминальной хирургии [8]. Большинство повреждений обусловлено операциями на толстой и прямой кишке (0,9–10% случаев) [9]. В урологической практике стриктуры и облитерации мочеточников возникают на фоне длительного стояния конкремента независимо от варианта оперативного лечения или после перенесенных эндоурологических вмешательств. Оперативных пособий по реконструкции верхних мочевыводящих путей выполняется много: различные модификации уретеропиелоанастомоза, кишечная пластика или аутотрансплантация почки с резекцией суженного отдела мочеточника, уретероуретероанастомоз, прямой или непрямой уретероцистоанастамоз [10, 11]. Зачастую объем оперативного лечения в каждом конкретном случае решается интраоперационно с учетом состояния тканей и анатомических особенностей пациента. Нередки случаи рецидива заболевания после перенесенной реконструктивно-пластической операции, требующие повторного лечения [6]. В связи с этим данная область урологии требует дальнейшего изучения, анализа и попыток улучшения.
Цель исследования: ретроспективный анализ результатов лечения пациентов со стриктурами мочеточников путем оценки эффективности различных методов лапароскопических операций.
Материалы и методы. Материалом для данного исследования послужили результаты лечения пациентов со стриктурами всех отделов мочеточника, кроме ЛМС. Нами проведен ретроспективный анализ лечения 30 пациентов, прооперированных в условиях ЦКБ ГА с 2013 г. по настоящее время. В исследование вошли 18 женщин и 12 мужчин. Средний возраст мужчин составил 54,0±8,1 (29–79 лет), женщин – 51,0±8,5 года (от 28 до 74 лет).
 Дренирование верхних мочевыводящих путей 13 (46,43%) пациентам проводилось посредством нефростомических дренажей, 15 (53,57%) – мочеточниковых стентов.
Дренирование верхних мочевыводящих путей 13 (46,43%) пациентам проводилось посредством нефростомических дренажей, 15 (53,57%) – мочеточниковых стентов.
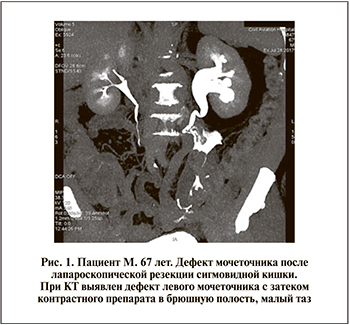
Обследование пациентов перед оперативным вмешательством включило изучение анамнеза заболевания, физикальный осмотр, оценку общесоматического статуса, лабораторные методы исследования (общеклинические и биохимические анализы крови и мочи, бактериологическое исследование мочи), инструментальное обследование (УЗИ почек, антеградную и ретроградную уретеропиелографию, динамическую нефросцинтиграфию, мультиспиральную компьютерную томографию, рис. 1).
Согласно результатам проведенных рентгенурологических обследований, средняя протяженность рубцового сужения мочеточника составила 5,2±3,7 см (рис. 2).
При динамической нефросцинтиграфии функция почки на стороне поврежденного мочеточника составила 12–48%, функция контрлатеральной почки – 88–52%.
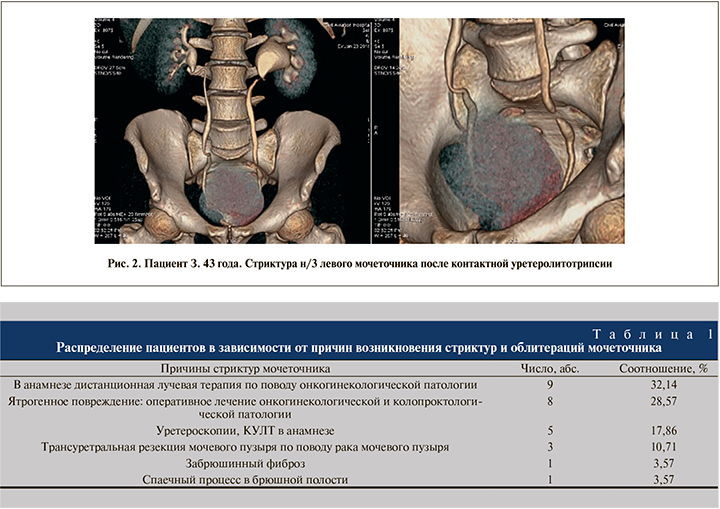
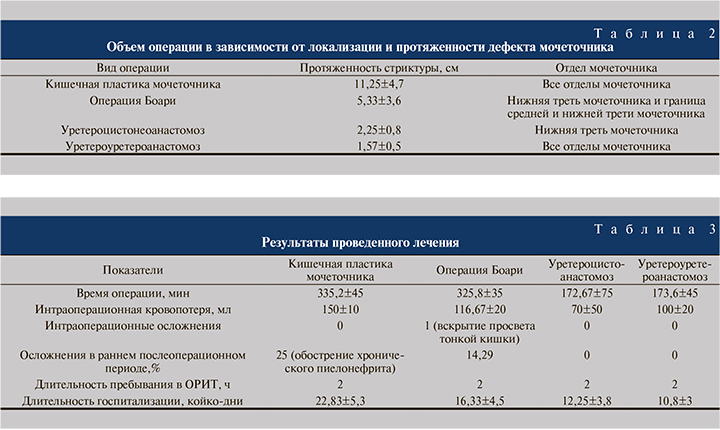
По данным проведенного обследования, все пациенты были распределены в зависимости от причин возникновения стриктур мочеточника (табл. 1).
На предоперационном этапе оценивались локализация и протяженность стриктуры мочеточника, а также причина возникновения патологического процесса, после чего определялась тактика оперативного лечения (табл. 2). При протяженности стриктуры более 10 см вне зависимости от уровня повреждения мочеточника выполнялась кишечная пластика. При дефекте мочеточника менее 10 см пластика с использованием собственных тканей мочевыделительной системы. При непротяженной стриктуре с целью восстановления проходимости дистальных отделов мочеточников выполнялась операция прямого уретероцистоанастомоза. Однако для ликвидации дефекта тазового отдела мочеточника длиной более 5 см использовалась пластика по методу Боари.
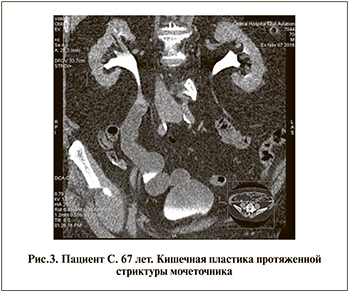
За период с 2013 по 2019 г. пациентам были выполнены следующие виды оперативных вмешательств: кишечная пластика мочеточника – 8 (28,6%) (рис. 3), операция Боари – 7 (25%), уретероцистоанастомоз – 10 (35,7%), уретероуретероанастомоз – 3 (10,7%).
 Все этапы оперативных вмешательств выполнялись лапароскопически. В табл. 2 приведен объем проведенного оперативного лечения в зависимости от протяженности и локализации стриктуры мочеточника.
Все этапы оперативных вмешательств выполнялись лапароскопически. В табл. 2 приведен объем проведенного оперативного лечения в зависимости от протяженности и локализации стриктуры мочеточника.
Результаты. У 23 (76,66%) пациентов послеоперационный период имел гладкое течение. Через 1 мес. были удалены мочеточниковые стенты; атак острого пиелонефрита, рецидивов заболевания за период наблюдения от 7 мес. до 3 лет не отмечено.
У 3 пациентов, перенесших операцию Боари, диагностированы стриктуры анастомоза, которые после дообследования (МСКТ мочевыводящих путей с контрастированием, динамическая нефросцинтиграфия, антеградная уретеропиелография) были признаны компенсированными (табл. 3).
У 3 (33,3%) из 9 пациенток с постлучевыми стриктурами мочеточников отмечены стриктуры анастомозов. В первом наблюдении (операция Боари) анастомоз по итогам обследования признан компенсированным, повторного оперативного лечения не проводилось. Во втором наблюдении после кишечной пластики мочеточников (наложение анастомоза петли тощей кишки с мочевым пузырем и мочеточниками у пациентки с постлучевыми стриктурами обоих мочеточников вследствие комбинированного лечения рака шейки матки) в послеоперационном периоде отмечены явления тонкокишечной непроходимости, что потребовало операции наложения обходного еюносцендоанастомоза «бок-в-бок». Стриктура энтероцистоанастомоза компенсированная. В третьем наблюдении после кишечной пластики аппендиксом сформировалась стриктура анастомоза, в связи с чем через год выполнена кишечная пластика участком подвздошной кишки.
Одной пациентке с постлучевой стриктурой нижней трети правого мочеточника в связи с прогрессированием вторичного сморщивания почки и полной утраты ее функции выполнена лапароскопическая нефрэктомия через 1,5 года.
Обсуждение. Реконструктивно-пластическая хирургия мочевых путей – один из наиболее востребованных сегодня и динамично развивающихся разделов оперативной урологии. Это обусловлено неуклонным ростом количества больных с ятрогенными и послеоперационными повреждениями органов мочевыделительной системы, последствием которых являются рубцовые сужения, облитерации мочеточников [12]. Хирургические вмешательства с применением собственных неизмененных отделов мочевых путей заслуженно считаются самым предпочтительным вариантом восстановления их проходимости. Наибольшее признание при восстановлении проходимости дистальных отделов мочеточников справедливо получила операция прямого урететроцистоанастомоза [2]. А непрямой уретероцистоанастомоз с помощью лоскута из стенки детрузора позволяет заместить до 10 см мочеточника [12]. При протяженных стриктурах мочеточника возможности пластических операций с применением собственных отделов мочевых путей ограничены. В таких случаях прибегают к заместительной кишечной пластике. Данная хирургическая тактика позволяет ликвидировать обструкцию верхних мочевых путей на любом уровне поражения и не зависит от протяженности стриктуры [13]. В нашем исследовании оценивались объем оперативного вмешательства в зависимости от протяженности и расположения стриктуры мочеточника, время операции и продолжительность послеоперационного периода в зависимости от объема оперативного вмешательства. Несомненно, операционное время напрямую зависит не только от опыта хирурга, но и от конкретной исходной клинической и интраоперационной ситуации. Так, в нашем исследовании продолжительность вмешательства варьировалась от 172 до 335 мин. В первом случае произведен лапароскопический уретероцистоанастомоз справа у молодого худого пациента после контактной уретеролитотрипсии в н/3. Самая длительная операция была выполнена пожилой даме, перенесшей комбинированное лечение по поводу рака шейки матки (экстирпация матки с последующей лучевой терапией) и аппендикулярную пластику правого мочеточника в связи с формированием постлучевой стриктуры. Поводом для тотальной правосторонней илеопластики послужила стриктура уретероаппендикоанастомоза. Средние сроки стационарного пребывания составили 15,5 дней. Как правило, за это время удавалось добиваться полной реабилитации и удалять все дренажи, исключив необходимость каких-либо манипуляций на амбулаторном этапе лечения иногородних больных.
Выводы. Оперативное лечение, направленное на восстановление адекватного пассажа мочи по мочевым путям до развития необратимых изменений в почечной ткани, позволяет сохранять функциональные возможности почки на стороне поврежденного мочеточника.
Пластика дефектов мочеточника неизмененными отделами мочевыводящих путей всегда остается приоритетной в реконструктивной урологии, так как имеет анатомофизиологическую направленность и позволяет восстанавливать пассаж мочи естественным путем.
При непротяженных стриктурах мочеточника (до 5 см) методом выбора является уретероуретероанастомоз, в отсутствие дистальной культи или протяженности более 5 см – уретероцистонеостомия. Однако при протяженной стриктуре мочеточника или постлучевых изменениях органов малого таза преимущество следует отдавать кишечной пластике.



