Введение. Известно, что для хронического бактериального простатита (ХБП) и хронического простатита/синдрома хронической тазовой боли (ХП/СХТБ) характерны сходные клинические проявления (так называемые простатитоподобные симптомы): тазовая боль, дискомфорт в надлонной области, частое и/или затрудненное болезненное мочеиспускание, чувство неполного опорожнения мочевого пузыря, болезненность простаты, ухудшение общего самочувствия, сексуальные расстройства и раздражительность, имеющие качественные различия проявлений в каждой конкретной категории заболевания [1, 2].
Согласно NIH-NIDDK Classification System (1995), основным лабораторным критерием дифференцировки данных патологических состояний является «инфекционный статус» секрета простаты (СП) при повышенном содержании лейкоцитов: идентификация возбудителей в случае ХБП и их «отсутствие» при ХП/СХТБ [3]. Тем не менее опубликовано немало работ, в которых делается акцент на том, что ХП/СХТБ IIIa, возможно, – это неверифицированный/недодиагностированный ХБП, так как применение современных диагностических методик (ПЦР, иммунотестов и технологий клеточных культур McCoy cells, 16s rRNA/DNA sequencing) для исследования биоматериала мужчин позволяет идентифицировать в нем различные таксоны микроорганизмов [4, 5].
Недодиагностика ХП/СХТБ IIIa подтверждается тем, что в разработанной и валидированной D. A. Shoskes et al. (2009) классификационной системе фенотипирования ХП/СХТБ, основанной на формировании ряда доменов – UPOINTS, выделен сайт I – infection, означающий идентификацию в СП грамотрицательных микроорганизмов (предположительно семейства Enterobacteriaceae) и/или представителей семейства Enterococcaceae, которые в свою очередь являются верифицированными возбудителями ХБП [6, 7]. Однако в данном домене не отражена облигатная принадлежность коагулазонегативных стафилококков (КОС), неклостридиальных анаэробных бактерий (НАБ), интрацеллюлярных микроорганизмов и других патогенов, которые потенциально могут выступать в качестве этиологических агентов развития ХБП или ХП/СХТБ IIIa. Так или иначе, разработчики данной классификационной системы все же апеллируют к потенциальности бактериального генеза воспалительного процесса в простате при ХП/СХТБ IIIa [8].
Принимая во внимание вышеизложенное, нами сформулирована исследовательская проблема: каковы сходства и различия в микробиологическом спектре СП у пациентов с ХБП и ХП/СХТБ IIIa при его экстенсивном анализе на расширенном наборе питательных сред? Проведенный поиск публикаций в базах данных PubMed/Medline, Web of Science, SCOPUS, ScienceDirect, eLIBRARY c использованием ключевых слов prostatic secretion assay, Meares-Stamey, 2 glass test, CP/CPPS, bacterial prostatitis, CBP, PCR показал немногочисленность валидных работ, содержащих информацию по данной проблеме.
Цель исследования: провести сравнительный анализ микробиоты СП у пациентов при ХБП и ХП/СХТБ IIIa.
Материалы и методы. Проведено полномасштабное проспективное сравнительное неконтролируемое исследование с 2010 по 2018 г. В исследование включен 101 мужчина в возрасте от 20 до 60 лет с простатитоподобными симптомами, беспокоящими их более 3 мес., которые обратились с данным жалобами в амбулаторном порядке в урологическое отделение Клиники РостГМУ. Биоматериал от пациентов получали путем проведения пробы Meares–Stamey, при этом СП собирали в стерильные емкости с транспортной средой AMIES Protagerm (BioMerieux, Marcy l’Etoile, Франция) и доставляли в лабораторию в течение 15 мин. Последующее хранение образцов биоматериала осуществляли в соответствии c основными положениями и требованиями преаналитического этапа лабораторных исследований [9]. Перед посевом на питательные среды производили 10-кратные разведения СП в среде Blaurock от 10-1 до 10-10 КОЕ/мл с последующей аппликацией на плотные питательные среды 0,1 мл бактериальной взвеси. По результатам микроскопии СП у всех пациентов определены воспалительные изменения.
На этапе I выполняли бактериологическое исследование СП на стандартной питательной среде (MacConkey Agar) в типичных условиях культивирования [10].
По результатам исследования CП сформировано две группы пациентов согласно основному группообразующему критерию, а именно идентификации в СП таксонов микроорганизмов семейства Enterobacteriaceae: E. coli, Proteus spp., Klebiella spp. – «по умолчанию» облигатных уропатогенов, вызывающих развитие ХБП. В 1-ю группу вошли 49 мужчин, у которых в СП определены вышеуказанные таксоны бактерий, во 2-ю – 52, не имевших энтеробактерий в биоматериале и/или с первично негативными результатами исследования СП.
Этап II заключался в бактериологическом исследовании образцов CП у всех (n=101) пациентов на расширенном наборе питательных сред в специальных условиях культивирования. В качестве селективных сред использованы плотные питательные среды для факультативно-анаэробных бактерий (ФАБ) – среда MacConkey, HiChrome Selective Agar для Enterococci spp., HiChrome Selective Agar для грибов, HiChrome Selective Agar для Klebsiellae spp., HiChrome Selective Agar для Staphylococci spp.; для НАБ – Bile Esculin Agar, Shadler Agar, Blaurock Broth, Shadler Broth [11]. Посевы инкубировали в аэробных (24–48 ч) и анаэробных (48–72 ч) условиях со специальным газовым составом (10% СО2, 10% Н2, 80% N2) в анаэростате АЭ-01 («НИКИ МЛТ-Поволжье», Россия) при 37°С. Биохимическую идентификацию бактерий осуществляли с помощью тест-систем EN-COCCUS test, STAPHYtestI6, NEFERMtest24, ENTEROScreen и т.д. («PLIVA-Lachema», Чехия).
Статистическую обработку результатов осуществляли с помощью прикладного пакета Statistica 10.2 («StatSoft Inc.», США). Описательная статистика количественных признаков (титра, частоты встречаемости) представлена в виде центральной тенденции медианы (Me) и интерквартильного размаха (25-й и 75-й процентили – LQ; UQ), а также среднего (M) и стандартного отклонения среднего (m). В тексте представлено как Ме [LQ; UQ] и M±m. Нормальность распределения показателей определяли с помощью теста Шапиро–Вилка, сравнение независимых переменных в группах проводили с помощью непараметрических статистических методов – U-тест Манна–Уитни (принятые уровни достоверности p<0,05 и p<0,01).
Результаты. Согласно данным бактериологического исследования с применением расширенного набора питательных сред в СП пациентов обеих групп идентифицировано 28 таксонов микроорганизмов (25 – в 1-й группе и 24 – во 2-й). При этом совокупно в 95% наблюдений в обеих группах идентифицированы поликомпонентные микробные ассоциации, состоящие из 2 и более микроорганизмов (см. рисунок).
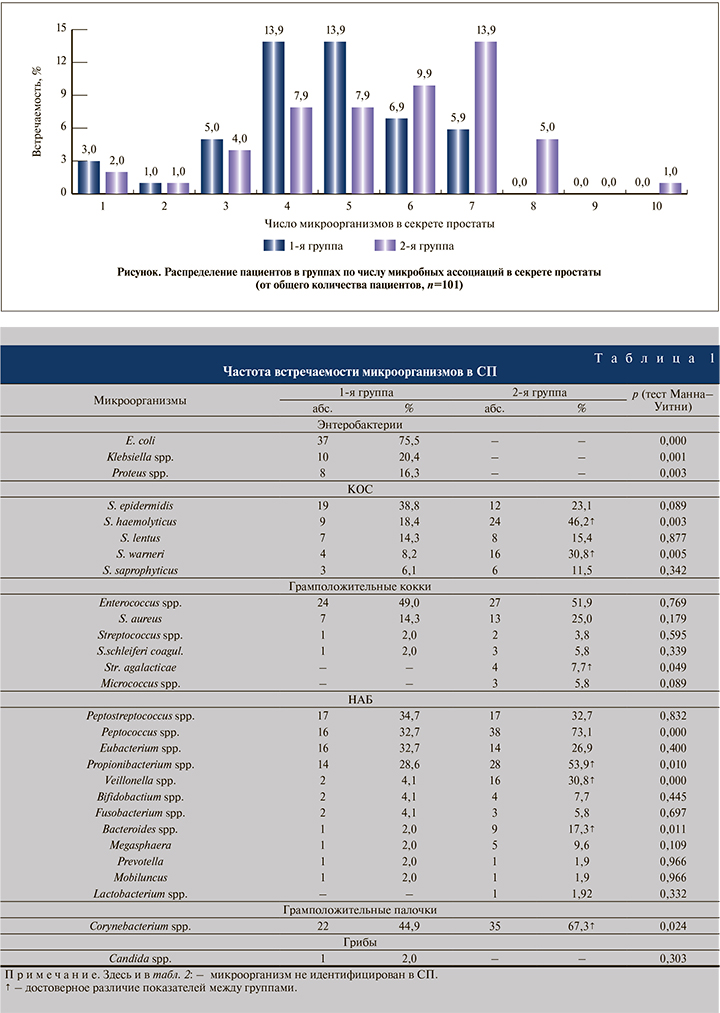
Анализ встречаемости микроорганизмов в СП (табл. 1) показал, что в 1-й группе чаще идентифицировали Enterococcus spp., Corynebacterium spp,, Peptostreptococcus spp., Peptococcus spр., Eubacterium spp., S. epidermidis, во 2-й – Corynebacterium spp., Enterococcus spp., Peptococcus spр., Propionibacterium spp., Peptostreptococcus spp., S. haemolyticus, S. warneri. В целом частота выявления в СП Corynebacterium spp., Enterococcus spp., Peptococcus spр. и Peptostreptococcus spp. в группах оказалась сопоставимой. Для определения значимости различий встречаемости микроорганизмов показатели обеих групп протестированы с применением теста Манна–Уитни.
Установлено, что в группе 2 значимо чаще, чем в группе 1, определены некоторые представители кластера НАБ: Peptococcus spр., Propionibacterium spp., Bacteroides spp., Veillonella spp.; и КОС: S.haemolyticus, S. warneri, а также грамположительные таксоны микроорганизмов: Corynebacterium spp. и Str. agalacticae. Примечательно, что в группе 1 достоверно чаще выявляли только микроорганизмы, выступавшие в качестве рандомизирующего фактора: E. coli, Klebsiella spp. и Proteus spp. По частотам встречаемости других микроорганизмов достоверных различий не выявлено.
Анализ обсемененности СП (табл. 2) показал, что в 1-й группе наибольший титр (КОЕ/мл) отмечен для E. coli (101–108), Proteus spp. (102–106), Klebsiella spp. (101–105), а также некоторых таксонов НАБ: Peptococcus spp. (101–104), Peptostreptococcus spp. (101–104), Propionibacterium spp. (101–105), а также КОС – S. haemolyticus, S. lentus (101–105), Еnterococcus spp. (101–105) и S. aureus (101–105). Во 2-й группе максимальные показатели титра в большинстве ограничены уровнем 103 КОЕ/мл. Только у 3 таксонов микроорганизмов титр обсемененности составил 104 КОЕ/мл: S. warneri, Enterococcus spp., Corynebacterium spp. Следует отметить, что в абсолютных значениях в 1-й группе в большинстве случаев чаще верифицировали микроорганизмы в титре 102 КОЕ/мл, во 2-й – в титре 101 КОЕ/мл. Таким образом, в 1-й группе по сравнению со 2-й для ряда микроорганизмов была характерна более высокая концентрация с более высоким разбросом значений.
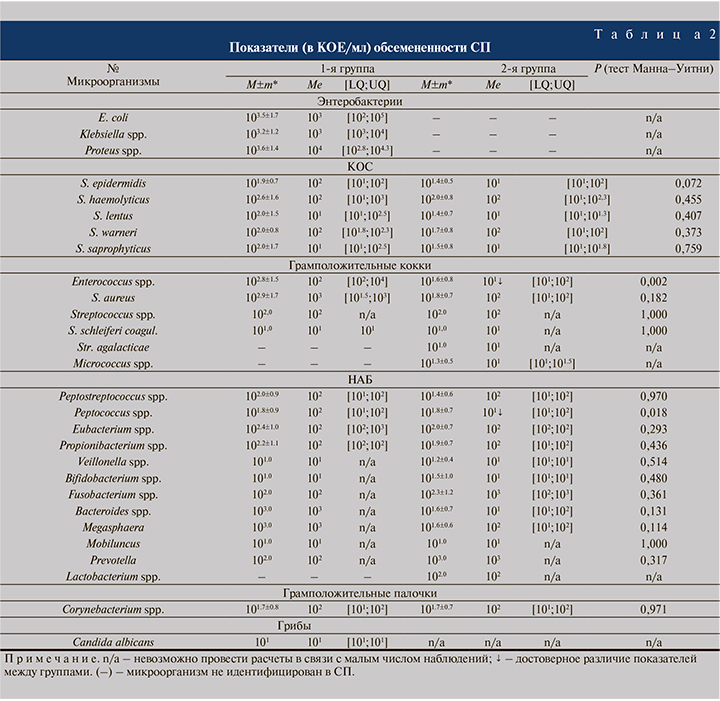
Согласно результатам непараметрического тестирования количественных показателей обсемененности СП различными бактериями, статистически значимые различия в титре микроорганизмов установлены только для Peptococcus spр. и Enterococcus spp. После сопоставления этих результаты со значениями частот их идентификации в СП определено, что показатели выявляемости вышеуказанных уропатогенов во 2-й группе выше, чем в 1-й (для Peptococcus spр. p<0,05), а средние титровые показатели данных бактерий, напротив, более значительные в 1-й группе (p<0,05).
Обсуждение. Этиопатогенез ХБП и ХП/СХТБ многогранен и являет собой сложную комбинацию как последовательно, так и параллельно протекающих процессов иммунного, сосудистого, нейроэндокринного и др. характера [12]. При этом бактериальная инвазия может выступать в качестве триггерного фактора и инициировать развитие патологических рекомбинаций в простате через каскад множества клеточных и гуморальных реакций [13].
В аннотации к системе фенотипирования UPOINT (2009) подчеркивается, что она первично разработана для определения терапевтической стратегии при ХП/СХТБ на основе идентификации определенных признаков, в том числе инфекционного фактора (домен I – infection). Авторы в данном сайте классификации валидировали идентификацию в СП только лишь грамотрицательной (энтеробактериальной) и энтерококковой флоры – облигатных возбудителей ХБП [6–8]. Между тем использование нами расширенного набора питательных сред и особых условий культивирования позволило идентифицировать в СП пациентов обеих групп широкий спектр поликомпонентных ассоциаций микроорганизмов, практически идентичный по своему таксономическому составу. В группе ХП/СХТБ IIIа в отсутствие резидентов семейства Enterobacteriaceae отмечено значительное увеличение удельного веса грамположительной флоры (Corynebacterium spp. и Enterococcus spp.), а также представителей НАБ (Peptococcus spр., Propionibacterium spp., Bacteroides spp., Veilonella spp.) и КОС (S. haemolyticus, S. warneri). Кроме этого во 2-й группе верифицированы, хотя и в довольно небольшом количестве, сапрофитные микроорганизмы, отсутствовавшие в СП пациентов 1-й группы, – Str. agalacticae и Мicrococcus spp., которые при снижении иммунного статуса могут вызывать тяжелые инфекционно-воспалительные изменения, а также представитель кишечной/влагалищной нормофлоры Lactobacterium spp. Отдельно следует выделить приблизительно двукратное увеличение встречаемости (однако недостоверное) во 2-й группе S. aureus – нормального комменсала кожи, обладающего широким набором мембранотоксинов, эксфолиатинов и др., способных индуцировать развитие при определенных условиях тяжелого деструктивного воспалительного процесса в органах и тканях [14].
На основании представленных данных можно предположить, что более разнообразный таксономический состав СП в группе ХП/СХТБ IIIа связан с отсутствием представителей семейства Enterobacteriaceae, в частности E. coli и K. pneumoniae, которые продуцируют достаточно мощные бактериоцины (колицины Е1, Е6, Е7, К и М и микоцины – E. coli, клебоцины – К. pneumoniae), подавляющие рост иной микрофлоры [15, 16]. С другой стороны, данные анализа концентраций бактерий показывают, что во 2-й группе по сравнению с 1-й средний титр микроорганизмов ниже и характеризуется меньшей количественной вариацией. К тому же в группе ХБП бактериальный пейзаж СП в большинстве случаев представлен 4- и 5-компонентными микробными ассоциациями, в то время как в группе ХП/СХТБ IIIа превалируют 6-, 7- и 8-таксонные бактериальные композиции, что, возможно, потребует учета при разработке терапевтической стратегии с более тщательным подбором антибактериальных препаратов для покрытия вариабельного микробного спектра.
Согласно клиническим рекомендациям EAU, таксоны микроорганизмов, идентифицированных в СП пациентов обеих групп, относятся к кластеру обсуждаемых штаммов [17]. B. Lobel et al. [18] в своем обзоре приводят иную классификационную систему разделения бактерий на пять классов по их принадлежности к формированию релевантного воспалительного процесса в простате. Таким образом, спектр выделенных из СП микроорганизмов может быть сепарирован на 3 категории (1-я и 5-я не представлены в исследовании): 2-я категория – вероятные патогены: грамположительные микроорганизмы – Enteroccoccus spp. и S. aureus; 3-я – возможные патогены: КОС, НАБ, грибы рода Candida; 4-я категория – признанные не патогенные для простаты таксоны микроорганизмов: Lactobacillus, Сorynebacterium spp. [18]. В работе J. Xiao et al. [19] посредством использования PCR и 16s rDNA PCR генного клонирования и секвенирования удалось выделить из СП 111 мужчин с симптоматикой ХП/СХТБ (IIIa и IIIb), с определенной частотой аналогично широкий спектр микроорганизмов, относящихся к 2–4-й категориям: U. urealyticum, C. trachomatis, HSV-2, HPV CMV, а также Staphylococcus, Pseudomonas, Achromobacter, Enterobacter, Prevotella и др. При этом исследователями с помощью точного теста Фишера определена достоверная прямая корреляция между уровнем повышения лейкоцитов и лектина в СП и количеством детектированных микроорганизмов [19].
Несмотря на разнообразие идентифицированного микробного спектра, очень мало достоверных данных о том, какие таксоны микроорганизмов способны вызывать простатит. Стоит подчеркнуть, что при экспериментальном моделировании простатита на кроликах New Zealand с использованием низких титров патогенов мы констатировали развитие воспалительного процесса в простате при инфицировании S. haemolyticus и E. coli (в качестве контроля) и несколько менее выраженного воспаления при инокуляции Peptococcus niger [20]. Результаты данного эксперимента демонстрируют вероятностную облигатную причастность некоторых таксонов микроорганизмов к развитию простатита, в частности Peptococcus niger, которые: 1) могут индуцировать и поддерживать развитие воспалительного процесса, но при обследовании не определяться на стандартном наборе питательных сред; 2) могут выступать триггером активации инфламмасом и инициации воспалительных изменений, которые будут протекать по «порочным кругам» даже после элиминации бактерий посредством иммунной клеточной реакции.
Заключение. Как показало настоящее исследование, отсутствие в СП по данным стандартного бактериологического исследования энтеробактерий или отрицательных результатов обнаружения микроорганизмов при наличии простатитоподобных симптомов и повышения лейкоцитов в СП не означает неинфекционной природы ХП/СХТБ IIIa.
Расширенное бактериологическое исследование простатического секрета позволяет во всех случаях идентифицировать в нем различные поликомпонентные микробные ассоциации, сходные по спектральному составу с таковым при ХБП с характерным увеличением частоты идентификации представителей НАБ, КОС и грамположительной флоры. Не вызывает сомнений тот факт, что простата не является стерильным органом и определение роли различных таксонов микроорганизмов в развитии релевантного воспалительного процесса, а также разделение облигатных уропатогенов и транзиторной резидентной флоры позволят пересмотреть репрезентируемые в различных исследованиях данные по распространенности ХП/СХТБ IIIa на уровне 40–65%, что в итоге изменит подходы к диагностике и терапии ХБП и ХП/СХТБ IIIа, которые мы рассматриваем как единое состояние, что в свою очередь требует пересмотра классификации NIH-NIDDK (1995).



