Введение. Первое упоминание о гибридной опухоли почки можно отнести к 2002 г., когда С. Pavlovich и соавт. впервые у пациентов с синдромом Birt-Hogg-Dubé описали структуру особой опухоли почки, представленной на светооптическом уровне участками классической онкоцитомы и хромофобного почечно-клеточного рака (ПКР) [1]. До настоящего времени из-за отсутствия единого мнения относительно гибридной опухоли в последней Международной гистологической классификации опухолей почек (ВОЗ, 2022) опухоль рассматривается в разделе «Другие онкоцитарные опухоли с морфологическими проявлениями онкоцитомы/хромофобного ПКР» [2–4].
Цель настоящего исследования: выявление иммуногистохимических, ультраструктурных особенностей и определение молекулярного профиля гибридных опухолей почки.
Материалы и методы. Объектом исследования послужил архивный биологический и текущий биопсийный материал от 12 больных (7 мужчин и 5 женщин) в возрасте от 54 года до 76 лет, проходивших хирургическое лечение по поводу гибридной опухоли почки в Урологической клинике ФГАОУ ВО «Первый Московский государственный медицинский университет им. И. М. Сеченова» Минздрава России (Сеченовский Университет).
Гистологическое исследование. Биоптаты фиксировали в 10%-ном растворе нейтрального формалина. После стандартной гистологической проводки кусочки заливали в парафин. Срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Иммуногистохимическое (ИГХ) исследование. Серийные срезы толщиной 5 мкм депарафинировали и регидратировали по стандартной методике. Для «демаскировки» антигенов срезы подвергали высокотемпературной обработке в цитратном буфере и инкубировали 5 мин с 3 %-ным Н2О2 (для каждого антитела в соответствии с рекомендуемым протоколом). Использовали мышиные моноклональные антитела к СК7 (готовый к использованию), к CD117 (готовый к использованию), к Cyclin D1 (в разведении 1:50), к EpCAM (в разведении 1:200) производства «Novocastra» (Великобритания), к Caveolin1 (в разведении 1:200), к EABA (в разведении 1:200) производства «Abcam» (США) и к S100А1 (в разведении 1:100) производства «Cell Marque» (США). В качестве вторичных антител использовали систему EnVision («DAKO Cytomation», Дания).
Электронно-микроскопическое исследование (ЭМИ). Кусочки ткани опухолей почки фиксировали в 2,5%-ном глутаральдегиде на 0,1 М фосфатном буфере (рН=7,4), затем постфиксировали в 1%-ном растворе четырехокиси осмия (OsO4). Дегидратацию материала и заливку образцов ткани проводили в ЭПОН-812 по общепринятой методике. Полутонкие срезы толщиной 1–2 мкм готовили на ультрамикротоме LKB-3 (Швеция), окрашивали толуидиновым синим, контрастировали ацетатом уранила и цитратом свинца, а затем исследовали в электронном микроскопе Philips TECNAI 12 BioTwinD-265 (Нидерланды).
Флюоресцентная гибридизация in situ (FISH). Для проведения реакций флюоресцентной in situ гибридизации (FISH-реакции) использовали центромерные пробы СЕР1–2, CEP4, CEP9, CEP11, CЕР17, CEP18, CEP20, конъюгированные с оранжевой флюоресцентной меткой, и центромерные пробы CEP6–8, CEP10, CEP12, CEP15–16, конъюгированные с зеленой флюоресцентной меткой; локусспецифические пробы LSI 13/21 и LSI N25 /LSI ARSA; теломерная проба TelVysion к хромосоме 14q фирмы «Abbott Vysis» (США). Для оценки сигналов вычисляли в процентах количество сигналов каждой пробы на 100–150 клеток в нормальной почечной паренхиме и опухолевой ткани каждого образца при 1000-кратном увеличении, после чего вычисляли в процентах среднее значение и среднеквадратическое отклонение (δ) каждого типа сигнала в нормальной почечной паренхиме. Пороговое значение каждого типа сигнала соответствовало сумме среднего значения и трехкратного среднеквадратического отклонения по P. Cossu-Rocca и соавт. [5].
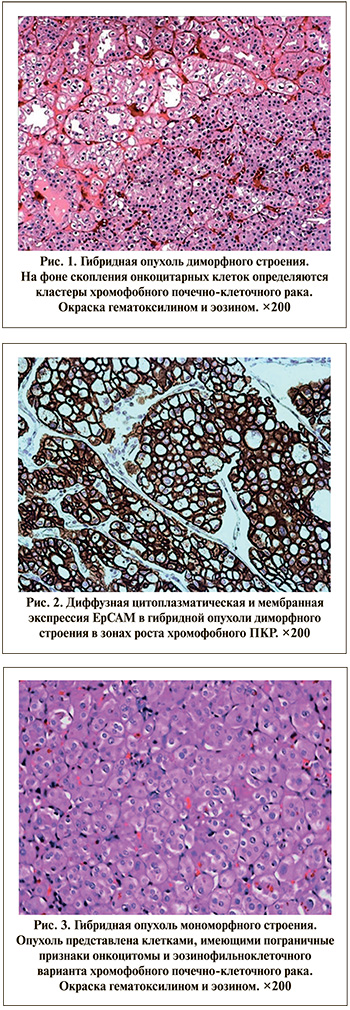
Результаты. В 10 случаях опухоль микроскопически была представлена диморфной структурой и характеризовалась гнездовидными или солидными структурами онкоцитомы, на фоне которой определялись зоны роста эозинофильноклеточного варианта хромофобного ПКР (рис. 1). При ИГХ-исследовании в зонах онкоцитомы обнаружена положительная реакция к EABA, Cyclin D1 и S100A1, а в ареалах роста хромофобного ПКР – EpCAM, СК7 и Caveolin-1 (рис. 2). В 6 наблюдениях в обоих участках выявлена положительная экспрессия CD117.
В двух образцах опухолевая ткань была представлена мономорфной структурой и состояла из относительно мелких оксифильных клеток промежуточного типа, напоминающих одновременно онкоциты и клетки хромофобного ПКР (рис. 3). Проведя анализ литературы, мы нашли единичные сообщения о гибридной опухоли почки, представленной исключительно онкоцитарными клетками промежуточного типа [6]. При иммунофенотипировании в обоих образцах в условиях положительной экспрессии СК7 была идентифицирована отрицательная реакция на CD117 (рис. 4).

При ЭМИ во всех 10 новообразованиях диморфного строения были обнаружены ареалы с ультраструктурными признаками онкоцитомы. В этих случаях в отдельных участках опухолевые клетки характеризовались наличием в цитоплазме большого количества однородных округлых митохондрий с ламеллярными криптами, из них в некоторых образцах выявлялось умеренное количество рибосом и/или хорошо развитый аппарат Гольджи (рис. 5).
В зонах роста хромофобного рака в опухолевых клетках в парануклеарной области отмечалось наиболее интенсивное скопление оптически пустых микровезикул. В отличие от онкоцитов эти клетки характеризовались обилием митохондрий с тубуловезикулярными криптами (рис. 6).
Обе опухоли мономорфного строения на ультраструктурном уровне демонстрировали наличие большого количества митохондрий одного размера и формы, внутрицитоплазматических полостей, выстланных микроворсинками, а также признаки поляризации микровезикул преимущественно к апикальной поверхности.
При FISH-исследовании во всех случаях были зарегистрированы сочетанные хромосомные аберрации. Из них в 5 образцах обнаружена трисомия по хромосоме 20, в 3 опухолях – по хромосомам 10 и 17, в 2 новообразованиях – по хромосоме 2. В 4 опухолях выявлена моносомия по хромосомам 1 и 17, в 2 образцах – по хромосомам 6, 9, 10 и 13, по 1 случаю – по хромосомам 2 и 20. В 3 наблюдениях трисомия по хромосоме 20 сочеталась с моносомией по хромосомам 1, 2, 9 и 17, а в 2 наблюдениях – по хромосоме 6. В 2 опухолях трисомия по хромосоме 17 сочеталась с моносомией по хромосомам 6, 10 и 20, в 1 случае – по хромосоме 6. В 2 новообразованиях полисомия по хромосоме 10 сочеталась с моносомией по хромосомам 1, 13 и 17, в 1 образце трисомия по хромосоме 2 сочеталась с моносомией по хромосомам 6, 10 и 20, еще в 1 – с моносомией по хромосоме 1. Выявлено по 1 случаю синхронной трисомии по хромосомам 2, 17 и 17, 20 соответственно.
Обсуждение. Полученные результаты свидетельствуют о том, что иммуно-, ультрафенотип и молекулярный профиль гибридных опухолей имеют ряд особенностей. Установлено, что для этих опухолей с диморфным клеточным составом характерна коэкспрессия маркерных антигенов онкоцитомы и хромофобного ПКР. Вместе с тем в гибридной опухоли мономорфного типа в отличие от диморфного варианта на фоне выраженной положительной экспрессии СК7 наблюдается отрицательная реакция на CD117. Наше ИГХ-исследование согласуется с результатами других исследователей [7–8]. Ультраструктурное исследование показало, что по электронно-микроскопическим характеристикам гибридные опухоли являются гетерогенными опухолями. В то же время на молекулярном уровне эти опухоли демонстрируют схожие с хромофобным ПКР хромосомные аберрации. Нашу точку зрения подтверждают данные, полученные F.Petersson и соавт. [9]. Результаты комплексного исследования указывают на то, что гибридные опухоли являются промежуточным звеном в процессе злокачественной трансформации онкоцитомы в хромофобный ПКР. Наши предположения о злокачественной трансформации онкоцитом почек согласуются с результатами S. Joshi и соавт. [10], выделивших среди онкоцитом почек анеуплоидные образцы с потерей хромосом 1, 14, 21, Х или Y, трансформировавшиеся в свою очередь в хромофобный ПКР. Пограничный потенциал как важное биологическое свойство является отличительной особенностью гибридной опухоли и характеризует ее в качестве отдельной нозологической единицы с четкими воспроизводимыми диагностическими критериями.
Заключение. Таким образом, иммуноморфологические и ультраструктурные особенности, а также молекулярный профиль гибридной опухоли почки определяют необходимость дифференциальной диагностики гибридной опухоли от онкоцитомы и хромофобного ПКР. Из-за редкой встречаемости и неопределенного злокачественного потенциала гибридной опухоли ее верификация представляет собой важную клиническую задачу с целью прогноза прогрессирования заболевания в послеоперационном периоде, что в свою очередь в дальнейшем позволит выработать оптимальную тактику и алгоритма лечения пациентов.



