Введение. Рак предстательной железы (РПЖ) – второе по частоте выявления онкологическое заболевание у мужчин в мире. В 2012 г. РПЖ диагностирован у 1,1 млн человек, что составляет 15% от всех случаев рака [1]. Частота аутопсийно выявленного РПЖ примерно одинакова повсеместно [2].
Согласно А. Д. Каприну и соавт. [3], доля РПЖ в России составляет 14,3% среди всех онкозаболеваний у мужской части населения, что выводит данную нозологию на второе место после бронхогенной карциномы. В возрастной же категории старше 60 лет РПЖ занимает первое место по встречаемости и составляет 18,5% от всех случаев онкозаболеваний.
Выявляемость рака при стандартной трансректальной биопсии простаты составляет от 30 до 50%. В связи с этим происходит прогрессирующее увеличение повторных биопсий при сохраняющемся подозрении на рак простаты [4].
На сегодняшний день биопсия, выполняемая под УЗ-контролем, является «золотым» стандартом рака предстательной железы. В большинстве случаев биопсия проводится трансректально, реже – трансперинеально. Выявляемость РПЖ при использовании обеих техник сопоставима [5, 6]. Частота выявления РПЖ при первичной трансректальной биопсии под УЗ-контролем варьируется от 30 до 50% [7].
По данным рекомендаций Европейского общества урологов (2017), показанием к повторной биопсии простаты служат повышение уровня ПСА; наличие подозрительных признаков при ПРИ (риск наличия рака – 5–30%); наличие атипичной мелкоацинарной пролиферации (риск наличия рака – 40%); наличие ПИН высокой степени (риск наличия рака – 30%); наличие атипичных желез, непосредственно прилегающих к ПИН (риск наличия рака – 50%); внутрипротоковая карцинома как солидная находка (риск наличия рака – 90%); наличие подозрительного участка на мультипараметрической магнитно-резонансной томографии (мпМРТ).
Отмечается прогрессирующее увеличение количества повторных (вторичных, третичных) биопсий простаты, которые не выявляют злокачественного процесса. На сегодняшний день Европейское общество урологов не дает рекомендаций по ведению таких пациентов.
Частота РПЖ, диагностируемого при сатурационной повторной биопсии (>20 точек), составляет 30–43% и зависит от количества пункций предыдущих биопсий [8]. Сатурационная повторная биопсия может выполняться трансперинеальным доступом, что позволяет обнаруживать рак в 38% случаев, однако существует риск (10%) развития осложнения в виде задержки мочи [9].
С целью улучшения качества диагностики РПЖ, избавления пациентов от повторных биопсий, уменьшения количества пункций при биопсии разработана и успешно введена в клиническую практику новая методика высокоточной диагностики рака – биопсия предстательной железы под контролем fusion-навигации (от англ. fusion – слияние) [10–12]. Данная запатентованная технология основана на совмещении двух модальностей, мультипланарной магнитно-резонансной томографии (мпМРТ) и УЗИ, что позволяет в режиме реального времени выполнять прицельную биопсию предстательной железы из подозрительных участков. Кроме того, методика позволяет не просто констатировать наличие или отсутствие злокачественного процесса, но и дает возможность оценить локализацию и распространенность процесса в простате, что в свою очередь расширяет возможности дальнейшего использования фокальной малоинвазивной терапии РПЖ и позволяет избегать необоснованных радикальных простатэктомий [13].
Предбиопсийная МРТ при таргетной биопсии
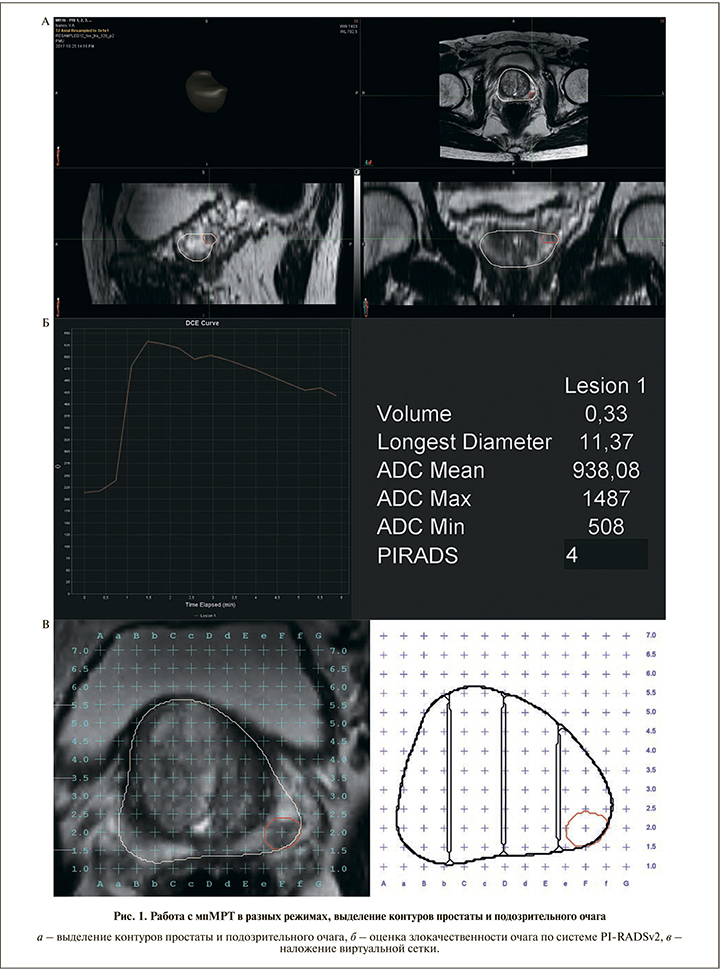
Для интерпретации подозрительного на рак участка используется система унифицированного подхода PI-RADSv2 [14]. Данная система подразумевает, что МРТ-исследование должно включать Т2-взвешенные (Т2-ВИ), диффузно-взвешенные (ДВИ) изображения и серии динамического контрастного усиления. Диффузно-взвешенные изображения следует получать с использованием высокого b-показателя в диапазоне от 1400 до 2000 с/мм2 и с реконструкцией карт измеряемых коэффициентов диффузии. PI-RADSv2 характеризует каждый выявленный подозрительный на клинически значимый рак очаг по шкале от 1 до 5 баллов в соответствии с изменениями в каждом сегменте железы, согласно доминирующей импульсной последовательности и другим импульсным последовательностям в порядке убывания их значимости для интерпретации выявленных изменений. МРТ простаты обладает высокой диагностической ценностью в выявлении клинически значимого рака и помогает не только определить локализацию очага, но и стратифицировать риск. Недавно проведенный мета-анализ, посвященный оценке эффективности МРТ при выявлении РПЖ, показал, что специфичность метода составляет 88%, чувствительность – 74% с отрицательной прогностической ценностью от 65 до 94% [15]. E. Martorana et al. [16] продемонстрировали высокую связь оценки по шкале PI-RADSv2 с гистологической злокачественностью опухоли по Глисону.
Предыдущие отрицательные биопсии: обнаружение пропущенного рака
N. E. Abraham et al. [17], обследовав 1213 пациентов с повторными отрицательными биопсиями, показали, что при каждой последующей биопсии может быть выявлен клинически значимый рак. МРТ/УЗИ-fusion-биопсия может идентифицировать лиц с клинически значимым раком и предотвращать проведение повторных биопсий с учетом сохраняющейся вероятности обнаружения рака даже при пятой повторной систематической биопсии. Чтобы определить целесообразность биопсии под конт-ролем fusion-навигации для пациентов с предыдущей одной или более отрицательными биопсиями, N. Mendhiratta et al. [18] оценили 210 случаев, в которых были выполнены предбиопсийная МРТ, fusion-биопсия и стандартная биопсия простаты. Критериям включения соответствовал 161 пациент, у 47 (29%) из которых был РПЖ. МРТ/УЗИ-fusion-биопсия и систематическая биопсия имели схожие показатели выявляемости: 21,7 и 18,6% соответственно (p=0,36), а частота выявления рака по шкале Глисона ≥7 – 14,9 и 9,3% (p=0,02) соответственно. Из 26 мужчин с критерием Глисона ≥7 fusion-биопсия выявила онкологический процесс у 24 (92,3%), тогда как стандартная УЗ-биопсия – лишь у 15 (57,7%; p<0,01). Среди пациентов с мпМРТ критерием подозрительности (mSS) <4 у 72% выявлен рак низкого риска по критерию UCSF-CAPRA. Авторы пришли к выводу, согласно которому у мужчин с предшествовавшими отрицательными биопсиями и постоянным подозрением на РПЖ стандартная систематическая биопсия обладает меньшей чувствительностью в выявлении рака по шкале Глисона ≥7, чем fusion-биопсия, в связи с чем приоритет стоит отдавать последней [18]. Отмечается, что для трактовки результатов мпМРТ необходимо использование системы PI-RADSv2 радиологами, имеющими опыт описания такого рода исследований простаты, и непосредственно урологами, имеющими опыт МРТ-направленных биопсий [19].
 Отсутствие первичной биопсии: поиск клинически значимого заболевания, уменьшение гипердиагностики
Отсутствие первичной биопсии: поиск клинически значимого заболевания, уменьшение гипердиагностики
Предбиопсийная мпМРТ обеспечивает повышение выявляемости рака высокого риска у мужчин, которым выполняется первичная биопсия предстательной железы, и в то же время снижает выявляемость клинически незначимых форм рака, что в конечном итоге снижает гипердиагностику. N. Mendhiratta et al. [20] провели исследование с участием 452 мужчин, которым была проведена предбиопсийная МРТ, после которой выполнена fusion-биопсия и стандартная биопсия простаты. Частота выявления рака при систематической биопсии составила 49,2%, при fusion-биопсии – 43,5% (p=0,006). Однако таргетная биопсия показала бόльшую злокачественность по шкале Глисона (≥7), чем систематическая биопсия (88,6 против 77,3%; p=0,037). Из 41 выявленного случая рака при систематической биопсии в 34 (82,9%) выявлена аденокарцинома 6 баллов по критерию Глисона, у 26 (63,4%) и 34 (82,9%) обнаружен клинически незначимый рак по критерию Эпштейна и шкале UCSF CAPRA ≤2 баллов соответственно. Авторы пришли к заключению, согласно которому у пациентов, которым в качестве первичной проводится fusion-биопсия, выявляется рак более высокой градации, чем при стандартной биопсии. В большинстве случаев при систематической биопсии в отличие от fusion-биопсии определяется рак низкого риска. Использование предбиопсийной МРТ с последующей fusion-биопсией снижает выявляемость рака низкого риска, в то же время значительно улучшает диагностику и стратификацию риска высокой градации [20].
Использование при активном наблюдении: локализация преобладающего очага, точная классификация заболевания
мпМРТ может использоваться как средство мониторинга мужчин с РПЖ низкого риска при активном наблюдении. Хотя мпМРТ вряд ли может значительно улучшить онкологические результаты активного наблюдения, но она может служить инструментом улучшения стратификации базового риска, что в дальнейшем позволяет лучше ориентироваться в тактике активного наблюдения, уменьшая количество повторных биопсий. На сегодняшний день есть несколько исследований, описывающих применение мпМРТ и fusion-биопсии в отношении пациентов с верифицированным РПЖ. мпМРТ повышает выявляемость скрытого рака высокой злокачественности. Стандартные биопсии однозначно идентифицировали значительное число больных со скрытым раком высокой градации, не выявленных при fusion-биопсии, ввиду чего было предложено совместное использование систематической биопсии и fusion-биопсии для получения максимально исчерпывающей информации. Это скорее всего отражает высокую распространенность небольших объемов паттерна 4 по Глисону в исследованной популяции. МРТ-градация по шкале PI-RADSv2 статистически достоверно коррелирует с гистологической шкалой по Глисону [21, 22]. С учетом вышесказанного роль МРТ при активном наблюдении еще предстоит определить. Крайне важно установить ее вклад в базовую оценку риска и мониторинг, чтобы оправдать существенные издержки.
В настоящей статье представлен опыт выполнения мпМРТ/УЗИ fusion-биопсий в клинике урологии им. Р. М. Фронштейна на базе Первого МГМУ им. И. М. Сеченова.
Материалы и методы. С сентября 2017 по январь 2018 г. в клинике урологии им. Р. М. Фронштейна на базе Первого МГМУ им. И. М. Сеченова 55 пациентам со стойко повышенным уровнем общего ПСА в сыворотке крови и с наличием подозрительного участка по результатам мпМРТ была проведена биопсия предстательной железы под контролем fusion-навигации промежностным доступом. У 21 пациента ранее была выполнена стандартная трансректальная биопсия под УЗ-контролем, по результатам которой ни у кого из них не был верифицирован РПЖ. У 2 пациентов был верифицирован РПЖ (3+3) 6 баллов по Глисону в одном столбике с поражением до 10% от его площади. Другим 32 пациентам биопсия простаты ранее не проводилась. Возраст пациентов варьировался от 53 до 74 лет (Ме – 65 лет, σ=4,98). Уровень ПСА составлял от 3,5 до 51,1 нг/мл (М – 10,01 нг/мл, m=1,29). Объем предстательной железы варьировался в широких пределах: от 25 до 207 см3 (Ме – 54 см3, σ=41,09), у 36 (66%) пациентов уровень ПСА соответствовал значениям «серой зоны» (от 4 до 10 нг/мл). В 12 (22%) случаях биопсия проводилась под эндотрахеальным наркозом (в 7 случаях – на этапе освоения методики, в 5 – по желанию пациента); в 43 (78%) – под спинномозговой анестезией. В среднем на проведение биопсии уходило 35 мин (25–70 мин), срок госпитализации составлял от 2 до 5 дней (медиана – 2,3).
Техника выполнения промежностной биопсии простаты под контролем fusion-навигации
На первом этапе пациентам проводили мпМРТ в режимах Т2-ВИ, ДВИ с картами ИКД (измеряемого коэффициента диффузии) и в режиме с динамическим контрастным усилением препаратами гадолиния. Согласно рекомендациям разработчиков программного обеспечения MimSoftware от 2016 г., для корректного анализа импульсных последовательностей МРТ-изображений рабочей станцией необходимо соблюдать следующие параметры сканирования: шаг среза при Т2-ВИ – 2,5 мм (аксиальные, сагиттальные и продольные проекции) или импульсная последовательность Т2-ВИ с толщиной среза 1 мм и изотропными вокселями. Для исследования может быть использован МРТ-аппарат с величиной индукции магнитного поля 1,5 Тл и значением b ≥800 с/мм2 или 3 Тл и b ≥2000 с/м [23]. Далее врач-радиолог выполнял процедуру обработки мпМРТ-изображения, выделение контуров предстательной железы и подозрительных участков, ранжирование злокачественности подозрительного участка по системе Pi-RADSv2 с учетом данных Т2-ВИ, изотропных ДВИ+карт ИКД, данных динамического контрастного усиления в соответствии с доминирующей последовательностью в зависимости от сегмента локализации участка в предстательной железе (рис. 1, 2).

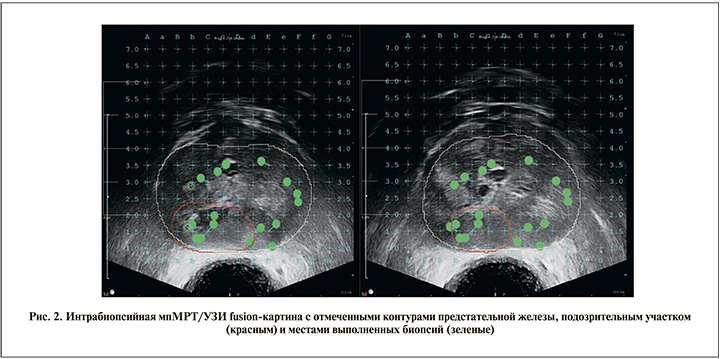
Третьим этапом выполняли собственно промежностную биопсию простаты под контролем мпМРТ/УЗИ fusion-навигации (рис. 3). Для совмещения модальностей мпМРТ и УЗИ использовали УЗ-аппарат Flexfocus 800 BK medical; персональный компьютер с высокой производительностью; программное обеспечение MimSoftware, а также видеограббер DVI2USB 3.0, epiphanvideo (рис. 4), позволяющий импортировать данные с УЗ-аппарата в персональный компьютер для дальнейшего совмещения с мпМРТ-изображением и работы с ними.
После совмещения УЗ и мпМРТ-изображений в первую очередь выполняли биопсию из подозрительного участка (от 2 до 13 вколов в зависимости от количества и размера очага; рис. 3). Далее последовательно осуществляли забор биоптатов из других не стратифицированных как максимально подозрительный очаг на fusion-карте областей простаты (13–45 вколов). Каждый биоптат помещали в отдельный флакон с формалином, плотно закрывали и маркировали номером в строгом соответствии с fusion-картой (рис. 4).
После завершения биопсии формируется отчет в формате PDF, в котором указаны все данные, касающиеся подготовки, проведения манипуляции, а также бланк для гистологического заключения.
Для статистической обработки полученных данных использовались коэффициент корреляции Спирмена (оценка связи мпМРТ градации по системе PI-RADSv2 с гистологической шкалой Глисона) и регрессионный анализ (при сравнении относительного распределения пациентов в соответствии с суммой баллов по шкале Глисона при выполнении мпМРТ/УЗИ fusion-биопсии и трансректальной биопсии простаты под УЗ-контролем).
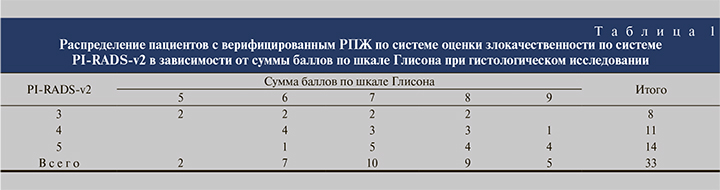
Результаты. Если по критерию злокачественности PI-RADSv2 пациент имел <3 баллов, то гистологических данных за онкологический процесс в простате не оказывалось (как по результатам fusion-биопсии, так и после лазерной энуклеации гиперплазии простаты). Исходя из этого, из окончательного анализа были исключены 20 пациентов с оценкой 2 балла по шкале PI-RADSv2. По результатам fusion-биопсии данных за рак у них получено не было. Таким образом, для статистической обработки отобраны 33 пациента (от 3 до 5 баллов по шкале PI-RADSv2) с диагностированным РПЖ, у 24 (74%) из которых был выявлен клинически значимый рак (≥7 баллов по Глисону), у 9 (26%) – рак с оценкой <7 баллов по Глисону (табл. 1).
Связь мпМРТ градации злокачественности по системе PI-RADSv2 имеет статистически достоверную корреляцию с гистологической шкалой Глисона. Коэффициент корреляции Спирмена (ρ) равен 0,466. Связь между исследуемыми признаками – прямая, теснота (сила) связи по шкале Чеддока – умеренная. Число степеней свободы (f) составляет 17. Критическое значение критерия Спирмена при данном числе степеней свободы составляет 0,46. ρнабл >ρкрит, зависимость признаков статистически значима (p<0,05). То есть связь мпМРТ–градация злокачественности по системе PI-RADSv2 имеет статистически достоверную корреляцию с гистологической шкалой Глисона.
При выполнении всех fusion-биопсий в биоптатах из подозрительного участка всегда определялся материал с наибольшим потенциалом злокачественности, нежели чем в биоптатах, взятых у тех же пациентов при систематической биопсии из других участков.
Как видно из табл. 2, мпМРТ/УЗИ-fusion-биопсия по сравнению со стандартной систематической трансректальной биопсией позволяет повышать выявляемость клинически значимого РПЖ (>6 баллов по Глисону) и снижать клинически незначимого (≤6 баллов по Глисону).
Заключение. Актуальность широкого внедрения в клиническую практику представленной технологии с целью выполнения прецизионной таргетной биопсии предстательной железы из подозрительных участков очевидна. Проведение биопсии простаты под контролем fusion-навигации улучшает качество гистологического материала, избавляет пациента от лишних биопсий, уменьшает количество пункций при биопсии, тем самым выводит диагностику РПЖ на более высокий уровень. МпМРТ/УЗИ-таргетная биопсия обладает высокой чувствительностью в выявлении клинически значимого рака и низкой – клинически незначимого. Кроме того, методика позволяет определять локализацию и распространенность патологических изменений в простате, что расширяет возможности применения фокальной терапии РПЖ.



