Введение. Тестостерон (Тс) и его активный метаболит дигидротестостерон играют важную роль в организме мужчины. Так, Тс обладает не только андрогенным, но и анаболическим действием, регулирует репродуктивную функцию мужчин посредством индукции сперматогенеза и обеспечения полового влечения, а также предопределяет физиологическое обеспечение психической деятельности. Основное биологическое действие Тс проявляется в тканях-мишенях, которыми являются клетки семенных канальцев, семенные пузырьки, придатки яичек, предстательная железа, половой член. Клинически андрогенные свойства Тс манифестируются развитием половых органов, появлением вторичных половых признаков, формированием полового влечения и сексуального поведения. Врожденный низкий уровень андрогенов в организме нарушает формирование половых признаков, приводя к дефектам развития мужской репродуктивной и эндокринной систем [1, 2]. Анаболические свойства Тс обусловливают его участие в регулировании обмена кальция, азота, фосфора, углеводов и белков, что предопределяет развитие и увеличение мышечной массы, синтез костной ткани [3–5]. С возрастом у мужчин отмечается снижение уровня Тс в сыворотке крови на 0,4–2,0% начиная с 30-летнего возраста [6, 7]. У мужчин среднего возраста без сопутствующих заболеваний распространенность гипогонадизма составляет 6%, но вырастает при ожирении и некомпенсированном сахарном диабете до 50% и выше [8].
Мужчинам с клиническими симптомами гипогонадизма и низким уровнем Тс в сыворотке крови с целью коррекции его дефицита тестостерона современные клинические руководства рекомендуют заместительную гормональную терапию препаратами тестостерона (ЗГТПТ) [9–12]. При этом цель лечения – облегчить симптомы гипогонадизма путем восстановления сывороточных уровней Тс до нормальных физиологических значений. Выбор препарата для лечения определяется формой заболевания, факторами риска и репродуктивными планами пациента. Необходимо помнить о возможном транзиторном снижении уровня Тс, например, на фоне острых или декомпенсации хронических заболеваний, которое должно быть исключено при тщательном клиническом обследовании и повторном измерении уровня гормонов [13].
Вместе с тем в последние годы имеет место активное использование препаратов тестостерона (ПТ) атлетами в немедицинских целях [14]. В связи с тем что применение ПТ в немедицинских целях идет в разрез с законодательствами многих государств, распространенность этого явления остается невыясненной. Более того, лица, применяющие ПТ и обратившиеся за медицинской помощью, в 50% случаев скрывают от врачей факт использования стероидов [15, 16].
В связи с тем что применение ПТ стало необоснованно и агрессивно использоваться в немедицинских целях, врачам приходится сталкиваться с нежелательными эффектами со стороны многих органов и систем мужчин. Неверно называть такой подход к использованию экзогенного тестостерона терапией, поскольку целью в данном случае является не лечение чего-либо, а намеренное увеличение уровня Тс в организме при его исходном формально-нормативном значении [17, 18]. При этом в условиях длительного приема ПТ у исходно эугонадных мужчин развиваются различные варианты гипогонадизма.
В связи с этим своевременная качественная диагностика и эффективное лечение индуцированного гипогонадизма представляются недоизученной проблемой здравоохранения. Клинических рекомендаций и стандартов по диагностике и лечению вторичного гипогонадизма после использования ПТ непрофессиональными спортсменами не существует [17–19]. Представленная проблема носит междисциплинарный характер и требует детального изучения.
Цель: изучить структуру нежелательных явлений (НЯ) со стороны мочевыводящих путей и половых органов мужчин, посещавших тренажерные залы, применявших препараты тестостерона и анаболические стероиды в немедицинских целях.
Материалы и методы. Проведен клинико-статистический анализ 64 мужчин в возрасте 22–46 лет, посещавших тренажерные залы и получавших ПТ и анаболические стероиды (АС) в немедицинских целях, обратившихся в последующем к урологу, андрологу, эндокринологу с различными жалобами со стороны мочевыводящих путей и половых органов на фоне приема или после отмены ПТ или АС. До начала приема ПТ и АС у всех мужчин в анамнезе отсутствовали заболевания и симптомы со стороны мочевыводящих путей и репродуктивных органов. Исходно уровень гормонального статуса (Тс, ФСГ, ЛГ, пролактин, эстрадиол) соответствовал нормативным значениям. Концентрация общего Тс в сыворотке крови у всех обследованных была выше 12,1 номоль/л. Прием ПТ был инициирован без медицинских показаний самостоятельно мужчинами или сотрудниками спортивных центров. Длительность приема ПТ и АС у всех пациентов составила более 1 года.
При обследовании пациентов применялись валидированные шкалы опросники: International Prostatic Symptom Score (IPSS) и International Index of Erectile Function (IIEF5) и лабораторно-инструментальные методы исследования: микроскопическое исследование эякулята, исследования общего Тс, ФСГ, ЛГ, пролактина, эстрадиола в сывротке крове и ультразвуковое исследование с допплеркартированием сосудов полового члена. Результаты исследования были обработаны с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office, 2007. Статистическую обработку данных проводили с использованием статистического пакета STATISTICA, 6.1 (StatSoftInc., США). Проведение расчетов и интерпретацию результатов осуществляли согласно руководству О. Ю. Ребровой. Оценку соответствия распределения признаков Закону нормального распределения проводили с применением критерия Шапиро–Уилка. Пороговый уровень значимости установлен на уровне p<0,05.
Исследование одобрено Локальным независимым этическим комитетом ФГБОУ ВО РостГМУ МЗ РФ о№ 20/21т 23.12.2021.
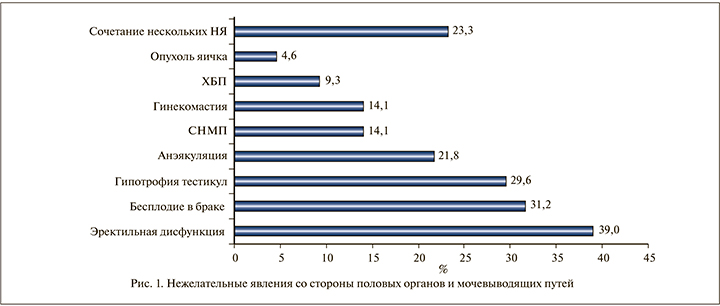
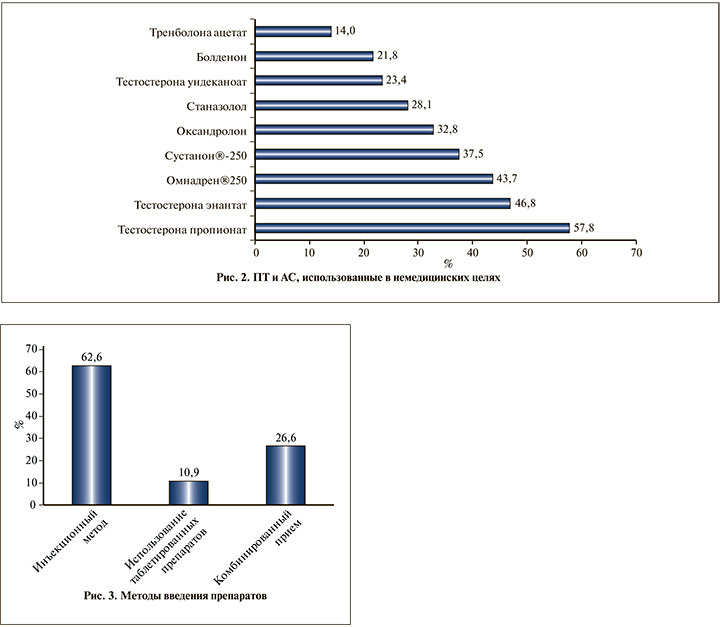
Результаты и обсуждение. В структуре нежелательных явлений у обследованных доминировали эректильная дисфункция – 25 (39,0%), бесплодие в браке – 20 (31,2%), гипотрофия тестикул – 19 (29,6%) (p<0,05) (рис. 1). Обследуемые чаще использовали следующие препараты:
Тестостерона пропионат, Тестостерона энантат, Омнадрен® 250 (рис. 2). В 65,6% случаев препараты комбинировались, использование трех препаратов и более отмечено у 60% пациентов. Доминировал инъекционный метод введения гормонов (p<0,05) (рис. 3).
Применение ПТ или АС большинством (59,3%) мужчин отмечено в течение 1–3 лет, 43,7% пациентов– более 3 лет,%) (p<0,05).
При оценке уровня Тс в сыворотке крови у 78,1% был ниже 12,1 номоль/л. При этом отмечена коррелятивная связь уровня Тс и длительности применения препаратов Тс и АС. Чем длительнее был курс приема препаратов Тс и АС, тем ниже уровень Тс в сыворотке крови (p<0,05).
Эректильная дисфункция (ЭД). ЭД различной степени выраженности выявлена по результатам опросника МИЭФ-5 у 25 (39,0%) мужчин. Легкая степень ЭД (1–-20 баллов) отмечена у 8 (12,5%), умеренная симптоматика (11–15) у 12 (18,7%) и тяжелая симптоматика (5–10) – у 5 (7,8%) мужчин (p<0,05).
По шкале твердости эрекции распределение обследованных мужчин представлено в табл. 1.

Всем пациентом выполняли фармакологический тест с использованием перорального селективного ингибитора 5-фосфодиэстеразы (5ФДЭ) – силденафила цитрат (СЦ) (Виагра-тест). У 10 (15,6%) мужчин тест был положительным, у 15 (23,4%) – отрицательным. Второй группе мужчин (с отрицательным Виагра-тестом) выполнено допплерографическое исследование сосудов полового члена с интракавернозным введением вазоактивного препарата папаверина гидрохлорида 2% 2 мл. При этом у всех мужчин отмечено снижение гемодинамических показателей кавернозных артерий. Снижение кровотока в одной из кавернозных артерий отмечено у 16 (25%) мужчин, в обеих – у 9 (14%) обследованных (p<0,05).
Бесплодие, гипотрофия тестикул, анэяуляция. Бесплодие в браке и гипотрофия тестикул в исследуемой группе отмечены в 31,2 и 29,6% случаев соответственно. По данным спермограммы, олигоспермия имела место у 13 (20,3%) пациентов, олигозооспермия у 11 (17,1%), азооспермия у 9 (14,1%). Полное поражение функциональной активности тестикул сопровождалось полным отсутствием эякулята (анэякуляция) при половом акте у 9 (14,1%) пациентов (p<0,05). Полагаем, что снижение количества сперматозоидов вплоть до азооспермии и гипотрофия яичек происходили вследствие подавления секреции гонадотропинов. Кроме того, у 14 (29,8%) была отмечена атрофия тестикул, при этом у 10 пациентов с двух сторон, у 4 – односторонняя. Симптомы нижних мочевыводящих путей (СНМП). СНМП выявлены у (21,8%) мужчин. При этом у большинства (10; 15,6%) , согласно опроснику IPSS, сумма баллов соответствовала умеренной симптоматике (8–19 баллов), у 4 (6,2%) – легкой (0–7 баллов). Кроме того, при анализе характера симптомов выявлено превалирование симптомов накопления, при оценке показатель качества жизни соответствовал неудовлетворительной оценке (табл. 2).
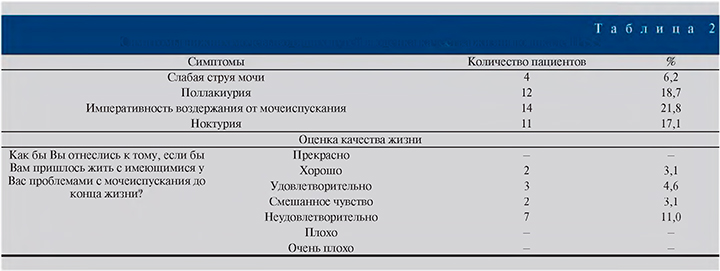
Гинекомастия. Гинекомастия определена у 9 (14,1%) пациентов (рис. 4 А, В).
У 7 (11%) пациентов гинекомастия была двусторонней, у 2 (3,1%) односторонней. По стадиям развития у 2 (3,1%) пациентов выявлена I стадия (развивающаяся) гинекомастии, у 3 (4,6%) верифицирована II стадия (промежуточная), у 4 (6,3%) отмечена III стадия (фиброзная) (p<0,05).
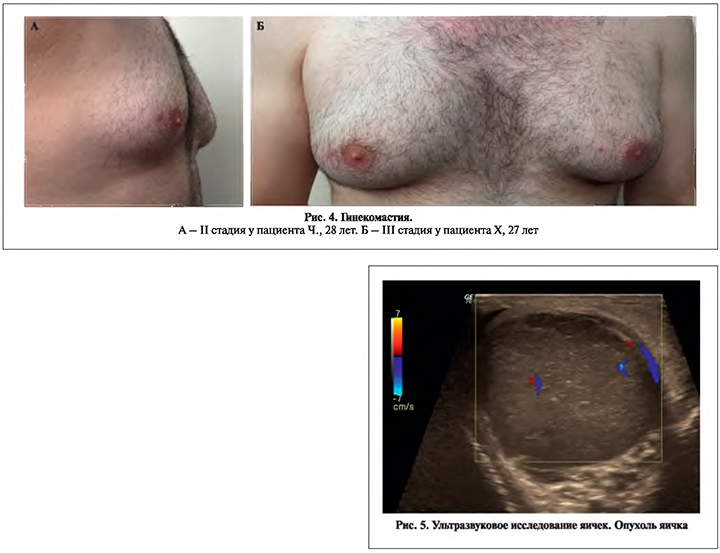
Новообразования. Опухоли яичка выявлены у 3 (4,7%) мужчин: у 1 (1,6%) – Лейдигома, у 2 (3,1%) – рак яичка (рис. 5).
Обсуждение. Применение ПТ и АС распространено среди посетителей спортивных залов и фитнес-центров. Знания о рисках и НЯ для здоровья при использовании ПТ и АС ограниченны из-за отсутствия клинических исследований по данной проблеме [18, 19].
Согласно результатам данного исследования, наиболее частыми НЯ у мужчин, использовавших ПТ и АС, были ЭД и бесплодие. Согласно данным литературы, выявленные нарушения обусловлены дисфункцией гипоталамо-гипофизарно-тестикулярной (ГГТ). Введение экзогенных высоких доз тестостерона может вызывать ЭД и бесплодие из-за подавления оси ГГТ и снижения продукции ФСГ и ЛГ, что приводит к снижению сперматои стериогенеза [20, 21].
Короткий прием препаратов с последующей отменой может приводить к восстановлению эректильной и репродуктивной функций, однако длительное применение может приводить к необратимым изменениям в тестикулах [21]. У всех (100%) пациентов, включенных в исследование, период приема ПТ и АС был более года. Кроме того, у 50% мужчин имело место сочетание приема двух и более ПТ и АС в сочетании с другими токсическими для репродуктивного эпителия препаратами (гормон роста, эфедрин, инсулин, тироксин, диуретические средства). Такое сочетание, по данным литературы, приводит к состоянию «стойкой инфертильности» [22]. Также восстановление фертильности после использования ПТ и АС в немедицинских целях осложняется «допинговой полипрагмазией», что осложняется необратимостью инфертильности [18]. Полученные результаты данного исследования также свидетельствуют о наличии не только качественных нарушений эякулята, но и количественных, чем и обусловлена анэуяляция данной категории обследованных, выявленная в 14,1% случаев. Согласно результатам ряда международных исследований, отмечено, что среднее время полного подавления сперматогенеза составляет прием ПТ в течение 3,5 мес. [23]. При этом среднее время восстановления сперматозоидов до уровня 20×106 мл после прекращения приема ПТ составляет 12–24 мес. Более длительный прием данных препаратов может приводить к тяжелым необратимым изменениям сперматогенеза [24]. Большинство (59,3%) обследованных принимали ПТ и АС от 1 года до 3 лет; 59,3%.
Среди СНМП в большинстве (57,5%) наблюдений регистрировали ирритативные симптомы. Известно, что функциональная активность детрузора снижается при дефиците Тс. В условиях длительного снижения уровня Тс в сыворотке крови нарушается синтез оксида азота (NO) в нейроэндотелии сосудов, что приводит к стойкому спазму стенки сосудов различных органов и систем, что в свою очередь способствует развитию сначала гемической, а затем и клеточно-тканевой гипоксии. Развивающаяся далее локальная и системная ишемия, в частности тазовая, ведущая к гипоксии тазово-уретро-простатической зоны, рассматривается важнейшим индуктором СНМП [25, 26].
По нашим данным, гинекомастия развилась в 14,1% наблюдений. По данным литературы, причиной этого состояния служит повышение уровня ароматазы за счет супрафизиологических концентраций Тс и конверсии его в эстроген из-за экзогенно водимых ПТ ([27, 28].
Взаимосвязь терапии препаратами Тс и опухолей яичка недостаточно изучена, однако дефицит Тс может приводить к повышенной активации выработки ФСГ, ЛГ, гиперстимуляции тестикул и провоцировать гипертрофические процессы в ткани яичка, которые возможно могут стимулировать атипический рост и развитие опухолей яичка [25]. Заключение. Необоснованная терапия ПТ и АС может сопровождаться широким спектром различных нежелательных явлений со стороны мочевыводящих путей и органов репродуктивной системы. Необходимо разъяснять мужчинам негативные эффекты необоснованного использования ПТ и АС, а также разрабатывать систему лечения НЯ.



