Введение. С самого начала развития пандемии новой коронавирусной инфекции было обращено внимание на гендерные различия в опасности развития и тяжести клинического течения инфекции [1]. На сегодняшний день общепринято, что одним из факторов риска более тяжелого течения COVID-19 является мужской пол [2].
Важной причиной возникающих гендерных различий и большей опасности как развития COVID-19 у мужчин, так и более тяжелого клинического течения может быть ускоренное проникновение вируса SARS-CoV-2 в эпителиальные клетки легочных альвеол, что сопровождается быстрым нарастанием вирусемии [1]. Два основных рецептора, необходимых для проникновения вирусов в клетки, – это «заякоренный» на клеточной мембране ангиотензин-превращающий фермент 2-го типа (АПФ2) и трансмембранная сериновая протеаза 2-го типа (TMPRSS2) [3]. Еще в «доковидное» время было известно, что андрогеновый рецептор является главным регулятором транскрипции TMPRSS2, увеличивая ее концентрацию при активации андрогенами [3]. В условиях in vitro показано, что экспрессия как АПФ2, так и TMPRSS2 увеличивается под действием активного метаболита тестостерона (Т), дигидротестостерона (ДГТ) [4]. Поэтому на ранних этапах изучения новой коронавирусной инфекции именно повышение андрогенного статуса мужчин связали с более тяжелым течением COVID-19 [5, 6]. Ретроспективный анализ ряда нерандомизированных исследований, в том числе и проведенных нашей группой, показал, что андрогендепривационная терапия (АДТ), результатом которой является снижение концентрации ДГТ, улучшение течения аденомы и рака простаты, ассоциируется с меньшим риском развития новой коронавирусной инфекции [7, 8]. Тому же было посвящено исследование БИСКВИТ, выполненное в клинике МНОЦ МГУ в 2020 г. [9]. При раннем начале лечения COVID-19 комбинацией бромгексина, блокирующего активность TMPRSS2 [10], и спиронолактона, обладающего неспецифическим антиандрогенным действием, снижающим уровни и Т, и ДГТ, и активность как АПФ-2, так и TMPRSS2 имела место более быстрая нормализация клинического состояния [9].
Однако у больных уже развившейся новой коронавирусной инфекцией, особенно с поражением легких, и требующей госпитального лечения, закономерности меняются. В этом случае снижение андрогенного статуса, определявшееся в основном по уровню Т, ассоциировано с неблагоприятным течением заболевания [11, 12]. Исследования нашей группы продемонстрировали, что низкий уровень Т у мужчин, госпитализированных с умеренно-тяжелым и тяжелым течением COVID-19 был ассоциирован с более выраженными инфильтративными изменениями в легких, высоким уровнем С-реактивного белка (СРБ), Д-димера и требовал более длительного и интенсивного лечения в госпитале [13]. Данные относительно взаимосвязи ДГТ как возможного звена патогенеза COVID-19 с тяжестью течения и прогнозом при новой коронавирусной инфекции практически отсутствуют. В одном из исследований было показано, что для пациентов с COVID-19 в ОРИТ характерен более низкий уровень ДГТ по сравнению со здоровыми добровольцами, однако основное внимание в этой работе было также сосредоточено на Т [14]. Мы попытались восполнить этот пробел одновременным анализом уровней как Т, так и ДГТ у больных мужчин, госпитализированных с COVID-19 в клинику МНОЦ МГУ.
Таким образом, целью настоящего исследования стала оценка влияния андрогенного статуса (Т и ДГТ) у мужчин на тяжесть течения и исходы COVID-19 умеренно-тяжелого и тяжелого течения.
Материалы и методы. В одноцентровое проспективное исследование были включены мужчины (n=151), госпитализированные в Медицинский научно-образовательный центр МГУ им. М. В. Ломоносова в период с 21 апреля 2020 по 13 июня 2020 г. c подтвержденным COVID-19 (по результатам положительного ПЦР-теста из носоглотки на наличие РНК SARS-Cov-2), у которых были определены уровни Т и ДГТ в плазме крови.
Для объективизации тяжести клинического состояния и адекватной оценки эффектов проводимой терапии были использованы две шкалы: Шкала тяжести дистресс-синдрома NEWS-2 [15], модернизированная для пациентов с COVID-19 [10], и наша оригинальная Шкала оценки клинического состояния больных коронавирусной инфекцией (ШОКС-КОВИД) [16].
Исследование уровня биохимических показателей было оценено при поступлении и через 12 (+/-2) дней или при выписке пациентов, если она произошла ранее. Компьютерная томография (КТ) легких и органов грудной клетки выполнена на 32-м срезовом компьютерном томографе Somatom Scope (Siemens ФРГ). Для количественного анализа инфильтративных изменений легких при COVID-19 применялись программы «Мультивокс» (разработчик – компания «Гаммамед», Москва) и «Botkin.AI (разработчик – компания «Интелоджик», Москва). Методика исследования подробно описана в наших предыдущих статьях [9, 17].
Определение сывороточной концентрации Т было проведено с помощью автоматического анализатора Roche Cobas 6000 методом иммунохемилюминесценции с использованием тест-системы Elecsys Testosterone II. Референсные значения, как и вся остальная информация по тест-системе Elecsys Testosterone II для определения уровня общего Т в крови, была получена из инструкции производителя, которая прилагается к тест-системе. Нижней границей нормы содержания Т в плазме крови мужчин в соответствии с инструкцией к тест-системе были 2,49 нг/мл у больных моложе 50 лет (диапазон – 2,49–8,36 нг/мл) и 1,93 нг/мл у лиц старше 50 лет (диапазон – 1,93–7,40 нг/мл).
Определение сывороточной концентрации ДГТ выполнено с использованием иммуноферментного анализа Elecsys Testosterone II Immunoassay (analyzer Roche Cobas 6000). Референсные значения, как и вся остальная информация по тест-системе для определения сывороточной концентрации ДГТ в крови, получена из инструкции производителя, которая прилагается к тест-системе. Нижней и верхней границей нормы содержания ДГТ в плазме крови у мужчин в соответствии с инструкцией к тест-системе были значения 175 и 1204 пг/мл соответственно.
Статистический анализ. Оценка нормальности распределения проводилась при помощи критерия Шапиро–Уилка и критерия Колмогорова–Смирнова. Описание количественных данных представлено в виде медианы и интерквантильного размаха (медиана и 25%; 75%) в случае ненормально распределенных данных и в виде среднего значения и стандартного отклонения (СО) в случае нормального распределения. Сравнение количественных признаков между группами проведено с использованием критерия Манна–Уитни при непараметрическом распределении данных и при помощи Т-критерия Стьюдента при нормальном распределении. Качественные данные представлены в виде абсолютных и относительных величин. Значимость различий между группами по качественным признакам оценивалась на основании критерия ХИ-квадрат (χ2), а также двустороннего точного теста Фишера. Для оценки корреляции использовался коэффициент корреляции Спирмана. Для регрессионного анализа использовались логистическая регрессия (в случае бинарной зависимой переменной) и линейная регрессия (в случае непрерывной зависимой переменной). Различия считались статистически значимыми при p <0,05.
Результаты. В общей выборке пациентов – мужчин с COVID-19 (n=151) – медиана Т оказалась равной 2,15 нг/мл (IQR – 1,21–3,42). Дефицит Т наблюдался у 70 (46,4%) пациентов. Медиана ДГТ (измеренного у 125 пациентов) составила 374,00 пг/мл (IQR – 242,70–557,90). При этом дефицит ДГТ наблюдался лишь у 18 (14,4%) пациентов, в то время как у 85,6% мужчин, заболевших новой коронавирусной инфекцией, ДГТ оставался в пределах нормальных значений. В табл. 1 представлены результаты сравнения показателей между группами пациентов, разделенных в соответствии с концентрацией Т – выше (n=75) и ниже (n=76) медианы, а также в соответствии с концентрацией ДГТ – выше (n=63) и ниже (n=62) медианы.

В ходе анализа для Т было показано, что у пациентов со сниженным уровнем Т все показатели системного воспаления (СРБ, лейкоциты, нейтрофилы, индекс Нейтрофилы/лимфоциты, соотношение лимфоциты/СРБ) были значимо повышены по сравнению с пациентами с нормальным уровнем Т. К концу наблюдения по большинству показателей различия сохранялись, но были менее выражены. Аналогично риск тромбозов, определяемый по показателям Д-димера и фибриногена, оказался значимо выше у пациентов со сниженным уровнем Т. У мужчин со сниженным уровнем Т площадь поражения легких по КТ была более, чем вдвое больше (25,75 против 11,95%), по сравнению с пациентами и нормальной концентрацией Т. Клиническая тяжесть состояния по шкале NEWS-2 (<0,002) и общая оценка тяжести пациентов по шкале ШОКС-КОВИД (p<0,001) были значимо выше в группе пациентов с уровнем Т ниже медианы.
В этой группе значимо чаще назначались кортикостероиды и пациенты со сниженным уровнем Т значимо чаще попадали в ОРИТ, требовали ИВЛ и проводили в стационаре на 3 суток больше (<0,002) до нормализации состояния.
Мужчины, заболевшие COVID-19, с уровнем ДГТ ниже медианы были значительно старше, с меньшим индексом массы тела, чем пациенты с уровнем ДГТ выше медианы. В отношении воспалительных маркеров и маркеров тромбообразования, тяжести клинического соcтояния (шкала NEWS-2) и общей тяжести течения COVID-19 (шкала ШОКС-КОВИД) значимых различий в двух группах в зависимости от концентрации ДГТ как при поступлении, так и в динамике обнаружено не было. Пациенты с уровнем ДГТ ниже медианы попадали в ОРИТ с такой же частотой, как и с сохранным уровнем ДГТ, но проводили в ОРИТ значимо больше времени и значимо чаще переводились на ИВЛ. Частота назначения кортикостероидов и длительность пребывания в стационаре в группах в зависимости от уровня ДГТ значимо не различались.
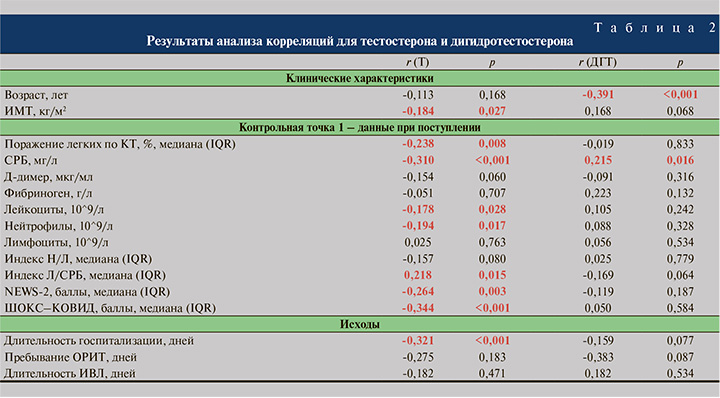
Результаты анализа корреляций между уровнями Т и ДГТ, с одной стороны, и клиническими характеристиками и показателями, характеризующими особенности проявлений новой коронавирусной инфекции, с другой, представлены в табл. 2. Показано, что низкий уровень Т ассоциируется с более выраженными воспалительными процессами. Для ДГТ практически отсутствовали корреляции с проявлениями COVID-19. Исключение составляет слабая положительная корреляция с уровнем СРБ, что может с осторожностью трактоваться как большая выраженность воспаления при более высоком уровне ДГТ. На основании полученных результатов и данных литературы сформирован ориентированный ациклический граф для необходимости перевода пациентов в ОРИТ или смерти (см. рисунок).
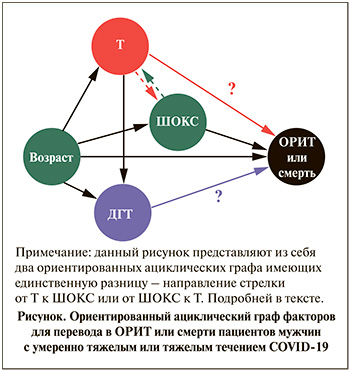
Черные линии демонстрируют очевидные доказанные связи, а линии со знаками вопросов – те зависимости, которые явились предметом данного исследования. Особенностью стало то, что в качестве интегрального показателя тяжести проявлений новой коронавирусной инфекции использовалась оригинальная шкала ШОКС-КОВИД.
Многофакторные логистические регрессионные модели, описывающие вероятность более тяжелого течения COVID-19, выражающегося в необходимости перевода пациентов в ОРИТ, и смерти с учетом концентрации Т и ДГТ, представлены в табл. 3.
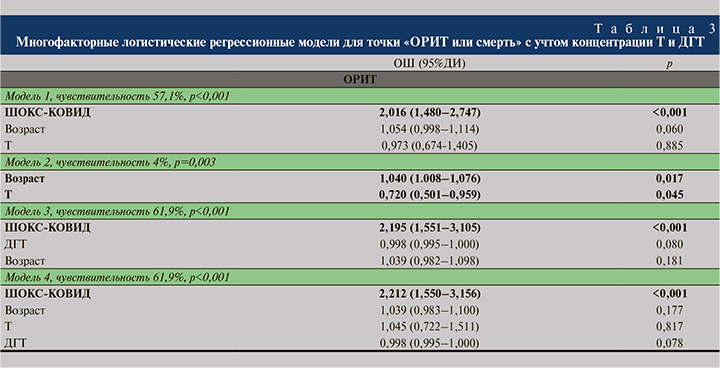
Первая модель (чувствительность – 57,1%) включила кроме возраста и тяжести COVID-19 по ШОКС-КОВИД и концентрацию Т. Как видно, ни уровень Т, ни возраст не определяли риск неблагоприятного течения новой коронавирусной инфекции. Главным значимым фактором перевода пациентов в ОРИТ или смерти явилась шкала ШОКС-КОВИД: при увеличении на каждый дополнительный балл шансы на неблагоприятный исход возрастали более, чем вдвое (ОШ=2,016; 95% ДИ=1,480–2,747; р<0,001).
С учетом выявленной корреляции между уровнем Т и тяжестью проявлений болезни по ШОКС-КОВИД возможно предположить два варианта зависимости переменных, представленных на рис. 1 в виде цветных пунктирных линий. Если предположить главенство тяжести течения COVID-19 и проявлений болезни, сопровождавшейся снижением уровня Т, то зависимость представлена зеленой пунктирной линией. В этом случае наша первая модель многофакторных связей будет корректной. Но нельзя исключать и обратного, что низкий уровень Т определяет тяжесть проявлений болезни (красная пунктирная стрелка на рис. 1) и ШОКС-КОВИД является медиатором влияния Т на риск перевода в ОРИТ или смерти пациентов мужчин с СOVID-19. Для проверки этого предположения была создана вторая модель, исключившая из числа анализируемых факторов ШОКС-КОВИД. В этом случае и возраст, и, что мы и проверяли, низкий уровень Т ассоциированы с рисками неблагоприятных исходов новой коронавирусной инфекции. Однако чувствительность модели без ШОКС очень низкая (всего 4%), что позволяет сделать вывод: даже если низкий уровень Т и влияет на число баллов ШОКС-КОВИД, это не единственный и не главный фактор тяжести.
Третья модель аналогична первой с единственной разницей, что вместо Т изучалось возможное влияние содержания ДГТ вместе с возрастом и ШОКС-КОВИД на риск перевода в ОРИТ или смерти пациентов. При чувствительности модели 61,9% ни ДГТ, ни возраст не явились значимыми факторами и лишь увеличение тяжести проявлений болезни на каждый дополнительный балл ШОКС-КОВИД удваивало шанс попасть в ОРИТ или умереть больным мужчин с COVID-19 (ОШ=2,195; 95% ДИ: 1,501–3,105; р<0.001).
Четвертая модель включила оба фактора андрогенного статуса (концентрации Т и ДГТ) одновременно с возрастом и числом баллов по ШОКС-КОВИД. При чувствительности модели в 61,9% вновь подтвердилось отсутствие влияния мужских половых гормонов Т и/или ДГТ, а также возраста на неблагоприятные прогнозы при COVID-19. Вновь единственным значимым фактором, определившим риск попадания в ОРИТ или смерти мужчин с новой коронавирусной инфекцией, оказалось число баллов по ШОКС-КОВИД (ОШ=2,12; 95% ДИ: 1,550–3,156; р<0,001) интегральным и информативным параметрами тяжести течения новой коронавирусной инфекции.
На следующем этапе была построена линейная регрессионная модель для прогнозирования ассоциации между уровнями Т и ШОКС-КОВИД как наиболее чувствительный предиктор для исходов COVID-19 с поправкой на возраст (табл. 4).

Данная модель показала, что повышение уровня Т ассоциировано со снижением ШОКС-КОВИД. Тем самым, как мы писали ранее, можно предполагать два варианта зависимости: либо более тяжелое течение новой коронавирусной инфекции сопровождалось снижением уровня Т, либо, что менее вероятно, наоборот, при снижении андрогенной функции и концентрации Т у больных новой коронавирусной инфекцией увеличивается тяжесть течения болезни и количество баллов по ШОКС-КОВИД. Следует отметить невысокий уровень скорректированного R2 (0,105), показывающий, что только 10,5% изменчивости ШОКС-КОВИД может объясняться возрастом и уровнем Т.
Обсуждение результатов. Молекулярная основа гендерных различий в подверженности к развитию COVID-19 до сих пор находится на стадии обсуждения. Еще в «доковидное» время было известно, что реакции врожденного и приобретенного иммунитета у мужчин и женщин различаются, что связывают с генетическими особенностями, а именно с наличием двух Х-хромосом у женщин и одной Х-хромосомы у мужчин [18]. На Х-хромосоме расположены гены, ответственные за многие реакции врожденного иммунитета. Некоторые исследования показывают, что Х-хромосома у женщин может избегать инактивации, в результате чего женщины получают двойную дозу вышеописанных генов, что таким образом обеспечивает более сильный иммунный ответ [2]. С другой стороны, связанный с Х-хромосомой у мужчин синтез тестостерона, превращение его в ДГТ могут сопровождаться активацией андрогенных рецепторов, повышенной активацией АПФ-2 и TMPRSS2, являющихся «входными воротами» для вируса SARS-CoV-2 в клетки [4]. В этом случае именно повышенный уровень ДГТ может рассматриваться в качестве главного негативного фактора развития COVID-19 у мужчин. С этой точки зрения можно сделать предположение, что ранняя специфическая или неспецифическая антиандрогенная терапия может снижать риск заболеть новой коронавирусной инфекцией и предотвратить прогрессирование болезни [9, 19]. Следует отметить, что в текущий момент нет данных РКИ, подтверждающих подобное предположение.
Задачей настоящего исследования был анализ потенциальной связи уровня как Т, так и ДГТ с тяжестью течения и прогнозом уже развившейся новой коронавирусной инфекцией, потребовавшей госпитализации.
В нашем предыдущем исследовании мы выявили статистически значимую ассоциативную взаимосвязь между сниженным уровнем Т и большей тяжестью течения COVID- 19 у пациентов-мужчин [5]. Хотя направленность этих связей вызвала вопросы. В настоящей работе убедительно подтверждено, что почти у половины мужчин (46,4%) с тяжелым и умеренно-тяжелым течением новой коронавирусной инфекции имеет место снижение уровня Т ниже нормы. Больные COVID-19 с уровнем Т ниже медианы гораздо чаще переводились в ОРИТ – 23,7 против 9,3% (p=0,018) и значимо чаще требовали проведения ИВЛ – 15,8 против 4,0% (p=0,032) по сравнению с группой мужчин с новой коронавирусной инфекцией и уровнем Т выше медианы соответственно. Аналогично и в ряде других работ показано, что концентрация Т у мужчин на ИВЛ была в 3 раза ниже, чем у мужчин без ИВЛ [20]. При этом Т в построенных логистических регрессионных моделях не был значимо связан с риском перевода в ОРИТ и необходимостью проведения ИВЛ.
Протективное действие андрогенов, в частности Т, в отношении воспаления в легочной паренхиме было показано ранее, преимущественно при бронхиальной астме, ХОБЛ, легочном фиброзе и различных инфекционных заболеваниях [21]. Полученные в настоящем исследовании данные подтверждены и в других работах: для мужчин без вовлечения легочной ткани в воспалительный процесс при COVID-19 был характерен наибольший уровень Т, который прогрессивно снижался при поражении легочной ткани менее 50% и еще более снижался при поражении более 50% паренхимы [22]. Присоединение пневмонии при COVID-19 также было ассоциировано со снижением концентрации Т [23]. Для мужчин с COVID-19, попадавших в ОРИТ, концентрация Т была значительно ниже, чем для мужчин, проходивших стационарное лечение вне ОРИТ [22, 24]. Защитный потенциал Т может объясняться его антицитокиновыми эффектами: повышенный уровень тестостерона сопровождается снижением интерлейкина-1β, интерлейкина-6 [25], а также ростом уровня интерлейкина-10, способствующего снижению уровня фактора некроза опухоли=TNF-α [26], что еще раз подтверждает полученные нами данные и объясняет возможные механизмы.
Для выявления направленности возможных связей низкого уровня Т, тяжести течения и неблагоприятного прогноза (попадание в ОРИТ или смерти) мужчин с COVID-19 был применен метод создания направленных ациклических графов, (DAG от англ. directed acyclic graph), представленных на рис. 1. Как следует из результатов многофакторной модели (модель 1 в табл. 3), уровень Т, как и возраст, не был значимо связан с плохим прогнозом и главным фактором попадания пациентов в ОРИТ или смерти служило число баллов по интегральной шкале ШОКС-КОВИД. Это объясняется тем, что сама шкала охватывает как клинические (ЧДД, температуры, сатурация, вентиляция), так и лабораторно-инструментальные данные (СРБ, Д-димер, поражение легких по КТ), что особенно актуально при прогнозировании течения заболевания. Эта модель имеет чувствительность 57,1% и предполагает ведущую роль ШОКС-КОВИД в формировании прогноза и незначимую подчиненную роль сниженного уровня Т, связанного не с возрастом, а с тяжестью COVID-19 (зеленая пунктирная стрелка на рисунке).
Для исследования возможной обратной зависимости, при которой низкий уровень Т определяет более тяжелое течение болезни и число баллов по ШОКС-КОВИД, которая служит медиатором влияния на прогноз пациентов, мы построили многофакторную модель без включения интегральной шкалы (модель 2 в табл. 3). В этой ситуации и меньший уровень Т, и больший возраст значимо повышали шансы пациентов на неблагоприятный прогноз. Но чувствительность этой модели оказалась крайне низкой =4%, что позволяет считать низкий уровень Т не единственным и не главным фактором ухудшения течения COVID-19 и увеличения числа баллов по шкале ШОКС-КОВИД.
Аналогичные данные в отношении ДГТ весьма ограниченны, а имеющиеся на этот счет публикации позволяют лишь косвенно судить о возможной взаимосвязи этого гормона с тяжестью и прогнозом больных новой коронавирусной инфекцией. В единственной работе на ограниченном количестве пациентов, в которой проводилось сравнение ДГТ между больными COVID-19 мужчинами в ОРИТ и здоровыми добровольцами, сниженный уровень ДГТ был зарегистрирован у 17 из 35 (48,6%) человек [27]. При анализе расширенной выборки пациентов показано, что для пациентов с COVID-19 в ОРИТ (n=39) концентрация ДГТ была значительно ниже, чем в контрольной группе здоровых добровольцев, при этом опускаясь ниже референсных значений [14]. Это были пациенты с критической тяжестью заболевания, находившиеся в ОРИТ. В наше исследование были включены пациенты с умеренно-тяжелым и тяжелым течением болезни, находившиеся в стационаре, из которых только 25 (16,6%) человек потребовали интенсивной терапии. В этой группе концентрация ДГТ оказалась в пределах нормальных значений у 85,6% пациентов. Тяжесть течения COVID-19 по баллам ШОКС-КОВИД, частота перевода в ОРИТ, длительность лечения в стационаре пациентов с уровнями ДГТ ниже и выше медианы не различались. Во всех проведенных многофакторных анализах концентрация ДГТ не определяла риска негативного прогноза пациентов с СOVID-19. ДГТ не влияет на исходы COVID-19, хоть и может обладать негативным провоспалительным действием [28]. Результаты настоящего корреляционного анализа (для ДГТ и СРБ r=0,215; p=0,016) также не позволяют исключить незначительный провоспалительный эффект, который не был связан с ухудшением течения болезни. Наиболее значимым фактором, влиявшим на вероятность перевода в ОРИТ мужчин с новой коронавирусной инфекцией, находившихся на госпитальном лечении, являлось количество баллов по ШОКС-КОВИД.
Мы также построили многофакторную линейную регрессионную модель взаимосвязей ШОКС-КОВИД с Т и возрастом пациентов. Которая показала ассоциацию баллов по ШОКС-КОВИД с Т (B – 0,444, p=0,005). Иными словами, чем тяжелее течение болезни и число баллов по ШОКС-КОВИД, тем ниже определяемый у мужчин уровень Т. Следует правда отметить, что данная модель описывала только 10,5% изменчивости ШОКС-КОВИД, что еще раз подчеркивает, что возраст и уровень Т не являются главными показателями, определяющими тяжесть COVID-19.
Заключение. ШОКС-КОВИД является наиболее чувствительным предиктором исхода COVID-19 у госпитализированных мужчин, в том числе с учетом возраста. Т и ДГТ непосредственно не оказывают влияния на исходы заболевания. Большая тяжесть течения инфекции и увеличение баллов по ШОКС-КОВИД ассоциированы со снижением концентрации Т, ослаблением его противовоспалительных и антицитокиновых эффектов, что опосредованно ухудшает прогноз пациентов мужчин с новой коронавирусной инфекцией, находящихся на госпитальном лечении. Для ДГТ такие взаимосвязи отсутствуют.



