Введение. Ежегодная заболеваемость инфекциями мочевыводящих путей (ИМП) в мире составляет более 150 млн случаев, из которых на пиелонефрит приходится около 14–22% [1, 2]. Основным путем проникновения инфекции в почку является восходящий, однако при любом пути проникновения микроорганизмы задерживаются, как правило, в венозных капиллярах почки, откуда распространяются на межуточную ткань, вызывая в ней развитие гнойно-воспалительного процесса [3]. Согласно данным литературы, у 15–21% пациентов с острым пиелонефритом диагностируются различные гнойно-деструктивные формы: апостематозный пиелонефрит, абсцесс и карбункул почки. Уросепсис, летальность которого достигает 60%, является одним из осложнений острого пиелонефрита [4]. В 2021–2022 гг. наиболее частыми возбудителями ИМП явились Escherichia coli (69%), Enterococcus faecalis (10%), Klebsiella pneumoniae (4%), Pseudomonas aeruginosa (4%), Proteus mirabilis (4%) и Staphylococcus aureus (2%) [5].
В то же время с декабря 2019 г. зарегистрировано более 600 млн случаев новой коронавирусной инфекции Covid-19 и более 6 млн смертей от осложнений [6]. Дыхательная, иммунная и свертывающая системы являются основной мишенью Covid-19 [7]. По данным исследований, у 29% пациентов с тяжелым течением новой коронавирусной инфекции встречается острое повреждение почек (ОПП) [8–11].
Патогенез COVID-19 продолжает изучаться. Вирус SARS-CoV2 передается воздушно-капельным, воздушно-пылевым или контактным путями. Исследованы два основных пути проникновения вируса в клетку: проводниками вируса могут служить рецептор к ангиотензин-превращающему ферменту 2-го типа (АПФ2) или трансмембранный гликопротеин CD-147 [12]. АПФ2 играет важную роль в ренин-ангиотензин-альдостероновой системе (РААС), поскольку противодействует эффектам ангиотензина II, который вызывает системную вазоконстрикцию и высвобождение альдостерона. Ангиотензин I преобразуется в ангиотензин II с помощью АПФ2 [13]. Доказано, что экспрессия АПФ2 примерно в 100 раз выше в почках, чем в легких [13].
Спайковый белок (S-белок) коронавирусов по своей структуре имитирует АПФ2, благодаря чему вирусные частицы успешно связываются с рецепторами АПФ2, после чего РНК вируса встраивается в РНК клетки-мишени [14]. В ранних исследованиях предполагалась низкая частота развития (3–9%) острого повреждения почек у пациентов с новой коронавирусной инфекцией COVID-19 [15, 16]. Недавние исследования показали более высокую частоту развития повреждения почек среди данной когорты пациентов. В исследовании Cheng и соавт. выявлено, что среди 710 госпитализированных пациентов с COVID-19 в 60% случаев в первые дни госпитализации развивалась протеинурия, в 30% –альбуминурия, в 26,7% – гематурия, повышение уровня креатинина и мочевины крови составили 15,5 и 14,1% соответственно, при этом острое повреждение почек являлось фактором риска летального исхода [17, 18]. При исследовании 357 пациентов с ОРДС, не имевших хронических заболеваний почек, в 68% случаев развилось ОПП [19].
Основными факторами острого повреждения почек у пациентов являются развитие системного воспалительного ответа и «цитокиновый шторм». Гиперпродукция цитокинов связана с повреждением легких и почек: поврежденный эпителий почечных канальцев способствует повышению уровня интерлейкина-6 (ИЛ-6) [19]. У пациентов с острым респираторным дистресс-синдромом повреждение почек может возникать в результате гиповолемии, нарушения почечного кровотока, повышенной сосудистой проницаемости [20]. ОРДС также может вызывать гипоксию мозгового вещества почек, что является дополнительным повреждением канальцев почек [19].
Ранние схемы лечения новой коронавирусной инфекции включили применение антибактериальных препаратов, что привело к значительному росту антибактериальной резистентности, по данным за 2019–2021 гг. Например, в исследовании Ruwandi и соавт. сообщается об увеличении резистентности к препаратам группы макролидов (26% в 2019 г. против 43% в 2021 г.) [21]. В исследовании Huang и соавт. сообщается об увеличении резистентности к препаратам группы пенициллинов, цефалоспоринов первого поколения (более 60% за период с 2019 по 2021 г.) [5].
Таким образом, механизмы повреждения почек у пациентов, перенесших новую коронавирусную инфекцию, прогрессирующая резистентность микроорганизмов к антибактериальным препаратам за период пандемии остаются проблемами, требующими дальнейших исследований и решений.
Цель исследования: изучить частоту и возможные причины возникновения гнойных форм пиелонефрита у пациентов, перенесших новую коронавирусную инфекцию Covid-19.
Материалы и методы. Исследование проводилось на базах университетской клиники урологии РНИМУ им. Н. И. Пирогова. В проспективное и ретроспективное исследование включены результаты обследования и лечения 403 пациентов с диагнозом «острый необструктивный пиелонефрит», среди которых 5 (1,2%) мужчин и 398 (98,8%) женщин. Двести семьдесят шесть пациентов, из которых 4 мужчин, находились на лечении в условиях урологического отделения в период с 2018 по 2019 г. (доковидная группа), 127 пациентов, среди которых 1 мужчина, – в период заболеваемости новой коронавирусной инфекцией с 2020 по 2021 г. (постковидная группа). В группе из 127 пациентов 78 (61,4%) перенесли новую коронавирусную инфекцию различной степени тяжести, в данной когорте больных коронавирусная инфекция подтверждена лабораторно.
В исследование не включались пациенты, имевшие длительный урологический анамнез, в том числе перенесшие оперативные вмешательства по поводу мочекаменной болезни, аномалий развития мочевыводящих путей, травмы и др., а также пациенты с тяжелыми сопутствовавшими заболеваниями, осложнявшими течение острого пиелонефрита, такими как сахарный диабет и другие болезни эндокринной системы, онкологические, аутоиммунные заболевания. Возраст исследуемых варьировался от 18 до 76 лет (средний возраст – 38±5 лет).
Всем пациентам, включенным в исследование, проводилась оценка жалоб, анамнеза, данных объективного статуса и лабораторно-инструментальных исследований, в том числе результатов общего и биохимического анализов крови, посева мочи с определением чувствительности к антибактериальным препаратам, уровня С-реактивного белка, общего анализа мочи, показателей коагулограммы, данных ультразвуковой диагностики, МРТ (магнитно-резонансная томография) органов брюшной полости или МСКТ (мультиспиральная компьютерная томография) органов брюшной полости с внутривенным контрастированием. Всем пациентам в качестве эмпирической терапии назначались препараты группы пенициллинов или фторхинолонов, в случае выявления гнойно-деструктивных форм пиелонефрита производилась смена антибактериальной терапии на препараты групп резерва, таких как карбапенемы, глицилциклины, цефалоспорины IV поколения и другие.
Результаты исследований. Из 276 пациентов доковидной группы гнойно-деструктивные изменения в паренхиме почки были диагностированы у 14 (5%) пациентов, из них 3 (1,1%) выполнено дренирование абсцессов почки под ультразвуковым и МСКТ-наведением, у остальных пациентов данной группы воспалительные изменения регрессировали на фоне проведения консервативной терапии. Средний уровень лейкоцитов при поступлении у пациентов данной группы составил 14,4 (±3,2) х109, С-реактивного белка – 63,7 мг/л (у 17 [6,1%] пациентов уровень С-реактивного белка выше 200 мг/л), изменения в коагулограмме выявлены у 21 (7,6%) пациента. Бактериологические посевы мочи были положительными у 91 (33%) пациента. Среди микроорганизмов наиболее часто встречались Escherichia coli у 105 (38,0 %) пациентов, Enterococcus faecalis у 58 (21,0%), Proteus mirabilis у 11 (4,0%), Klebsiella pneumoniae у 36 (13,0%) пациентов. Средний койко-день составлял 7,3 дня.
Среди 127 пациентов группы, находившихся на лечении в период пандемии с острым необструктивным пиелонефритом, у 22 (17%) больных гнойно-деструктивными формами пиелонефрита новая коронавирусная инфекция подтверждена лабораторно. У 3 (2,4%) пациентов с гнойно-деструктивной формой пиелонефрита лабораторного подтверждения перенесенной коронавирусной инфекции не отмечено. Средний уровень лейкоцитов крови при поступлении составил 15,1 (±2,7) х109, С-реактивного белка – 71,5(±8,3) мг/л, изменения в коагулограмме выявлены у 18 (14,2%) пациентов. Все пациенты получали комплексную терапию, включавшую антибактериальные препараты (группа карбапенемов, аминогликозидов, глицилциклинов или ванкомицин). Средний койко-день составил 7,8. Из 22 (17%) пациенток с гнойно-деструктивным пиелонефритом постковидной группы оперативное вмешательство проведено 6 (4,7%) больным, в 5 случаях проведено дренирование абсцессов почки под ультразвуковым (УЗ) и МСКТ-наведением и в 1 случае выполнена нефрэктомия.
По данным бактериологических исследований мочи в период с 2018 по 2021 г., встречаемость Escherichia coli увеличилась на 5,2% (2018/2021 с 17,9 до 23,1%), Enterococcus faecalis на 2,8% (2018/2021 с 20,6 до 23,4%), Klebsiella pneumonia на 9,8% (2018/2021 с 13,9 до 23,7%); Proteus mirabilis на 0,1% (2018/2021 с 2,7 до 2,8%), Acinetobacter baumannii на 2,1% (2018/2021 с 2,3 до 4,4%) и Staphylococcus haemolyticus на 0,1% (2018/2021 с 1,8 до 1,9%) (рис. 1). Частота встречаемости Pseudomonas aeruginosa уменьшилась на 0,9% (2019/2021 с 5,7 до 4,8%), Staphylococcus aureus на 0,3% (2019/2021 с 1,8 до 1,5%), Enterobacter cloacae – на 2,9% (с 3,6 до 0,7%). В когорте больных 2019 по 2021 гг. с выделенной Enterococcus faecalis прослеживается снижение резистентности к ципрофлоксацину на 3% (с 49,8 до 46,8%), к левофлоксацину на 22% (с 40 до 18%); Escherichia coli демонстрирует повышение резистентности к левофлоксацину на 16,8% (с 29,8 до 46,6%), ципрофлоксацину на 6,1% (с 40,1 до 46,2 %); Klebsiella pneumoniae демонстрирует повышение резистентности к левофлоксацину на 15,1% (с 29,1 до 44,2%), ципрофлоксацину на 17,4% (с 38,8 до 56,2%). Proteus mirabilis продемонстрировал повышение резистентности к левофлоксацину на 4,2 % (с 19,9 до 24,1%), ципрофлоксацину на 33,1% (с 22,3% до 55,4%); у Pseudomonas aeruginosa отмечается повышение резистентности к левофлоксацину на 1,9% (с 60,8 до 62,7%), снижение резистентности к ципрофлоксацину на 1,7% (с 57,8 до 56,1%). Staphylococcus aureus демонстрирует увеличение резистентности к левофлоксацину на 15,8% (с 10,3 до 26,1%), ципрофлоксацину на 13,3% (с 19,7 до 33%); Enterobacter cloacae демонстрирует повышение резистентности к левофлоксацину на 9,4% (с 18,6 до 28%), ципрофлоксацину на 5,1% (с 38,5 до 43,6%).
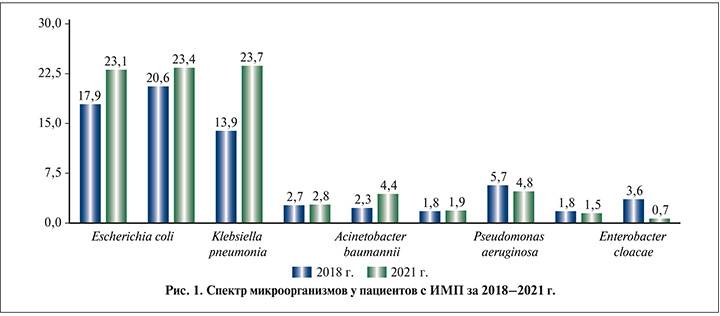
Таким образом, у пациентов с острым необструктивным пиелонефритом, которые перенесли новую коронавирусную инфекцию, наблюдается увеличение количества гнойно-деструктивных форм пиелонефрита. При исследовании встречаемости микроорганизмов и резистентности их к антибактериальным препаратам, выделенных в посевах мочи пациентов, находившихся на стационарном лечении с инфекцией мочевыводящих путей с 2018 по 2019 г., широкое применение антибактериальной терапии в период пандемии, использование резервных антибактериальных препаратов в качестве эмпирической терапии привели к появлению панрезистентных штаммов микроорганизмов.
Клинические примеры. Представляем три клинических примера, отразивших различные исходы острого гнойно-деструктивного пиелонефрита после перенесенной новой коронавирусной инфекции.
Клинический пример № 1. Пациентка Х. 21 года госпитализирована с жалобами на боль в поясничной области слева, повышение температуры до 39°С, слабость. Из анамнеза: перенесла новую коронавирусную инфекцию Covid-19 за две недели до обращения в ГКБ № 1 им Н. И. Пирогова; жалобы беспокоили в течение 4 сут., принимала препараты группы нестероидных противовоспалительных средств (НПВС), Ципрофлоксацин – 1000 мг/сут. Сопутствовавших заболеваний у пациентки не выявлено.
При поступлении температура тела – 38,6°С. Данные лабораторных исследований: уровень лейкоцитов крови – 19,8х109/л; уровень гемоглобина – 118 г/л; уровень С-реактивного белка – 228,9 мг/л; уровень креатинина – 128 мкмоль/л; лейкоцитурия – 500,0 в п/з. Данные посева мочи: Escherichia coli 106. По данным КТ органов брюшной полости выявлен формирующийся абсцесс верхнего полюса правой почки (рис. 2).
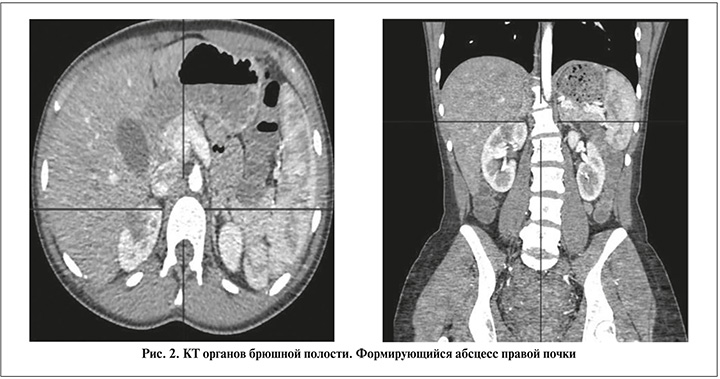
Назначена антибактериальная терапия: Меропенем 3000 мг/сут., Амикацин 1000 мг/сут.; антикоагулянтная терапия: Фраксипарин 0,6 мл, симптоматическая терапия.
Динамика на 1-е сутки: температура тела – 37,5°С, лабораторные анализы: лейкоциты крови – 12,8х109/л; гемоглобин – 122 г/л; уровень С-реактивного белка – 119,5 мг/л; креатинин – 118 мкмоль/л. На 7-е сутки: температура тела – 36,5°С, данные лабораторных анализов: лейкоциты крови – 9,2х109/л; гемоглобин – 121 г/л; С-реактивный белок – 19,5 мг/л; креатинин – 95 мкмоль/л. В анализе мочи – 5–6 лейкоцитов в п/зр. В посеве мочи роста микрофлоры нет.
При контрольном УЗИ почек на 9-е сутки данных о наличии абсцесса не выявлено, пациентка выписана в удовлетворительном состоянии.
Клинический пример № 2. Пациентка Л. 29 лет госпитализирована с жалобами на боль в поясничной области слева, повышение температуры тела до 40°С с ознобом. Из анамнеза: жалобы беспокоят в течение 9 дней, самостоятельно принимала НПВС, за месяц до госпитализации перенесла Covid-19, по поводу чего проводилось стационарное лечение. Сопутствовавшее заболевание – хронический гастрит.
При поступлении температура тела – 39,4°С; данные лабораторных исследований: лейкоциты крови – 15,8х109/л; гемоглобин – 107 г/л; СРБ – 334,2 мг/л; креатинин – 118 мкмоль/л; лейкоцитурия сплошь в п/з. Данные посева мочи: рост микрофлоры не выявлен.
По данным КТ органов брюшной полости выявлен формирующийся абсцесс левой почки (рис. 3).
Пациентке выполнено дренирование абсцесса левой почки под МСКТ-навигацией – получено гнойное содержимое в объеме 20 мл (рис. 4). Назначена антибактериальная терапия: Меропенем 3000 мг/сут., Амикацин 1000 мг/сут., акнтикоагулянтная терапия: Фраксипарин 0,6 мл, симптоматическая терапия.
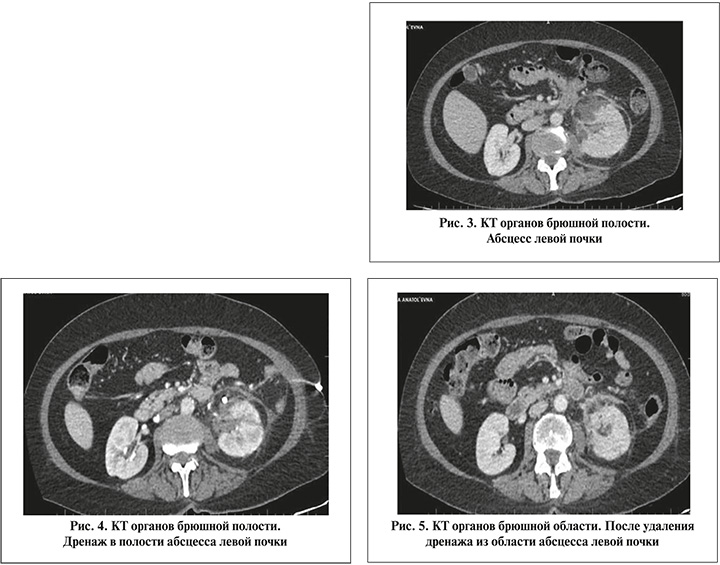
Динамика на 1-е сутки: температура тела – 37,9°С; лабораторные анализы: лейкоциты крови – 11,4х109/л; гемоглобин – 118 г/л; СРБ – 189,2 мг/л; креатинин – 109 мкмоль/л. На 5-е сутки дренаж из полости абсцесса удален. Температура тела – 37,2°С. Лабораторные данные: лейкоциты крови – 10,1х109/л; гемоглобин – 116 г/л; СРБ – 51,1 мг/л; креатинин – 109 мкмоль/л. На 8-е сутки наблюдалась положительная динамика: нормализовалась температура тела; лейкоциты крови – 9,1х109/л, СРБ – 21,2 мг/л, в анализе мочи: лейкоцитурия – 10–15 в п/зр. В посеве мочи: роста микрофлоры нет. На 9-е сутки, по данным КТ органов брюшной полости, данных за наличие очагов деструкции почечной паренхимы не выявлено (рис. 5). На 10-е сутки пациентка выписана в удовлетворительном состоянии.
Клинический пример № 3. Пациентка Е. 20 лет госпитализирована с жалобами на боль в поясничной области слева, гипертермию с ознобом до 37,9°С. Из анамнеза: жалобы беспокоят в течение 3 дней, принимала НПВС, за 3 мес. назад до обращения перенесла новую коронавирусную инфекцию. Сопутствовавших заболеваний не выявлено.
При поступлении: температура тела – 37,8°С; данные лабораторных исследований: лейкоциты крови – 12,8х109/л; гемоглобин – 104 г/л; СРБ – 59,2 мг/л; креатинин – 128 мкмоль/л; в анализе мочи: лейкоциты – 500,0 в п/з.
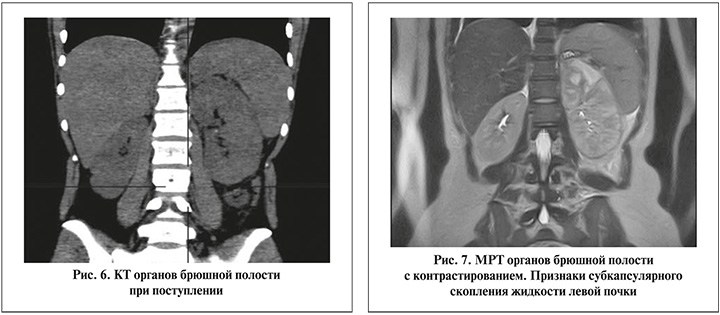
По данным КТ органов брюшной полости, утолщение паренхимы левой почки без очагов деструкции, чашечно-лоханочная система почек не расширена (рис. 6).
Установлен диагноз «острый необструктивный пиелонефрит слева», назначена антибактериальная терапия: Амоксиклав – 2000 мг/сут., Амикацин – 1000 мг/сут., антикоагулянтная терапия: Фраксипарин – 0,6 мл, симптоматическая терапия.
Данные на 1-е сутки: температура тела – 38,5°С; лабораторные данные: лейкоциты крови – 16,8х109/л; гемоглобин – 107 г/л; СРБ – 98,3 мг/л; креатинин – 121 мкмоль/л; На 4-е сутки положительной динамики не наблюдалось, сохранялась гипертермия до 39,5°С, сохранялся лейкоцитоз, произведена смена антибактериальной терапии, согласно полученному посеву мочи: Klebsiella pneumonia – 107, резистентность к препаратам группы фторхинолонов, пенициллинов. Проводилась терапия препаратами Меропенем, Линезолид, Полимиксин В, продолжена антикоагулянтная терапия. Выполнена МРТ брюшной полости с контрастированием, выявлено увеличение размеров левой почки, структура почки диффузно неоднородная с гиподенсивными участками паренхимы, с неровными контурами, признаки субкапсулярных скоплений жидкости (рис. 7).
На 6-е сутки стационарного лечения в связи с ухудшением состояния пациентки выполнена операция люмботомия слева, ревизия левой почки. Интраоперационно определялся отек паранефральной клетчатки, в области верхнего полюса левой почки деструкция паренхимы, при вскрытии капсулы почки получено 50 мл гнойного содержимого, при дальнейшей ревизии выявлены множественные подкапсульные апостемы. Выполнена нефрэктомия слева (рис. 8).
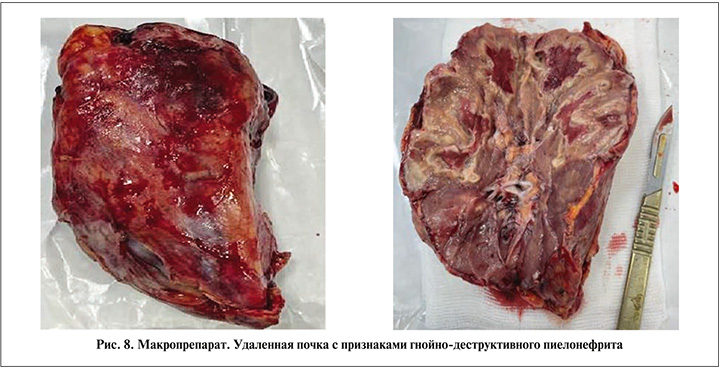
Данные лабораторных анализов на 7-е сутки (1-е сутки после нефрэктомии): температура тела – 37,1°С; лейкоциты крови – 11,4х109/л; гемоглобин – 104 г/л; СРБ – 33,1 мг/л; креатинин – 133 мкмоль/л. На 10-е сутки страховой дренаж удален. Данные лабораторных анализов на 12-е сутки (6-е сутки после нефрэктомии): температура тела – 36,8°С; лейкоциты – 10,2х109/л; гемоглобин – 101 г/л; СРБ – 21,1 мг/л; креатинин – 121 мкмоль/л. В анализе мочи 2–3 лейкоцита в п/зр. В посеве мочи роста микрофлоры нет. На 15-е сутки госпитализации пациентка выписана в удовлетворительном состоянии.
Обсуждение. На сегодняшний день актуальными в современном здравоохранении остаются вопросы лечения пациентов с ИМП, которые являются наиболее распространенными бактериальными инфекциями, на которые приходится до 35–40% всех случаев внутрибольничных инфекций [22]. В то же время важными вопросами остаются дальнейшие исследования возникновения новых штаммов, особенностей клинического течения, патогенеза и осложнений новой коронавирусной инфекции Covid-19. На март 2022 г. заболеваемость коронавирусной инфекцией превысила 460 млн, летальность составляла 2% [6].
У пациентов после перенесенной новой коронавирусной инфекции в ряде случаев нетипично протекали различные заболевания. Например, мужчины, перенесшие Covid-19, имели меньшие значения соотношения уровня тестостерона и лютеинизирующего гормона [25]. Причиной повреждения яичек стали избыточная продукция цитокинов, тромбоз микрососудов и ишемия паренхимы яичек [26]. Некоторые мужчины, переболевшие Covid-19 в тяжелой форме, предъявляли жалобы на ослабление эрекции и нарушение семяизвержения, которые могли появиться из-за снижения выработки тестостерона, тестикулярной недостаточности, а также прогрессирующей эндотелиальной дисфункции [27].
Основными мишенями Covid-19 являются дыхательная, свертывающая система крови и иммунная система. На сегодняшний день известно несколько механизмов патогенеза Covid-19, одним из которых является проникновение вируса в клетку органа-мишени благодаря связыванию вируса с ферментом АПФ2. Дополнительным фактором риска, осложняющим течение новой коронавирусной инфекции, является прогрессирующая антибактериальная резистентность в связи с возросшим приемом антибактериальных препаратов в период пандемии. По данным Т. С. Перепановой, летальность от различных инфекций, вызванных резистентными штаммами микроорганизмов, составляет 42–43% [24]. Автор предлагает применение ингибиторозащищенных бета-лактамов или карбапенемов, что может приводить к снижению частоты выработки бета-лактамазы расширенного спектра (БЛРС) [24]. Среди факторов риска возникновения полирезистентных возбудителей названы неадекватный инфекционный контроль, инвазивные манипуляции, длительное пребывание пациентов в стационаре, госпитализация в предшествовавшие 3–6 мес., антибактериальная терапия в предшествовавшие 2 мес. [24].
По данным исследования М. И. Катибова и соавт., 2022 г., в эпоху пандемии выявлены увеличение частоты гнойно-воспалительных заболеваний почек с 2 (0,3%) до 5 (4,4%) [23].
Целью настоящего исследования явилось изучение частоты и вероятных причин возникновения гнойно-деструктивных форм острого пиелонефрита у пациентов, перенесших новую коронавирусную инфекцию. В данное исследование включены 403 пациента с диагнозом «острый необструктивный пиелонефрит». Двести семьдесят шесть пациентов наблюдались в группе доковидного периода (2018–2019), среди них гнойно-деструктивные изменения диагностированы у 14 (5%) больных, 3 (1,1%) пациентам проведено дренирование гнойных очагов паренхимы почки под УЗИ и МСКТ-наведением. Из 127 пациентов постковидного периода (2020–2021) гнойно-деструктивные изменения наблюдались у 22 (17%) больных, оперативное лечение под УЗИ и МСКТ-контролем выполнено 6 (4,7%) пациентам.
Наиболее частыми возбудителями ИМП в 2020–2021 гг. оказались Escherichia coli (69%), Enterococcus faecalis (10%), Klebsiella pneumoniae (4%), Pseudomonas aeruginosa (4%), Proteus mirabilis (4%) и Staphylococcus aureus (2%) [5]. По данным исследования, в период с 2018 по 2021 г. встречаемость Escherichia coli увеличилась на 5,2%, в то же время наблюдалась прогрессирующая резистентность к препаратам группы фторхинолонов. Встречаемость Enterococcus faecalis увеличилась на 2,8%, при этом резистентность к препаратам группы фторхинолонов снизилась. Встречаемость Klebsiella pneumoniae возросла на 9,8%, при этом наблюдалось повышение резистентности к препаратам группы фторхинолонов. Также отмечено повышение встречаемости Proteus mirabilis и Staphylococcus haemolyticus на 0,1% с повышением резистентности к препаратам группы фторхинолонов, встречаемость Acinetobacter baumannii увеличилась на 2,1%.
Таким образом, возрастающая антибиотикорезистентность, появление панрезистентных штаммов, выявленных за период пандемии в связи с нерациональным приемом антибактериальных препаратов, диктуют использование антибактериальных препаратов группы резерва для лечения пациентов с гнойно-деструктивными формами пиелонефрита на этапе эмпирической терапии.
Заключение. У пациентов с острым необструктивным пиелонефритом без урологического анамнеза, перенесших новую коронавирусную инфекцию, отмечен рост гнойно-деструктивным форм. Причинами их возникновения, по нашему мнению, являются увеличение числа резистентных бактериальных штаммов к наиболее часто применяемым группам антибактериальных препаратов, как оригинальных, так и генериков, нарушение принципов рациональной антибиотикотерапии, появление зон ишемии почечной паренхимы как результат нарушения микроциркуляции и повышенного тромбообразования, снижение активности гуморальных факторов иммунитета. Увеличение количества панрезистентных штаммов диктует необходимость применения данной когортой пациентов антибактериальных препаратов группы резерва на этапе эмпирической терапии. Назначение антикоагулянтов пациентам с острым пиелонефритом с целью улучшения микроциркуляции, профилактики тромбообразования является патогенетически обоснованным.



