Введение. Гиперактивный мочевой пузырь (ГМП) – это широко распространенный симптомокомплекс (наблюдается у 16–19% взрослого населения) [1, 2], ключевой критерий которого – наличие ургентных позывов к мочеиспусканию, которые могут сопровождаться другими проявлениями – ургентным недержанием мочи, учащенным мочеиспусканием и ноктурией, в отсутствие доказанной инфекции нижних мочевыводящих путей (НМП) или других очевидных заболеваний НМП [3, 4].
Традиционно считалось, что ГМП — это проявление патологической сократительной активности детрузора. Однако, как показали исследования, у 30–46% пациентов с ГМП может развиваться характерная симптоматика ургентного учащенного мочеиспускания и без детрузорной гиперактивности, когда, по данным цистометрии наполнения, непроизвольные сокращения детрузора отсутствуют [5–7]. То есть в основе симптомов ГМП могут лежать различные патогенетические механизмы.
Приблизительно 20–30% случаев ГМП имеют нейрогенную природу – развивается в результате нарушений со стороны центральной и/или периферической нервной систем и может представлять собой симптом выявленного неврологического заболевания (например, при болезни Паркинсона, рассеянном склерозе, дисциркуляторной энцефалопатии, травмах и других заболеваниях спинного и головного мозга – так называемый незаторможенный нейрогенный мочевой пузырь) [7–9].
Более неоднозначным представляется этиопатогенез ненейрогенного ГМП. Уротелиальная теория связывает развитие аномальных сокращений детрузора с повышением чувствительности уротелия (например, при хроническом воспалении) и нарушением его взаимодействия с миоцитами и центральной нервной системой (ЦНС). Молекулярные механизмы такого взаимодействия во многом обеспечиваются сигнальными факторами (АТФ, NO), ко-медиаторами – пептидами и белками, синтезируемыми клетками уротелия и субуротелиального пространства (интерстициальными клетками, миофибробластами) [10].
Согласно миогенной теории (А. Elbadawi et al., 1993), ненейрогенный ГМП может возникать из-за развития не типичных для детрузора межклеточных соединений, обладающих большей проводимостью и приводящих к чрезмерному распространению локальных сокращений. Причем наблюдаемые изменения миоцитов не относились к дегенеративным, являлись нестойкими [11], а надлежащая среда (in vitro и in vivo), по словам авторов, побуждала клетки гладкой мускулатуры быстро восстанавливать специализированные соединения и устранять атипичные, приводя к восстановлению функции [11–14].
Подобной регулирующей средой мочевого пузыря, способной обеспечивать адекватную структуру тканей, поддерживать нормальное межклеточное внутритканевое (в т.ч. между клетками детрузора) и межтканевое взаимодействие (между уротелием, нейронами и миоцитами), является протеом и пептидом (совокупность белков и пептидов, производимых за определенный период времени) уротелия и субуротелиального пространства [15].
В составе протеома уротелия обнаружено 52 белка и пептида, регулирующих активность сигнальных молекул мочевого пузыря (АТФ, NO, ацетилхолина и др.) и тем самым участвующих в нейрональном контроле, 17 протеинов, влияющих на образование эпителиальной ткани и воспалительный ответ, а также как минимум три белка (CR1L, HTT, INHA), оказывающих прямое воздействие на сократительную активность миоцитов детрузора [15].
Состав протеома органа в норме стабилен и сходен у различных особей, его изменение коррелирует с нарушением регуляторного гомеостаза и развитием дисфункциональных расстройств. Действительно, выявлены значительные различия в составе протеома в здоровом мочевом пузыре и при ГМП: биосинтез почти 40% белков (201 из 507), выраженный в норме, был подавлен при ГМП, а 19,5% (74 из 380) белков встречались исключительно при ГМП, но не в здоровом состоянии. Особенно заметной была разница в уровне транскрипции белков, контролирующих активность сигнальных молекул [15].
Таким образом, актуален поиск этиопатогенетической терапии ГМП, способной регулировать состав протеома, активность сигнальных факторов и нарушенное межклеточное взаимодействие, тем самым возвращая здоровое функционирование органа независимо от причины, вызвавшей дисбаланс [19]. Перспективной в этом ключе представляется разработка лекарственных препаратов на основе органоспецифических регуляторных пептидов, модулирующих экспрессию генов и белков, т.е. способных восстанавливать синтезирующую активность уротелия и состав протеома, измененный вследствие патологического состояния, восстанавливающих нормальную структуру и взаимодействие гладкомышечных клеток. Другим важным аспектом является способность регуляторных пептидов мочевого пузыря модулировать нервно-мышечный сигнал, выступая в качестве ко-медиаторов, выделяющихся из нервных окончаний вместе с классическими медиаторами, с наличием специфических рецепторов к ним на мембране клетки [20–23].
Везустен® представляет собой лекарственный препарат, состоящий из комплекса регуляторных пептидов с молекулярной массой не более 10кДа, выделенных из мочевого пузыря бычков.
Препарат прошел полный комплекс доклинических исследований, подтвердивших тканеспецифическую активность – стимулирующее воздействие на рост клеток мочевого пузыря без влияния на культуры тканей других органов, в отсутствие токсического, местно-раздражающего эффектов, аллергенности, иммуногенности и мутагенности [24–34].
Применение препарата при ГМП в дозировке, соответствующей человеческой терапевтической (с использованием коэффициента пересчета доз на модели обструкции мочевого пузыря крыс) нормализовало сократительную активность детрузора. По окончании курса терапии показатели функциональной активности мочевого пузыря (масса, объем мочевого пузыря и их соотношение, количество остаточной мочи) достоверно не отличались от таковых интактных животных и были в 3,3–4,5 раза меньше показателей контрольной группы, при этом количество остаточной мочи не превышало 11% (по сравнению с 64,6 % в контрольной группе) [35].
Клинические исследования доказали, что исследуемый препарат, обладая благоприятным профилем безопасности и переносимости (результаты 1-й фазы КИ с участием здоровых добровольцев и 2-й фазы с участием пациентов с ГМП), уменьшает количество эпизодов недержания мочи, частоту и ургентность мочеиспусканий, а также оказывает положительное влияние на качество жизни пациентов с ГМП, что позволило получить разрешение на проведение регистрационных клинических исследований 3-й фазы лекарственного препарата [36].
Материалы и методы. Представленное многоцентровое двойное слепое рандомизированное плацебо-контролируемое сравнительное исследование в параллельных группах относится к III фазе клинических испытаний, проводилось согласно Протоколу и Правилам GCP (good clinical practice – надлежащая клиническая практика).
Исследование состояло из трех этапов:
- Период скрининга продолжительностью 14 дней.
- Период оценки эффективности терапии – 42 дня от начала терапии (21 день – период терапии+дальнейшее наблюдение после окончания терапии).
- Период наблюдения – 28 дней±2 дня от завершения Визита 3.
Cкрининг включал клинический и биохимический анализы крови, общий анализ мочи, электрокардиограмму (ЭКГ), ультразвуковое исследование (УЗИ) органов малого таза, анализ мочи на беременность, бактериологическое исследование мочи с антибиотикограммой, серологические исследования (HbsAg, Anti-HCV, ВИЧ), оценку степени тяжести симптомов ургентности по шкале PPIUS (Perception Of Intensity Of Urgency Scale – Восприятие пациентом интенсивности ургентности, см. таблицу), оценку выраженности недержания мочи по основному и дополнительному опросникам OAB-q и подсчет TUFS (Total Urgency and Frequency Score – общий суммарный балл частоты и ургентности мочеиспусканий, представляет собой сумму оценок по шкале PPIUS для всех эпизодов мочеиспусканий за сутки). В качестве исходного уровня PPIUS принимали среднюю оценку в сутки по дневнику мочеиспускания за последние 3 дня, предшествовавшие визиту рандомизации.

В исследование были включены пациенты: мужчины и женщины в возрасте от 18 до 70 лет с верифицированным диагнозом ГМП (учащенное мочеиспускание, ургентные позывы с/или без ургентного недержания мочи) в течение 3 мес. и более, с наличием не менее 3 ургентных позывов на мочеиспускание в течение последних 3 дней и не менее 7 мочеиспусканий в среднем за сутки.
К критериям невключения относились отягощенный аллергологический анамнез; гиперчувствительность к любому из компонентов, входящих в состав препарата Везустен®; хроническая сердечная недостаточность II–IV функциональных классов по классификации NYHA (New York Heart Association – Нью-Йоркской ассоциации кардиологов); ишемическая болезнь сердца; заболевания артерий и/или сосудов головного мозга; клинически значимая обструкция мочевыводящих путей; объем остаточной мочи более 200 мл; смешанное недержание мочи с преобладанием стрессового компонента; инфекции мочевыводящих путей; интерстициальный цистит; камни мочевого пузыря; предшествующая лучевая терапия органов малого таза; немедикаментозное лечение ГМП, включая тренировку мочевого пузыря; диабетическая нейропатия; мегаколон; любое злокачественное новообразование органов малого таза в анамнезе; неконтролируемая инфекция вируса иммунодефицита человека (ВИЧ) и/или активный гепатит; наркотическая или алкогольная зависимость в анамнезе в течение последних 5 лет; участие в клиническом исследовании лекарственных средств менее чем за 6 мес. до начала исследования; беременность и период грудного вскармливания, а также любые сопутствовавшие соматические заболевания или состояния, которые, по мнению исследователя, затрудняли интерпретацию результатов лечения или приводили к невозможности проведения процедур.
Пациенты, удовлетворявшие критериям включения/ невключения, были рандомизированы в соотношении 1:1 в 2 группы (основная – «Везустен®» и контрольная – «Плацебо») по 75 пациентов, суммарно 150 пациентов. Препараты (Везустен®, 5 мг либо плацебо) вводились внутримышечно 3 раза в неделю, каждому пациенту было введено по 10 доз препарата/плацебо.
На рис. 1 схематично представлен дизайн данного исследования.
На Визите 2 (21 сут. от начала исследования, завершение терапии) и Визите 3 («Визит финальной оценки эффективности терапии» на 42-е сутки от начала исследования, через 3 нед. после завершения 3-недельного курса терапии) проводились физикальный осмотр с оценкой АД, ЧСС, температуры тела, ЭКГ, клинические анализы крови, мочи, биохимический анализ крови, оценка нежелательных явлений (НЯ) и сопутствовавшей терапии, а также оценка симптоматики по шкалам PPIUS, TUFS, основному и дополнительному опросникам OAB-q. Дневник мочеиспусканий заполнялся пациентами в течение 3 дней, предшествовавших планируемому визиту; для оценки TUFS подсчитывали среднее значение за 3 дня до визита.
Между Визитами 2 и 3 врач-исследователь еженедельно проводил телефонные опросы для регистрации возможных НЯ.
Визит 4 (завершающий) проводился в формате телефонного опроса для контроля состояния пациента и регистрации возможных НЯ на 70-й (±2) день от начала исследования (через 48–52 дня после завершения терапии).
В качестве первичных критериев эффективности определяли на Визите 3:
- среднее изменение степени тяжести симптомов ГМП по шкале TUFS по сравнению с исходным уровнем;
- долю пациентов, у которых наблюдалось ≥50% уменьшение количества эпизодов недержания мочи (3+4-я степени выраженности позывов по шкале PPIUS) в сутки по сравнению с исходным уровнем.
В качестве вторичных критериев эффективности оценивались на визитах 2 и 3: средние изменения оценок TUFS; PPIUS; баллы по основному и дополнительному опросникам OAB-q, количество мочеиспусканий по сравнению с исходным уровнем.
Анализ безопасности проводили на основании данных о регистрации НЯ и СНЯ, результатов лабораторных анализов и инструментальных методов исследования (ЭКГ), данных физикального осмотра и оценки изменений жизненноважных показателей (АД, ЧСС, ЧД, температура тела).
Статистический анализ. Статистический анализ проводился с использованием программного комплекса NCSS 11.0.
Для анализа первичных критериев оценки эффективности проведен расчет 95% доверительного интервала для разности средних и долей в группах, для расчета границы превосходящей эффективности.
Вторичные показатели эффективности анализировали с использованием методов параметрической и/или непараметрической статистики в зависимости от результатов оценки нормальности распределения выборки.
Уровень значимости для одностороннего критерия оценки эффективности был выбран равным 0,025 (2,5%), мощность критерия – 0,8 (80%).
Результаты. Установлена клиническая эффективность препарата в отношении выраженности симптоматики ГМП и качества жизни пациентов.
Оценивалось среднее изменение тяжести симптомов ГМП по шкале TUFS на Визите 3 по сравнению с исходным уровнем. По результатам дисперсионного анализа повторных измерений показателя TUFS были выявлены статистически значимые внутригрупповые различия как в группе препарата Везустен, так и в группе плацебо, сумма баллов по TUFS статистически значимо снижалась к Визиту 3 (через 3 нед. после отмены терапии) в обеих группах. При этом среднее снижение суммы баллов в группе Везустен® было в 1,97 раза значительнее, чем среднее снижение суммы баллов в группе плацебо (среднее снижение суммы баллов в группе Везустен® – 10,02±9,19 балла, в группе Плацебо – 5,09±6,43), различия между группами статистически значимы (p=0,0007), рис. 2.

При расчете превосходящей эффективности данные, полученные на ограниченном количестве пациентов взятых выборок, проецируются на всю популяцию пациентов. Было продемонстрировано, что с вероятностью 95% истинная разница между эффектами группы Плацебо и группы Везустена® лежит в диапазоне от 2,369 до 7,489 балла. С высокой степенью достоверности (p=0.022) нижняя граница превосходящей эффективности составляла более 2,3 балла (Two Proportions – Superiority Tests Report – наличие суммарного терапевтического ответа, μ1–μ2 >2,3).
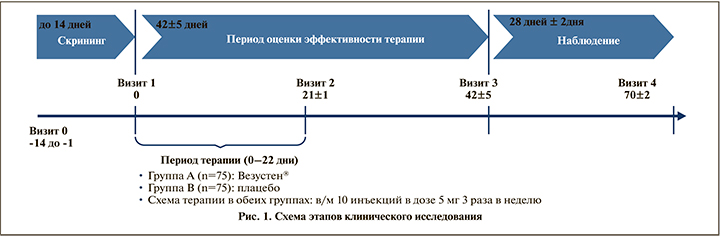
Дополнительно была проведена оценка количества пациентов с выраженным улучшением в виде снижения симптоматики по TUFS (более чем на 20%) на визитах 2 и 3 по сравнению с исходным уровнем. В группе Везустен® на Визите 2 (сразу после окончания курса терапии) такие пациенты составили 54,05% пациентов, на Визите 3 (через 3 нед. после окончания курса) отмечалось дальнейшее снижение симптоматики, и пациенты с выраженным улучшением составили 66,67% (р<0,05, в то время как в группе плацебо лишь 27,02 и 38,73% соответственно (рис. 3), т.е. отмечалось нарастание эффекта препарата.
Были выявлены статистически значимые различия между группами по доле пациентов, у которых на Визите 3 наблюдалось ≥50% уменьшение суточного количества эпизодов недержания мочи по сравнению с исходным уровнем: на фоне терапии препаратом Везустен® такие пациенты составили 65,33%, в группе Плацебо – 41,33%. Определена нижняя граница 95% доверительного интервала для разности долей – 0,085, установлена граница превосходящей эффективности 8% (p=0,0244). При проведении точечной оценки на Визите 3 разность долей составила 24% (рис. 4).
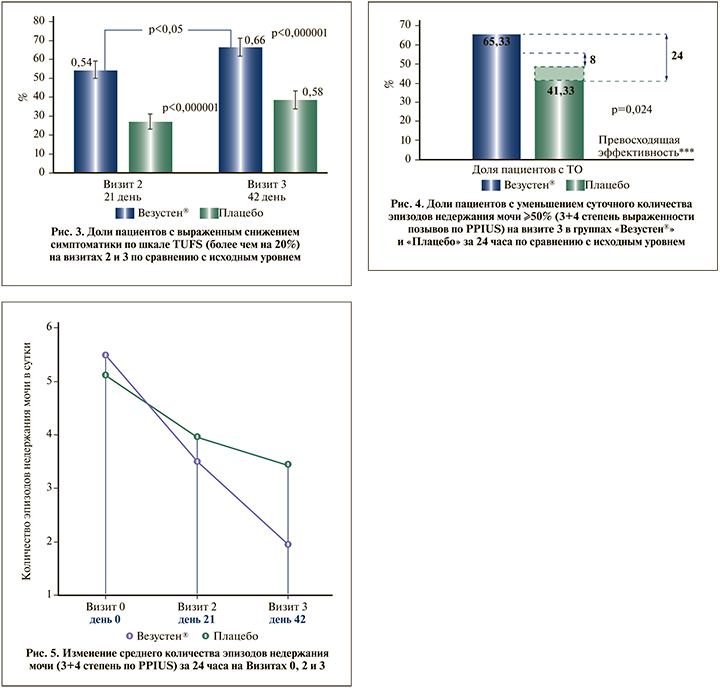
Дополнительно оценивалось изменение среднего количества эпизодов недержания мочи (3+4-я степени выраженности позывов по PPIUS) за 24 ч на Визитах 0, 2 и 3.
По результатам дисперсионного анализа повторных измерений среднего количества эпизодов недержания мочи (3+4-я степени выраженности позывов по PPIUS) были выявлены статистически значимые внутригрупповые различия как в группе Везустен®, так и в группе Плацебо на Визите 3 по сравнению с исходными данными. В группе Везустен®, в отличие от группы Плацебо, по данному показателю отмечалось статистически достоверное нарастание эффекта препарата после окончания курса терапии (от Визита 2 к Визиту 3, р<0,05), рис. 4.
Среднее снижение количества эпизодов недержания мочи в группе Везустен® превосходило среднее снижение количества эпизодов недержания мочи в группе Плацебо на Визите 3 более чем в 2 раза: на фоне терапии Везустен® на 3,57 эпизода в сутки (с 5,5 до 1,9 эпизода в сутки), или 65,45%, а в группе Плацебо – на 1,66 эпизода в сутки (с 5,1 до 3,4 эпизода в сутки), или на 33,33% (рис. 5).
В результате проведенных межгрупповых сравнений показателей на визитах 2 и 3 по сравнению с исходным уровнем были выявлены статистически значимые различия между группами пациентов, получавших препараты Везустен® и плацебо, по среднему изменению следующих показателей: количеству эпизодов недержания мочи (p=0,0108 для ∆=Скрининг-Визит 2; p=0,001 для ∆=Скрининг-Визит 3), количеству мочеиспусканий в сутки (p=0,0229; p=0,0021), а также степени тяжести симптомов ГМП по шкале TUFS на Визите 2 (p=0,0092), свидетельствующие о более выраженных эффектах препарата Везустен®.
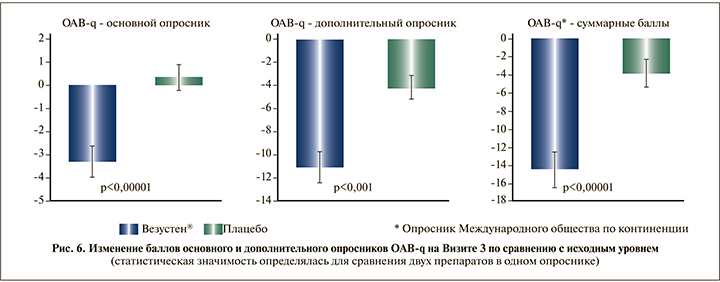
Выявлено статистически значимое снижение степени беспокойства пациентов вследствие симптомов ГМП на фоне терапии Везустен® по результатам среднего изменения баллов основного и дополнительного опросников OAB-q на Визите 3 по сравнению с исходным уровнем (p=0,0032 и p=0,0002 соответственно, рис. 6).
НЯ были выявлены у 72 пациентов (у 32 в группе приема препарата Везустен® и у 40 в группе Плацебо). При оценке числа пациентов, у которых были зарегистрированы НЯ, статистически значимых различий между группами выявлено не было (p=0,253).
Наиболее часто встречающимися НЯ были клинически незначимые отклонения лабораторных показателей (клинического и биохимического анализов крови, общего анализа мочи). По мнению исследователей, эти отклонения не имеют связи или имеют сомнительную связь с применением препаратов.
За время проведения исследования зарегистрировано 13 НЯ в месте инъекции: 6 НЯ – в группе Везустен® и 7 НЯ – в группе плацебо, все НЯ были легкой степени тяжести (болезненность в месте введения препарата), не потребовали дополнительных действий от персонала и разрешились самостоятельно.
Таким образом, было сделано заключение о благоприятном профиле безопасности исследуемого препарата Везустен®.
Обсуждение. Было установлено, что лекарственный препарат на основе регуляторных пептидов Везустен® при курсовом применении (в дозировке 5 мг 3 раза в неделю, курс 10 инъекций) обладает клинической эффективностью, снижая степень тяжести симптоматики ГМП и количество суточных эпизодов недержания мочи. Несмотря на выявление существенного эффекта плацебо в ходе проведенного исследования, Везустен® оказывал значительно более выраженное (превосходящее плацебо) действие.
Как отмечалось выше, регуляция функции мочевого пузыря – сложный и комплексный процесс. В нем участвуют и холинергические, и адренергические, и пептидные пути, а также сложные пептидомы [15, 18, 37–40]. В частности, в нижних отделах мочевыделительной системы в норме присутствуют различные регуляторные пептиды, такие как нейрокинин А, брадикинин, пептид, связанный с геном кальцитонина, аденилатциклазоактивирующий полипептид [18], эндотелины [37], вазоактивный интестинальный пептид, который в экспериментах ингибирует фоновую сократительную активность детрузора [38], соматостатин, участвующий в регулировании как наполнения мочевого пузыря, так и его опорожнения [39], эндогенные опиаты, оказывающие на мочеиспускание ингибирующее действие [40]. Все эти пептиды в дополнение к классическим путям создают регуляторную матрицу управления.
Конечно, такой сложный процесс регуляции требует скоординированного действия нескольких систем: передачи сигнала из центральной нервной системы и обратно по афферентным путям, передачи сигнала на локальном уровне (внутристеночные нервные ганглии, передача от нервного окончания на гладкомышечные волокна) и паракринной регуляции. При нарушении этой координации на фоне ГМП воздействие только на один компонент этой системы регуляции не дает стойкого эффекта. Поэтому Везустен как комплексный органоспецифический пептидный препарат оптимален для одновременного воздействия на разные мишени независимо от этиопатогенетических механизмов, явившихся «спусковым крючком» для развития характерной симптоматики у конкретного пациента [40].
С учетом того факта, что эффект Везустена не только не прекращается после окончания курса терапии (Визит 2, точка завершения трехнедельного курса терапии), но и продолжает нарастать к Визиту 3 (через 3 нед. после окончания введения препарата), можно говорить о возможном запуске характерного для пептидов каскада регуляторных процессов, которые включают активацию сигнальных путей, запуск экспрессии генов, необходимых для восстановления нормального протеома, структуры и функции клеток, регуляцию передачи нервно-мышечного сигнала (в качестве важных ко-медиаторов) и паракринную регуляцию органа. Необходимо также подчеркнуть, что нарастание эффекта препарата Везустен наблюдалось спустя 3 нед. после окончания курса, т.е. тогда, когда существование первично введенного пептидного биорегулятора уже исключено в связи с быстрым метаболизмом пептидов [20–23]. Наблюдаемый патогенетический эффект препарата Везустен® может свидетельствовать о выраженной стойкой оптимизации функционального взаимодействия клеток уротелия, субуротелиального пространства, миоцитов детрузора и нейронов, имеющей решающее значение в ощущении наполнения мочевого пузыря, а также в осуществлении контроля над сократительной активностью детрузора.
Хорошая переносимость курса лечения и низкое число НЯ, продемонстрированные в данном исследовании, подтверждают высокий профиль безопасности исследуемого препарата.
Заключение. По результатам рандомизированного двойного слепого плацебо-контролируемого проспективного многоцентрового клинического исследования эффективности и безопасности, курсовое применение лекарственного препарата Везустен®, лиофилизат для приготовления раствора для внутримышечного введения в дозировке 5 мг в течение 3 нед. (суммарно 10 инъекций) улучшает состояние пациентов с ГМП: уменьшает число эпизодов ургентного недержания мочи, частоту и ургентность позывов к мочеиспусканию, а также оказывает положительное влияние на качество жизни пациентов. Выявлен эффект последействия Везустена® с продолжающимся нарастанием эффективности в отношении симптоматики ГМП через 3 нед. после окончания курса терапии.
Выраженный ответ на терапию Везустеном® отмечен более чем у 60% пациентов:
- У 66,67% пациентов отмечалось снижение симптоматики по шкале суммарной оценки частоты и ургентности мочеиспусканий (TUFS) более чем на 20%, среднее снижение суммы баллов превосходило показатели группы плацебо в 1,97 раза.
- У 65,33% пациентов наблюдалось снижение суточного числа эпизодов ургентного недержания мочи на 50% и более по сравнению с исходным уровнем (при проведении точечной оценки разность долей с группой плацебо составила 24%), среднее снижение числа эпизодов недержания мочи превосходило показатели группы плацебо в 2,15 раза.
Везустен® имеет благоприятный профиль безопасности, статистически значимых различий между группами Везустен® и Плацебо в отношении показателей безопасности, оцениваемых в исследовании, выявлено не было.



