Введение. Интерстициальный цистит/синдром болезненного мочевого пузыря (ИЦ/СБМП) считается серьезной проблемой, в значительной степени влияющей на качество повседневной жизни пациентов. Этим заболеванием страдают тысячи людей в мире, особенно женщины. Оно характеризуется болью, ощущением давления, дискомфортом в области таза в отсутствие инфекции мочевыводящих путей и другой патологии (инфекций, передающихся половым путем, эндометриоза, простатита) [1, 2].
Для объяснения этиологии ИЦ/СБМП предложено множество теорий, в которых многочисленные факторы оказывают непосредственное влияние на характеристики симптомов, течение заболевания и различные реакции на терапию. Многие причинные факторы этого заболевания подтверждены, однако современное понимание причинно-следственной связи все еще предполагает поражение уротелия токсичными веществами, аллергенами или бактериями из мочи. Это может быть основным моментом в развитии воспалительного процесса в более глубоком слое стенки мочевого пузыря [3–5]. Для прояснения механизмов, лежащих в основе этого заболевания, необходимы дальнейшие исследования.
В последние годы все больший интерес проявляют к использованию в диагностике ИЦ/СБМП биомаркеров, одним из которых является фактор роста нервов (ФРН). Установлено, что он отвечает за рост и поддержание сенсорных нейронов и, по-видимому, играет роль в нейроиммунных взаимодействиях, в воспалении тканей [6, 7]. Кроме этого считается, что ключевую патофизиологическую роль в инициации и развитии воспаления играют тучные клетки, секретирующие, в частности, ФРН, который вызывает невропатическую боль – одну из характеристик ИЦ/СБМП [8, 9].
Цель исследования: оценить содержание ФРН в крови и моче и инфильтрацию тучными клетками стенки мочевого пузыря в модели ИЦ/СБМП, проанализировать взаимосвязь между ними.
Материалы и методы. Для создания экспериментальной модели ИЦ/СБМП использовано 38 белых новозеландских кроликов-самцов массой 1500–2000 г. При работе с животными придерживались правил по уходу и использованию лабораторных животных (NIH Guide for the Care and Use of Laboratory Animals) [10]. ИЦ/СБМП моделировали путем введения в мочевой пузырь различных раздражителей: 70%-ный спирт (1-я группа, n=8), который вводили в полость мочевого пузыря; мочу, взятую из мочевого пузыря животного (2-я группа, n=15), которую вводили в стенку мочевого пузыря [11]; 0,9%-ный раствор NaCl (3-я группа, n=7), также вводимый в стенку мочевого пузыря. Четвертую, контрольную, группу составили восемь интактных животных.
Фактор роста нервов определяли твердофазным иммуноферментным методом (ELISA) с помощью набора NGF Emax® в крови и моче на аппарате Medispec 6000M (Израиль). Измерения проводили через 1 и 14 дней после моделирования ИЦ/СБМП.
Через 14 дней после начала эксперимента животных умерщвляли пентобарбиталом в дозе 200 мг/кг. Из трансабдоминального разреза по средней линии выполняли цистэктомию. Образцы ткани мочевого пузыря заключали в парафин; с помощью микротома готовили срезы толщиной 4 мкм. Затем образцы окрашивали толуидиновым синим для выявления тучных клеток. Микропрепараты изучали с помощью светового микроскопа OlympusBx-50 и системы камер Olympus PM10SP. Каждое поперечное сечение было разделено на 10 участков. Выраженность инфильтрации тучными клетками оценивали в каждом из этих участков, использовав следующую шкалу: 0 – нет тучных клеток; 1 – менее 20 клеток; 2 – 20–45 клеток; 3 – более 45 клеток. Баллы всех 10 срезов складывали, делили на 30 (максимально возможный балл) и умножали на 100. Баллы по тучным клеткам для каждого мочевого пузыря являлись средними трех исследованных сечений. Подсчет проводили при оптическом увеличении 200 [12, 13].
Статистическую обработку данных проводили с помощью программ StatisticaforWindows 8.0 и MicrosoftExcel. Рассчитывали среднее значение (average), стандартное отклонение среднего (Standard Deviation). Корреляционную зависимость показателей рассчитывали по коэффициенту корреляции Пирсона. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение. Анализ концентрации ФРН в первый день исследования выявил статистически значимое повышение уровня биомаркера в крови во всех группах по сравнению с контрольной (рис. 1, а). В 1-й группе уровень ФРН превышал контрольный на 46,02% (р<0,05), во 2-й – на 71,3% (р<0,01), в 3-й – на 43,9% (р<0,05). Через 14 сут. превышение содержания ФРН контрольных показателей составило 64,96% (р<0,01), 90,1% (р<0,001) и 26,6% в 1-й, 2 и 3-й группах соответственно. В моче животных также отмечен высокий уровень ФРН (рис. 1, б). Через сутки после начала эксперимента у животных 1-й группы по сравнению с интактными животными концентрация ФРН практически не различалась, а спустя 14 сут. содержание биомаркера в моче было выше на 9,3%. Во 2-й группе уровень ФРН в моче в 1-е и 14-е сутки превышал контрольный на 68,25% (р<0,01) и 85,0% (р<0,001) соответственно, в 3-й – на 27,44% (р<0,05) и 5,3% соответственно.
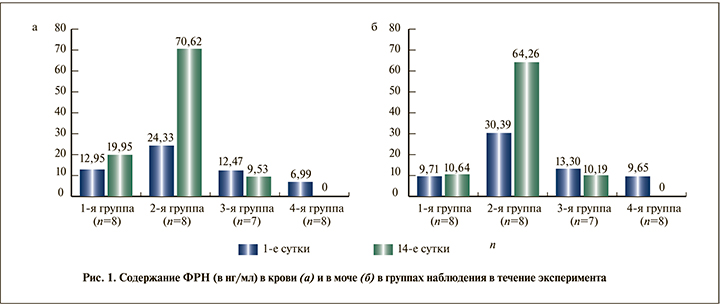
Анализ содержания ФРН за весь период наблюдения внутри каждой группы выявил, что в 1-й группе содержание биомаркера в крови повысилось на 35,1% (р<0,05), в моче – на 8,74%; во 2-й группе – на 65,5% (р<0,01) и 52,7% (р<0,01) соответственно. У животных 3-й группы уровень ФРН, напротив, снизился на 30,8 (р<0,05) и 30,5% (р<0,05) соответственно в крови и моче.
Определение корреляции между содержанием ФРН в крови и моче в 1-й группе показало наличие прямой слабой взаимосвязи (r=+0,163; р=0,50) в начале эксперимента, которая через 14 дней сильно ослабла и стала обратной (r=-0,088; р=0,50). Во 2-й группе коэффициент корреляции на разных сроках наблюдения практически не различался, составив 0,215 (р=0,50) и 0,216 (р=0,50) соответственно. В 3-й группе через день после моделирования показатели ФРН в крови и моче положительно коррелировали между собой (r=0,691; р=0,48), однако по прошествии 14 дней взаимосвязь значительно снизилась и стала обратной (r=-0,330, р=0,53). В группе интактных кроликов коэффициент корреляции уровня ФРН в крови и моче составил 0,199 (p=0,50, прямая слабая связь).
 Анализ наличия и распределения тучных клеток в образцах тканях животных групп исследования показал, что эти клетки определялись лишь в 1-й (0,25±0,707) и 2-й (14,200±5,796) группах, причем в 1-й группе тучные клетки выявлены лишь в одном образце (от 0 до 2 в поле зрения), тогда как во 2-й – во всех 15 образцах (от 3 до 26 в поле зрения; рис. 2).
Анализ наличия и распределения тучных клеток в образцах тканях животных групп исследования показал, что эти клетки определялись лишь в 1-й (0,25±0,707) и 2-й (14,200±5,796) группах, причем в 1-й группе тучные клетки выявлены лишь в одном образце (от 0 до 2 в поле зрения), тогда как во 2-й – во всех 15 образцах (от 3 до 26 в поле зрения; рис. 2).
Проведенный корреляционный анализ уровня ФРН в 1-й группе в крови и моче с присутствием тучных клеток показал наличие прямой слабой связи: r=0,102 (р=0,52) и r=0,142 (р=0,50) соответственно. Во 2-й группе уровень ФРН в крови и моче коррелировал с наличием тучных клеток отрицательной умеренной связью: r=-0,260 (р=0,50) и r=-0,178 (р=0,50) соответственно.
Обсуждение. Результаты проведенного исследования позволили выявить повышение концентрации ФРН в крови во всех вариантах модели ИЦ/СБМП с первого дня. Увеличение уровня биомаркера было особенно выраженным в модели с введением мочи в стенку мочевого пузыря. Наши результаты согласуются с данными других исследований [2, 14]. Ряд исследователей выявили высокий уровень ФРН в тканях мочевого пузыря в моделях ИЦ у грызунов [15, 16].
В нашей работе повышенное содержание ФРН в крови и моче обнаружено в различных моделях ИЦ/СБМП, но статистически значимо более высоким этот показатель был при токсическом варианте с введением мочи в стенку мочевого пузыря.
Установлено, что ФРН воздействует на афферентные волокна мочевого пузыря и отвечает за рост и поддержание сенсорных нейронов, за функцию висцеральных сенсорных и моторных нейронов у взрослых [17]. В некоторых исследованиях сообщается, что воспаление вызывает нейропластичность, которая приводит к повышению уровня ФРН в мочевом пузыре и генерирует ИЦ/СБМП [18, 19].
В нашей работе инфильтрация тучных клеток определялась в двух моделях. При этом у животных с моделью мочевой токсичности активность тучных клеток статистически значимо превосходила таковую в модели введения 70%-ного спирта (р<0,001).
Тучные клетки в настоящее время признаны регуляторными и эффекторными клетками как врожденного, так и адаптивного иммунитета [20]. Они способны реагировать на самые разнообразные стимулы и секретировать биологически активные продукты с провоспалительными, противовоспалительными и/или иммунодепрессивными свойствами. Как врожденные иммунные защитники тучные клетки распознают микробные агенты (бактериальные, вирусные, паразитарные и грибковые) и эндогенные факторы, возникающие в результате повреждения клеток [20]. Возможно, этим и объясняется отсутствие тучных клеток в тканях кроликов 3-й и 4-й групп. Тогда как во 2-й группе в ответ на сильное повреждение уроэпителия мочевого пузыря организм отреагировал выраженной инфильтрацией тучными клетками.
Заключение. Выявленные при экспериментальном моделировании ИЦ/СБМП (путем введения 70%-ного спирта в полость мочевого пузыря и мочи – в стенку пузыря) повышение уровня ФРН в моче и крови, содержания тучных клеток, а также их взаимосвязь указывают на развитие нейроиммунного воспаления при данном патологическом состоянии. С учетом участия многих факторов в патогенезе этого синдрома исследования необходимо продолжить.



