Введение: эндоскопические методы оперативного вмешательства в настоящее время являются методом выбора при лечении больных мочекаменной болезнью (МКБ). Широкое распространение данных операций повлекло за собой развитие ряда специфических осложнений, сопряженных с особенностями оперативного доступа. С целью уменьшения риска интраоперационных кровотечений отмечается тенденция к уменьшению диаметра инструментов. Однако отмечается повышение частоты инфекционных осложнений, связанных с развитием пиеловенозного рефлюкса на фоне нагнетания ирригационной жидкости в полости чашечно-лоханочной системы с недостаточно адекватным оттоком жидкости по кожуху или мочеточниковому катетеру [1, 2]. Физиологическое внутрилоханочное давление составляет 10 см вод.ст., пиеловенозный рефлюкс возникает при повышении давления выше 30–45 см вод.ст. [3]. Частота послеоперационных инфекционных осложнений, таких как острый пиелонефрит, уросепсис, достигает 25% [4, 5]. В 80% случаев возбудителем внебольничного острого пиелонефрита является Escherichia сoli (E. сoli) [6]. В последние годы отмечается прирост заболеваемости инфекцией мочевыводящих путей (ИМП). На фоне лечения антибактериальными препаратами отмечается стремительный рост резистентности микроорганизмов к большинству применяемых из них препаратов среди внутрибольничных и внебольничных штаммов [7].
Около 70–80% наблюдений осложненной ИМП связаны с предыдущими урологическими вмешательствами, такими как катетеризация верхних мочевыводящих путей, ранее выполненное оперативное лечение [8–9].
Цель исследования: изучить в условиях эксперимента выраженность патоморфологических изменений ткани мочеточника и почки на фоне пиеловенозного рефлюкса при наличии и отсутствии бактериальной флоры.
Материалы и методы. Дизайн исследования разработан в соответствии с рекомендациями ARRIVE (Animal Research: Reporting of In Vivo Experiments); описание экспериментальной части основано на чек-листе проверки качества экспериментальных исследований [10, 11]. Разработка и проведение клинической части эксперимента основаны на положениях, статьях и требованиях, отраженных в международных и отечественных документах и руководствах, согласно рекомендациям Ассоциации специалистов по работе с лабораторными животными Rus-Lasa (Russian Laboratory Animal Science Association) [12, 13].
Лабораторные животные (ЛЖ): 32 половозрелых кролика-самок породы белый великан, массой 3,1±0,3 кг и возрастом 4–5 мес. ЛЖ содержались в частном виварии, что отвечало санитарно-эпидемиологическим и гигиеническим нормам в соответствии с ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур» и ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами» [14, 15]. ЛЖ находились в отдельных клетках, со свободным доступом к пище и воде, с соблюдением режима дня и ночи 12 ч, температурой помещения 21–23°С, влажностью 75–80%. Срок адаптации кроликов перед началом исследования – 10 дней.
Перед проведением эксперимента все ЛЖ осмотрены ветеринарным врачом (ратологом) с целью выявления и исключения больных особей.
Температура тела за время адаптационного периода составляла в среднем 38,5±0,5°С. Нормальная температура тела кроликов – в пределах 38,5–39,5°С [16]. Во время проведения эксперимента ветеринарный врач присутствовал в качестве консультанта.
Экспериментальный штамм. E. сoli ATCC 25922, суточная культура, стандарт мутности Макфарланда-2 (McFarland) c последующим титрованием до получения концентрации E. сoli 1х105 КОЕ/мл.
Рандомизация. С целью исключения ошибок отбора, которые могли бы ухудшить качество эксперимента, лабораторные животные по истечении адаптационного срока были разделены на 4 группы: 1–3-я группы – экспериментальные (по 10 особей в каждой группе) и 4-я – контрольная (2 особи).
Экспериментальное моделирование. Специфическое устройство желудочно-кишечного тракта, отсутствие рвотного рефлекса у кролика исключают попадание содержимого желудочно-кишечного тракта в верхние дыхательные пути. С учетом данного факта подготовка кишечника перед операцией не проводилась. Перед проведением анестезии выполнялось взвешивание экспериментальных животных для определения точной дозировки анестезирующего препарата. Животных оперировали под наркозом, премедикация проводилась с использованием атропина сульфата в дозировке 0,05 мг внутримышечно и 1 мг/кг препарата Рометар (миорелаксант). После седации выполнялась установка внутривенного катетера 24G («желтый катетер») в ушную вену кролика и его фиксация, подготовка операционного поля (выбривание шерсти на передней поверхности брюшной полости). На операционном столе кроликов фиксировали в положении «на спине» с разведенными в стороны лапами. Далее лекарственные препараты вводились внутривенно. Общая анестезия проводилась с использованием препарата Золетил 100 (Virbac Sante Animale, Франция) в дозе 10 мг/кг. С целью поддержания адекватного уровня циркулирующей крови, стимуляции диуреза, создания дополнительных условий для рефлюкса (в первой и третьей группах) в течение операции вводился раствор NaCl 0.9%, 100 мл,+раствор фуросемида, 5 мг. Во второй группе диурез не стимулировался, с целью поддержания объема циркулирующей крови в послеоперационном периоде вводилось 50 мл NaCl 0,9%.
Интубация трахеи не выполнялась, ЛЖ дышали самостоятельно. Через верхнесрединный абдоминальный разрез длиной 5–6 см вскрывали брюшную полость. Кишечник смещали в контралатеральную сторону. Мочеточник мобилизовали с сохранением периадвентициальной ткани для адекватного его кровоснабжения. На 2–3 см дистальнее от нижнего сегмента почки мочеточник пережимался с помощью стерильного шовного материала (Поликон № 4, нить хирургическая стерильная) с целью создания условий для развития пиеловенозного рефлюкса на фоне блока мочеточника и почки. В просвет мочеточника на 1 см выше зоны пережатия с помощью инсулиновой иглы 26 G вводились: в 1-й группе – 2,0 ml NaCl 0,9%, во 2-й – E. сoli 1х105 КОЕ/мл, 1,0 мл, в 3-й группе – NaCl 0,9%, 1,0 мл+E. сoli 1х105 КОЕ/мл, 1,0 мл (рис. 1).
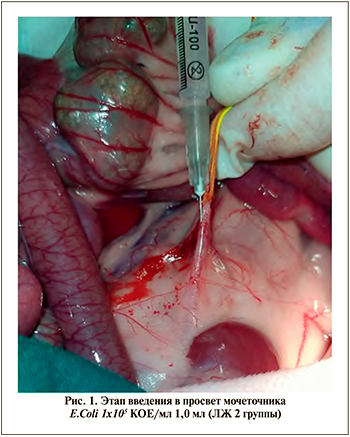
Время пережатия мочеточника в 1-й и 3-й группах составило 20 мин. Во 2-й группе мочеточник пережимался только в момент ввода бактериальной флоры в просвет мочеточника с целью заброса в чашечно-лоханочную систему. По истечении времени нить удалялась и выполнялось послойное ушивание операционной раны. Кровопотеря не более 10–15 мл.
После завершения оперативного вмешательства кроликов содержали в тех же условиях.
Забор биологического материала для гистологического исследования выполнялся для каждой из групп на 5-е сутки. Получение материала проводилось под общей анестезией препаратом Золетил 100 (Virbac Sante Animale, Франция) в дозе 50 мг/кг с последующей воздушной эмболизацией через ушную вену.
Забор почки и мочеточника до уровня нижней трети (н/3) выполнялся единым блоком. Тела кроликов утилизировались в специализированном крематории для животных. Формирование биоптатов. Все образцы тканей были фиксированы в растворе 10%-ного забуференного формалина (рН 7,2) с последующим изготовлением залитых парафином блоков и готовых микропрепаратов. Окраска гематоксилин-эозином (H&E) была выполнена для визуализации гистоархитектоники тканей, определения степени выраженности дисциркуляторных расстройств, некротических изменений и воспалительной инфильтрации. Оценивались отдельно паренхима почек, слизистая оболочки лоханок и мочеточников.
Результаты. При выполнении экспериментальной работы летальность среди лабораторных животных на этапах наркоза, оперативного вмешательства и вывода из наркоза не зафиксирована ни в одной группе. По данным морфологического исследования почек и верхней трети мочеточника, выявлены следующие изменения.
В 1-й группе ЛЖ (введение 2 ml NaCl 0,9%) паренхима почек с выраженными дисциркуляторными расстройствами, представленными полнокровием капилляров и артериол коркового и мозгового вещества с эритроцитарными стазами и сладжами, просветы сосудов расширены, клубочки обычного строения с полнокровными капиллярными петлями, строма с диффузной слабовыраженной воспалительной инфильтрацией, представленной преимущественно лимфоцитами и плазмоцитами (рис. 2-А).
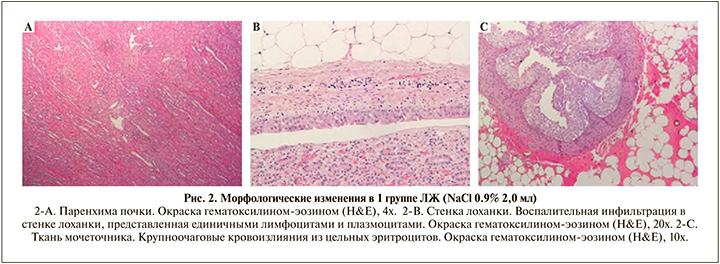
Стенка лоханки в 1 группе ЛЖ выстлана зрелым уротелием неравномерной толщины, поверхностный слой прослеживается не на всем протяжении. В толще собственного слоя, подслизистой оболочки и мышечного слоя неравномерно выраженная хроническая инфильтрация лимфоцитами и плазмоцитами, варьирующая от слабой до умеренной (рис. 2-В).
Стенка мочеточника в 1-й группе ЛЖ со слабовыраженной инфильтрацией единичными лимфоцитами, расположенной диффузно в толще всех слоев. Клеточные элементы расположены без нарушения стратификации. Часть мочеточника с крупноочаговыми кровоизлияниями из цельных эритроцитов в толще окружающей жировой ткани, очаговыми некрозами стенки с перифокальной слабовыраженной инфильтрацией лимфоцитами и нейтрофильными гранулоцитами. Эти изменения наиболее вероятно свидетельствуют о травматическом повреждении стенки в ходе оперативного вмешательства. На большем протяжении стенка мочеточника с сохранным послойным строением и минимальными признаками воспаления (рис. 2-С).
Во 2-й группе ЛЖ (E. сoli 1х105 КОЕ/мл, 1,0 мл) паренхима почек с очаговой умеренно выраженной воспалительной инфильтрацией, представленной множественными лимфоцитами, на некоторых участках воспалительный инфильтрат расположен вблизи клубочков, клубочки обычного строения с полнокровными капиллярными петлями, просветы некоторых извитых канальцев расширены, просвет заполнен эозинофильным содержимым с примесью множественных нейтрофильных гранулоцитов (рис. 3-А).
Стенка лоханки во 2-й группе ЛЖ выстлана зрелым уротелием неравномерной толщины, поверхностный слой прослеживается не на всем протяжении, на некоторых участках эпителий десквамирован от базальной мембраны в просвет лоханки, в некоторых фрагментах эпителий прослеживается не на всем протяжении. В толще собственного слоя, подслизистой оболочки и мышечного слоя неравномерно выраженный густой лимфоцитарный инфильтрат. Полость лоханки заполнена эозинофильным содержимым с примесью множественных нейтрофильных гранулоцитов (рис. 3-В).
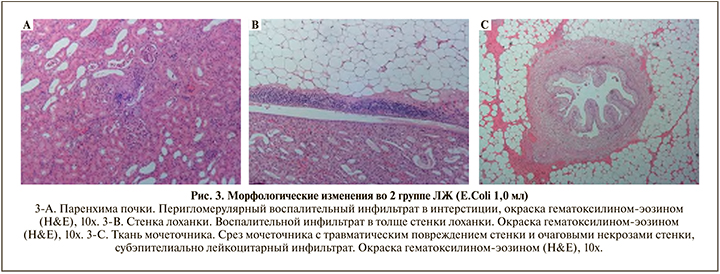
Гистоархитектоника стенки мочеточника во 2-й группе сохранена, в окружающей просвет жировой клетчатке крупноочаговые кровоизлияния, в зоне которых инфильтрация нейтрофильными гранулоцитами. В толще стенки умеренно слабовыраженный диффузный лимфоцитарный инфильтрат (рис. 3-С).
В 3-й группе ЛЖ (NaCl 0,9%, 1,0 мл+E. сoli 1х105 КОЕ/мл, 1,0 мл) паренхима коркового вещества с диффузно-очаговой воспалительной инфильтрацией, представленной множественными лимфоцитами, с примесью плазмоцитов, расположенных по ходу извитых канальцев, с тенденцией к формированию лимфоидных фолликулов без светлых центров, эпителий канальцев с белковой зернистой дистрофией, в просветах некоторых канальцев гомогенное эозинофильное содержимое с примесью множественных нейтрофильных гранулоцитов (рис. 4-А).
Стенка лоханки в 3-й группе ЛЖ с густым равномерным лимфоцитарным инфильтратом в толще всех слоев, на некоторых участках с примесью множественных нейтрофильных гранулоцитов, а также плазмоцитов уротелий неравномерной толщины, в некоторых фрагментах десквамирован в просвет лоханки, может прослеживаться не на всем протяжении. Вышеописанный воспалительный инфильтрат переходит на окололоханочную жировую клетчатку с тенденцией к формированию фолликулов без светлых центров. В просвете лоханки детрит из глыбчатых эозинофильных масс, слущенных эпителиоцитов, множественных нейтрофильных гранулоцитов (рис. 4-В).
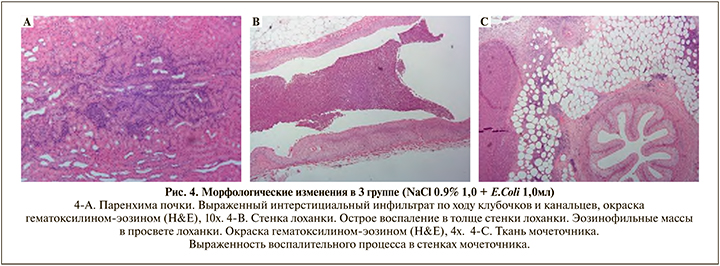
Стенки мочеточников в 3-й группе ЛЖ, а также окружающая их жировая клетчатка с густым лимфоплазмоцитарным инфильтратом, с тенденцией к формированию фолликулов, с примесью множественных нейтрофильных гранулоцитов, а также участками скопления гнойно-некротического детрита (рис. 4-С).
С учетом полученных данных можно прийти к выводу, согласно которому изменения в 1-й группе ЛЖ представлены слабовыраженным хроническим интерстициальным воспалением. В стенке лоханки и мочеточников физиологическая реакция на оперативное вмешательство, в отдельных фрагментах мочеточников травматическое повреждение стенки. Во 2-й группе ЛЖ на фоне невыраженного интерстициального нефрита начало формирования острого инфекционного процесса в виде очагового гнойного пиелита без лейкоцитарной инфильтрации слизистой лоханки отмечены признаки острого воспаления в окололоханочной жировой клетчатке, острый очаговый неравномерно выраженный уретерит. В 3-й группе ЛЖ – микроскопическая картина прогрессирования интерстициального нефрита в виде распространения воспалительного инфильтрата в толще паренхимы, а также более выраженных дистрофических изменений эпителия канальцев, острого гнойного пиелита с хорошо выраженным лейкоцитарным инфильтратом в стенке лоханки, с вовлечением в процесс окололоханочной жировой клетчатки, острого выраженного уретерита с формированием мелких очагов нагноения. Таким образом, сочетание пиеловенозного рефлюкса с бактериальной флорой способствует развитию выраженных воспалительных изменений ткани мочеточника и почки с формированием очагов нагноения.
Обсуждение результатов. Чрескожная нефролитотрипсия (ЧНЛТ) является методом выбора при лечении пациентов с МКБ [17]. Одним из осложнений ЧНЛТ в ближайшем послеоперационном периоде является острый пиелонефрит, частота которого, по данным литературы, достигает 25% [4, 5]. Одной из причин развития острого пиелонефрита является наличие бактериальной флоры в сочетании с интраоперационным повышением внутрилоханочного давления и развитием пиеловенозного рефлюкса.
В норме внутрилоханочное давление составляет 10 см вод.ст. При выполнении ЧНЛТ на фоне постоянной ирригации чашечно-лоханочной системы жидкостью под давлением отмечается повышение внутрилоханочного давления, а при увеличении его выше 30–45 см вод.ст. возникает пиеловенозный рефлюкс, на фоне которого содержимое лоханки проникает в венозную сеть почки [3].
В рамках нашего эксперимента исследованы 3 группы ЛЖ: 1-я – с формированием асептического пиеловенозного рефлюкса, 2-я – с наличием бактериальной флоры в моче и 3-я – с бактериальной флорой и созданным пиеловенозным рефлюксом.
Результаты эксперимента показали, что пиеловенозный рефлюкс при наличии асептической мочи самостоятельно не вызывает острых инфекционно-воспалительных заболеваний. Однако возникшие морфологические изменения в почке и мочеточнике на фоне резкого повышения внутрилоханочного давления при присоединении бактериальной флоры способствуют развитию острого пиелонефрита, что демонстрируют патоморфологические исследования ЛЖ третьей группы.
С целью снижения риска развития пиеловенозного рефлюкса необходимо избегать значительного повышения внутрилоханочного давления во время нефролитотрипсии путем контроля адекватного притока и оттока ирригационной жидкости. Кроме того, особой настороженности требуют пациенты с наличием роста бактериальной флоры в посеве мочи, с ранее установленными с целью дренирования чашечно-лоханочной системы почки внутренними мочеточниковыми стентами и нефростомическими дренажами, наличием рецидивных и резидуальных конкрементов инфекционного генеза.
Скрытая бактериурия служит одной из причин развития послеоперационного острого пиелонефрита. По данным литературы, частота скрытой бактериурии достигает 67% [18, 19]. С учетом возможности наличия скрытой бактериурии необходимо принимать во внимание высокий риск развития острого пиелонефрита в послеоперационном периоде, особенно при значительном повышении внутрилоханочного давления на этапах нефролитотрипсии. Даже несмотря на отсутствие роста бактериальной флоры в посеве мочи, выполненном на этапах предоперационного обследования пациента, необходимо принимать во внимание возможное наличие конкрементов инфекционного генеза, блокированных камнями чашечек.
Заключение. Уменьшение диаметра инструментов и оперативного доступа (антеградного и ретроградного) для нефролитотрипсии снижает риск кровотечений, но может увеличить риск инфекционных осложнений. Пиеловенозный рефлюкс, связанный с интраоперационным повышением внутрилоханочного давления, и бактериурия являются основными факторами, способствующими развитию острого пиелонефрита в послеоперационном периоде. Это подтверждено выявленными воспалительными изменениями почки и мочеточника у ЛЖ при проведении эксперимента. С целью возможного снижения частоты инфекционных осложнений целесообразно избегать резкого повышения внутрилоханочного давления ирригационной жидкости на этапах нефролитотрипсии, по возможности соблюдать раннее удаление дренажей и стентов как источников катетер-ассоциированных инфекций, проводить интраоперационный забор мочи для выявления скрытой бактериурии, особенно у пациентов с дренажами, с последующей коррекцией лечения по результатам посева мочи.



