Введение. В настоящее время специалистами изучения причин возникновения мочекаменной болезни (МКБ) определены ведущие факторы инициации, роста и формирования мочевых камней. Согласно теории папиллярной патологии, предложенной A. Rendall (1936), в почечных сосочках возникают функциональные и морфологические изменения, ведущие к обызвествлению подслизистого слоя. Образование кальцинатов в почках – довольно частое явление, что показано во многих работах. Исследование с применением рентгенографии высокого разрешения, проведенное на 50 трупных почках, выявило на 57% рентгенограмм признаки интерстициальных бляшек Рендалла [1].
Существует несколько теорий, объясняющих образование депозитов в почках:
- теория Carr (1954) подразумевает перегрузку лимфатических сосудов микролитами и/или нарушение лимфооттока в почке вследствие облитерации лимфатических сосудов, что ведет к литогенезу [2];
- в теории M.L. Stoller подчеркивается роль сосудистых изменений, участие vasa recta в литогенезе мочевых камней в почках [3];
- согласно теории, предложенной G. Kramer et al. [4], нанобактерии способны формировать очаги кристаллизации кальция фосфата с повреждением уротелия собирательных трубочек и почечных сосочков;
- образование минеральных депозитов в почечных канальцах может также быть обусловлено транслокацией наночастиц в минералоорганической форме через эндотелиальные клетки сосудов и почечные эпителиальные клетки и в интерстций почки, и непосредственно в мочу [5].
Определено два доминирующих механизма камнеобразования: а) механизм «фиксированных» частиц – депозиты СаР (апатит), локализующиеся в интерстиции в области петли Генле, растут кнаружи, преодолевают монослой эпителия почечного сосочка, вступают в контакт с мочой в чашечно-лоханочной системе и являются ядром кристаллизации СаОх (гетерогенная нуклеация требует более низкого уровня перенасыщения камнеобразующих веществ); б) механизм «свободных частиц» – кристаллы СаР, мочевой кислоты или цистина, могут образовываться в почечных канальцах, скапливаться и закупоривать терминальные собирательные трубочки (гомогенная нуклеация требует высокой степени перенасыщения соответствующим минералом) [6].
Основные теории камнеобразования выделяют следующие ведущие факторы образования мочевых камней:
- Пресыщение мочи литогенными ионами и анионами, приводящее к оксидативному стрессу, повреждению канальцевого эпителия, базальной мембраны петли Генле, прямых кровеносных или лимфатических сосудов, в результате чего могут возникать условия для образования мочевых кристаллов. Пресыщение принимается в физической химии как основной источник свободной энергии, приводящее к зарождению и росту кристаллов, а степень пресыщения камнеобразующих веществ влияет на длительность времени нуклеации. Не вызывает сомнений, что чем выше исходное пресыщение, тем короче время нуклеации [7].
- Нарушение интраренального траспорта мочи, поскольку чем дольше перенасыщенный раствор находится в покое, тем выше вероятность осаждения кристаллов. Особую роль в образовании камней играют особенности интраренального тока мочи, а именно затруднение пассажа мочи в местах сужения канальцев: 1) зона перехода проксимального канальца в петлю Генле, 2) основание сосочков, где почечные канальцы изгибаются [8]. По мнению M. L. Stoller, нисходящая и восходящая части vasa recta наиболее уязвимы к воздействию гипоксии и гиперосмолярной среды в сосочковом своде. Обусловлено это изменнием тока крови в папиллярном участке от ламинарного до турбулентного ввиду неоднократного раздвоения восходящего участка vasa recta. Нарушение кровотока может приводить к атеросклеротическим изменениям и кальцификации в стенке сосуда и базальной мембране петель Генле с последующим разрастанием депозита глубоко в интерстиций сосочка и формированием бляшки, проникающей глубоко в интерстиции. Кроме того, особенностью строения почечных сосудов является то, что роль их адвентиции выполняет интерстициальная ткань и пульсация внутрипочечных сосудов создает пульсовую волну в канальцах, способствуя продвижению мочи в сторону наименьшего сопротивления (из нисходящего отдела петли Генле в восходящий, из канальцев в собирательные трубочки, дальше в канальцы Беллини и почечные чашечки). То есть расстройства внутрипочечной гемодинамики могут существенно влиять на интраренальный транспорт мочи [9–11].
- Дефицит ингибиторов кристаллизации и агрегации кристаллов (однако в последние годы эффект влияния ингибиторов подвергается сомнению, поскольку может быть подавлен высокими концентрациями минералов в перенасыщенной моче) [11–13]:
- присутствие активаторов камнеобразования (мочевая кислота, уромодулин);
- стойкие изменения рН мочи;
- локальные анатомические и функциональные изменения мочевых путей.
Как видно из представленных выше данных, немаловажную роль в камнеобразовании исследователи отводят изменениям со стороны внутрипочечной гемо-, лимфо- и уродинамики.
На сегодняшний день в доступной отечественной и мировой литературе не встречаются работы, которые бы описывали интраренальные процессы, происходящие у пациентов с МКБ, так как до последнего времени не было методики, позволяющей реализовывать это на должном уровне в условиях in vivo. Современные компьютерные технологии дают возможность выполнять последовательный 3D-анализ данных МСКТ почек с контрастированием и приблизиться к изучению процессов, обеспечивающих продвижение мочи в почечной коре и мозговом веществе почки [14, 15].
В литературе немало работ, посвященных сравнению объема почки с ее функцией, т.н. волюметрия [16–19]. Также имеются работы, в которых показана корреляция между данными МРТ и нефросцинтиграфии в отношении определения относительной выделительной функции почек [20–23].
В 2017 г. в диагностическом арсенале Института урологии и репродуктивного здоровья человека Сеченовского Университета появился совершенно новый метод (Способ исследования функции почек при мультиспиральной компьютерной томографии: пат. Росс. Федерации № 2673384, заявл. 19.06.2017, опубл. 26.11.2018), позволяющий не только получать информацию о функциональных характеристиках почек, доступную при оценке стандартным методом (нефросцинтиграфия), но и оценивать многие интраренальные процессы, в частности скорость клубочковой фильтрации (СКФ) раздельно для каждой почки, основываясь на численном анализе данных МСКТ с контрастированием [24]. Располагая данной методикой, мы взяли на себя смелость попробовать оценить СКФ как основной параметр почечной функции [25] раздельно для каждой почки у больных МКБ.
Цель исследования: оценить особенности СКФ (основной параметр почечной функции) при МКБ и попытаться установить возможные закономерности в интраренальном транспорте контрастного вещества у данной группы пациентов.
Материалы и методы. В исследование вошли 23 пациента (13 мужчин и 10 женщин) в возрасте от 17 до 58 лет (средний возраст – 41,3±11,5 лет) с диагнозом МКБ. Пациенты находились на амбулаторном и стационарном обследовании и лечении в период с июня 2017 по май 2018 г. Данное исследование одобрено локальным комитетом по этике (выписка из протокола № 01-19 от 23.01.2019).
Критерии включения в исследование:
- пациенты с МКБ, которым по показаниям выполнили МСКТ почек с контрастированием (пятерым исследование выполнено перед оперативным вмешательством по поводу камней почек; восьми – для дообследования в связи с микрогематурией; одной пациентке – в связи с кистозным образованием правой почки; у остальных девяти пациентов размер камня превышал 1,0 см и для определения тактики лечения им выполнялась МСКТ почек с контрастированием);
- впервые диагностированная МКБ;
- размеры камней не более 2,0 см, не нарушающих оттока мочи из почек;
- отсутствие в анамнезе указаний на оперативное вмешательство (в том числе травм) на почках и верхних мочевыводящих путях;
- относительно молодой возраст (молодость – 18–44 года, классификация ВОЗ);
- отсутствие интеркуррентных заболеваний, требующих приема нефротропных и иных препаратов, способных влиять на почечную гемо- и уродинамику;
- отсутствие на момент обследования острой урологической и иной патологии.
Им всем проводили стандартное для МКБ клинико-лабораторное обследование (сбор жалоб, анамнеза, клинический и биохимический анализы крови, общий анализ мочи, исследование уровня паратгормона в крови, биохимический анализ мочи), а также ряд инструментальных обследований (УЗИ и допплерографическое сканирование [ДС] почечных сосудов, обзорный снимок и МСКТ почек с контрастированием).
Для структурно-функциональной оценки состояния почек выполняли постпроцессинговый численный анализ данных МКСТ с контрастированием. Данная инновационная методика позволяет получать информацию о почечном плазмотоке и перфузии, удельной СКФ (референсные значения СКФ – 0,55±0,3% контрастного вещества [КВ] в 1 с) [24], а также более подробную информацию о структурном состоянии мозгового вещества почек на основании анализа данных нативной фазы МСКТ.
Имеющаяся инновационная методика подразумевает математическую обработку данных МСКТ почек с контрастированием и последующей оценкой распространения КВ в структурах почек во времени. Методика на первоначальном этапе включает применение ряда фильтров для очистки полученных изображений от т.н. белого шума. После их применения получаем изображения, с которыми и производится дальнейшая работа. Далее отдельно выделяются левая и правая почки на всех фазах МСКТ и совмещение соответствующих объемов данных (левая почка в венозной фазе, с левой почкой в артериальной фазе и т.д.). Это дает возможность поточечно сравнить распределение КВ на этапе каждой фазы. Распределение КВ на различных фазах сравнивается друг с другом, и выделяются объемы почечных структур, в которых происходит распространение КВ в зависимости от конкретной фазы. Полученные объемы изучаются с применением методов математического анализа, что позволяет численно оценивать такие параметры, как почечный плазмоток и перфузия, удельная СКФ.
Пяти пациентам, находившимся на стационарном обследовании и лечении, выполнено оперативное вмешательство по поводу МКБ (дистанционная литотрипсия [n=3], нефролитолапаксия и миниперкутанная операция [по 1 наблюдению]), что позволило провести спектральный анализ фрагментов удаленных камней.
Известно, что обструкция экстраренальных мочевых путей, вызванная, в частности, камнями, приводит к нарушению пассажа мочи, повышению внутрилоханочного давления выше фильтрационного, что негативным образом сказывается как на интраренальной гемо- и уродинамике [26, 27], так и на многих обменных процессах в почечной ткани с последующей гибелью клеток [28].
Все вышеперечисленные критерии включения позволили нивелировать влияние вторичных факторов, в т.ч. обструкции верхних мочевыводящих путей на почечную гемо- и уродинамику, а следовательно, и на процессы интраренального транспорта контрастного вещества и провести исследование per se.
Результаты описаны с применением методов описательной статистики, сравнение показателей проводили с помощью критерия Краскелла–Уоллиса. Различия показателей признавались значимыми при Р менее 0,05.
Результаты. Согласно данным МСКТ почек с контрастированием, у подавляющего большинства (95,6%) обследованных регистрировали отклонения СКФ в обеих почках в сторону как ее увеличения, так и уменьшения. У 10 (43,5%) пациентов обнаружена гиперфильтрация (СКФ ≥0,56%), у 11 (47,8%) – гипофильтрация (СКФ ≤0,54%), у 1 – нормофильтрация и еще у одного справа гиперфильтрация (СКФ=0,62%), слева гипофильтрация (СКФ=0,48%; смешанная фильтрация). Таким образом, согласно полученным данным об СКФ, все пациенты были разделены на две группы: с гиперфильтрацией (n=10) и с гипофильтрацией (n=11). Показатели СКФ значимо различались в группах как справа (p=0,00068), так и слева (p=0,000142). Двое пациентов (один с нормофильтрацией, другой со смешанной фильтрацией) были исключены из дальнейшего анализа для сохранения однородности групп по показателям СКФ.
С целью выяснения причин подобного изменения интраренального транспорта контрастного вещества проведен сравнительный анализ. Для исключения влияния измененного внеорганного и внутриорганного почечного кровотока всем пациентам выполнено ДС почечных сосудов в бассейнах магистральных и сегментарных артерий (см. таблицу). Был изучен такой угол независимый [29] параметр почечного кровотока как индекс резистентности (RI). В таблице представлены данные по СКФ и результатам ДС почечных сосудов в группе пациентов с ГиперФЛ и ГипоФЛ, а также возраст пациентов в группах.

Согласно результатам клинико-лабораторного исследования, лейкоцитурия и микрогематурия отмечены у 6 (26%) и 11 (47,8%) обследованных соответственно. Нарушение состава электролитов в суточной моче выявлено у 13 (56,5%) пациентов (7 с гипофильтрацией; 5 с гиперфильтрацией; 1 со смешанной фильтрацией), повышение уровня паратгормона в крови – у 3 (13%) (1 с гиперфильтрацией; 2 с гипофильтрацией). Интеркуррентный фон в виде гипертонической болезни имел место у двоих пациентов, из них одному в анамнезе проведена радиочастотная абляция по поводу мерцательной аритмии. Анализ камней, удаленных в ходе операции, показал, что у 3 пациентов основу конкремента составляли оксалаты, у 1 – оксалаты и фосфаты, у 1 – гипоксантин.
 В группе пациентов с гиперфильтрацией (n=10) камень/камни локализовались в обеих почках в 7 наблюдениях, в правой почке – в 3. Среди пациентов с гипофильтрацией (n=11) у 7 человек конкременты определялись в обеих почках, у 2 – в правой и еще у 2 – в левой.
В группе пациентов с гиперфильтрацией (n=10) камень/камни локализовались в обеих почках в 7 наблюдениях, в правой почке – в 3. Среди пациентов с гипофильтрацией (n=11) у 7 человек конкременты определялись в обеих почках, у 2 – в правой и еще у 2 – в левой.
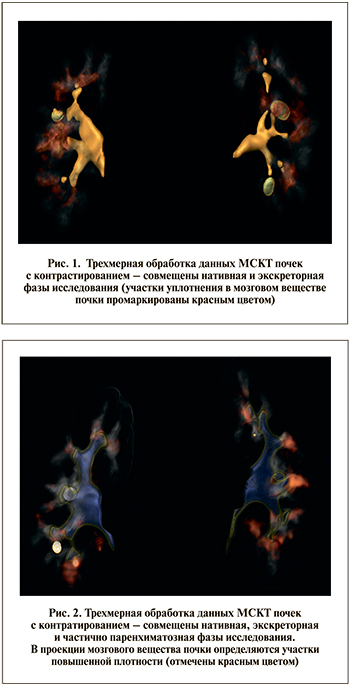
У 7 пациентов с МКБ (2 пациента с гипофильтрацией [18,2% в группе], 5 пациентов с гиперфильтрацией [50% в группе]) при анализе нативной фазы МСКТ обнаружили участки уплотнения в проекции мозгового вещества почек (рис. 1). Для ответа на вопрос о природе данных изменений требовалось проведение гистологического исследования. Приводим клиническое наблюдение.
П а ц и е н т к а А. 41 года. Диагноз: кистозное образование правой почки (тип 4 по Bosniak), камень правой почки. 15.05.2018 ей была выполнена лапароскопическая резекция правой почки по поводу данного кистозного образования (гистологическое заключение: папилярный светлоклеточный рак почки). По результатам математического анализа данных МСКТ почек с контрастированием у пациентки констатирована гипофильтрация (правая почка, СКФ – 42%; левая почка, СКФ – 0,43%). В нативную фазу МСКТ в проекции мозгового вещества почек с обеих сторон определялись участки повышенной плотности (рис. 2).
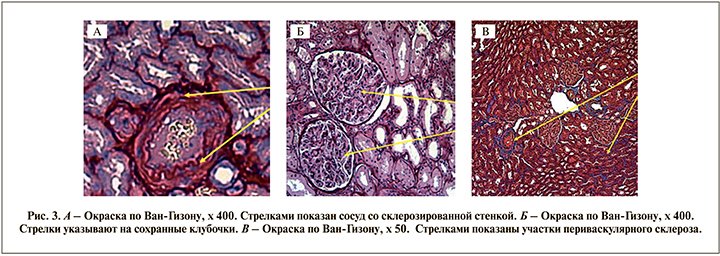
Проведена световая микроскопия гистологического материала (заключение: клубочки сохранны, эпителий канальцев в состоянии белковой дистрофии и распространенной субатрофии, просветы расширены [нефрогидроз]; очаги склероза в интерстиции и периваскулярный склероз. Очаговая лимфомакрофагальная инфильтрация), полученного из зоны макроскопически не измененной части паренхимы почки, наиболее удаленной от края опухоли и, на наш взгляд, максимально приближенной к мозговому слою, т.е. к участкам почечной ткани, маркированным красным цветом на нативных снимках (рис. 3).
Обсуждение. В настоящем наблюдении мы попытались выявить возможную связь нарушенной СКФ с некоторыми клинико-диагностическими данными у пациентов с МКБ. Для этого мы провели клинико-эпидемиологические корреляции в группах наблюдения, в частности исследование возраста пациентов, оценку суточной экскреции электролитов, изучение уровня паратгормона в крови, спектральный анализ состава камней, исследование распространенности поражения камнями почек, дуплексное сканирование почечных сосудов, подробный анализ данных МСКТ почек с контрастированием.
Наше исследование не позволило выявить связь измененной СКФ у пациентов с МКБ с данными ДС почечных сосудов у них. Средние значения ИР в группах пациентов с гипер- и гипофильтрацией были в пределах нормы и статистически значимо не отличались друг от друга ни для магистральных (p=0,287), ни для сегментарных (p=0,241) артерий. Это позволило заключить, что кровоток в почечных артериях не мог быть причинным фактором нарушенного интраренального транспорта контрастного вещества, так же как и сравнимый возраст (p=0,562). Пациенты были в среднем молодого возраста, что, видимо, говорит и об отсутствии влияния возрастных изменений со стороны почек на интраренальный транспорт контрастного вещества. Нельзя было выявить какую-либо корреляционную связь и по суточной экскреции электролитов. Изменения суточной экскреции электролитов имелись лишь у половины пациентов. Причем встречались такие противоположенные показатели среди пациентов одной группы, как например, повышение у одного, и понижение у другого больного суточной экскреции мочевой кислоты, а также некоторых электролитов. Последнее не позволило определить возможную саязь между измененной СКФ и суточной экскрецией электролитов. Повышение уровня паратгормона имелось у 3 пациентов. Не выражен был и интеркуррентный фон, что также нивелировало влияние сопутствующих заболеваний на работу почек. Оценить состав камней удалось лишь у 5 пациентов, перенесших оперативные вмешательства, поэтому проводить корреляционный анализ ввиду малочисленности выборки мы посчитали нецелесообразным. Также мы попытались установить наличие возможной зависимости стороны расположения камней у пациентов обеих групп и СКФ. Однако значимых различий частоты распределения пациентов обеих групп в зависимости от стороны локализации камней в почках выявлено не было (р=0,340).
У части пациентов, имевших довольно хорошие исходные данные МСКТ, получены интересные результаты обработки нативной фазы. Нами выявлены участки повышенной плотности мозгового вещества почек (как правило, с обеих сторон) у пациентов как с гипер-, так и с гипофильтрацией. Данные единственного гистологического исследования, которое нам удалось провести, позволили заключить, что, видимо, склеротические изменения со стороны стромы и периваскулярный склероз не могут не сказаться на интраренальном транспорте мочи. Как известно, внутрипочечные сосуды лишены адвентиции, его роль выполняет интерстициальная ткань, через которую пульсовая волна от этих сосудов способствует итраренальному транспорту мочи. Согласно данным гистологического исследования, интерстициальная ткань у пациентки А. находилась в состоянии склероза. Данные склеротические изменения уменьшали амплитуду пульсовой волны с интраренальных сосудов и приводили к снижению скорости продвижения болюса мочи по почечному канальцу (снижение интраренального тока мочи), что проявлялось в виде гипофильтрации контрастного вещества. Выявленная в данной ситуации гипофильтрация, возможно, является компенсаторной реакцией со стороны клубочков. Процессы нарушенного интраренального транспорта контрастного вещества, выявленные в нашем исследовании у большинства пациентов с МКБ, не противоречат факторам и теориями камнеобразования, в которых многие исследователи подчеркивают роль нарушенного интраренального кровообращения и транспорта мочи в процессах камнеобразования. Измененные показатели СКФ у пациентов с МКБ, возможно, вторично сигнализируют о проблемных процессах транспорта мочи на уровне нижележащих отделов нефрона. Конечно, все, что было представлено выше, является нашим предположением, полученным по результатам проведенной работы, требует дальнейшего поиска и анализа других возможных факторов, могущих оказать влияние на интраренальный транспорт контрастного вещества, в том числе и гистологическое исследование почечной ткани у пациентов с мочекаменной болезнью.
Заключение. Математический постпроцессинговый анализ данных МСКТ почек с контрастированием позволяет оценивать СКФ отдельно для каждой почки. Изменения со стороны СКФ у пациентов с МКБ могут свидетельствовать об измененном интраренальном кровотоке и транспорте мочи, которые не регистрируются с помощью рутинных методов диагностики. Проведенное исследование показало, что у большинства (95,6%) пациентов с МКБ происходят изменения СКФ в сторону как замедления, так и ускорения, что не может не влиять и на последующие обменные процессы в канальцевом аппарате почки, в дальнейшем отражаться на процессах камнеобразования.



