Актуальность. В период пандемии COVID-19 практикующие врачи всех специальностей сталкиваются с глобальной проблемой: недостатком информации о течении даже хорошо изученных заболеваний и патологических состояний на фоне коронавирусной инфекции [1]. В частности, это касается одной из наиболее актуальных проблем урологии – ведения пациентов с симптомами нижних мочевыводящих путей (СНМП), ассоциированных с доброкачественной гиперплазией предстательной железы (ДГПЖ) [2]. Накоплено достаточно клинических данных, свидетельствующих о том, что у мужчин с диагностированной инфекцией COVID-19 нарастает симптоматика со стороны нижних мочевыводящих путей, как объективная, так и субъективная, а также с большей частотой регистрируются осложнения, в частности острая задержка мочеиспускания [2–5]. В ряде стран пересмотрены клинические рекомендации в урологии с учетом особенностей и ограничений текущей пандемии COVID-19 [6, 7]. Однако в связи с трудностями проведения хорошо спланированных рандомизированных клинических исследований в острой эпидемиологической ситуации отмечается недостаток данных с высоким уровнем убедительности доказательств для актуализации терапевтических стратегий у пациентов с СНМП. В то же время повышается ценность информации, полученной из открытых исследований, а также наблюдательных программ, которые позволяют анализировать какую-либо клиническую проблему в условиях повседневной клинической практики, при этом предполагая индивидуальный подход к пациенту. Так, сегодня в научно-медицинских кругах все чаще можно встретить термины «Real World Evidence», «Real World Data» (доказательства, данные, полученные из реальной клинической практики).
В 2021 г. на территории Российской Федерации (РФ) проведена Всероссийская наблюдательная программа применения препарата Афалаза в Терапии симптомов нижних мочевых путей на фоне доброкачественной гиперпЛАзии предстательной железы у пациеНТов, перенесших COVID-19 (АТЛАНТ).
Афалаза – комплексный препарат производства компании ООО «НПФ “Материа Медика Холдинг”», содержащий технологически обработанные аффинно очищенные антитела к простатспецифическому антигену и к эндотелиальной NО-синтазе [8]. Лекарственное средство показано для лечения ДГПЖ и ассоциированных с ней дизурических расстройств [8]. Препарат Афалаза продемонстрировал свою эффективность в отношении пациентов с СНМП/ДГПЖ в крупном плацебо-контролируемом исследовании [9]. В частности, на фоне приема препарата отмечены уменьшение СНМП по шкале IPSS (International Prostate Symptom Score, Международная шкала оценки простатических симптомов), улучшение уродинамических показателей (максимальной и средней скорости потока мочи, остаточного объема мочи), уменьшение объема предстательной железы по данным ультразвукового исследования, положительное влияние на эректильную функцию [9]. Для изучения эффектов препарата для пациентов с СНМП/ДГПЖ, ранее не получавших терапии, также было проведено многоцентровое открытое проспективное исследование, показавшее аналогичные результаты [10].
Целью настоящей наблюдательной программы стало получение дополнительных данных по эффективности и безопасности применения препарата Афалаза в терапии СНМП на фоне ДГПЖ у пациентов, перенесших COVID-19.
Материалы и методы
Дизайн и процедуры исследования
Всероссийская наблюдательная программа применения препарата Афалаза в Терапии симптомов нижних мочевых путей на фоне доброкачественной гиперпЛАзии предстательной железы у пациеНТов, перенесших COVID-19 (АТЛАНТ), была спланирована и проведена в соответствии с правилами надлежащей клинической практики GCP (Good Clinical Practice) и Хельсинкской декларацией. Программа получила одобрение Независимого междисциплинарного комитета по этической экспертизе клинических исследований на основании Протокола заседания № 4 от 12.03.2021.
В наблюдательной программе были задействованы врачи-урологи из трех городов Российской Федерации (Санкт-Петербург, Ростов-на-Дону, Барнаул).
В исследовании участвовали амбулаторные пациенты 46–65 лет с документально подтвержденным диагнозом «ДГПЖ» и проявлениями СНМП, перенесшие COVID-19, которым, по мнению врача, был показан препарат Афалаза. Пациенты включались в программу независимо от давности перенесенной инфекции и впоследствии были стратифицированы на 4 группы по срокам, прошедшим от выявления COVID-19 (менее 1 мес., 1–2, 3–6, более 6 мес.). Наблюдательная программа не подразумевала рандомизированных групп сравнения, поскольку препарат назначался в рамках Инструкции по медицинскому применению всем пациентам.
После ознакомления с информационным листком пациента и подписания участником формы информированного согласия препарат назначался, согласно Инструкции по медицинскому применению, в дозе 2 таблетки 2 раза в день в течение 16 нед.
На этапе включения в программу регистрировались демографические данные пациента, дата выявления COVID-19, клинические характеристики основного заболевания (средний балл выраженности СНМП по шкале IPSS, а также средние баллы опросников МИЭФ-5 (Международный индекс эректильной функции) и EQ-5D [EuroQoL – 5 dimensions, опросник Европейской группы качества жизни из 5 вопросов]), терапия основного заболевания, наличие сопутствовавших заболеваний и терапии. В ходе программы было предусмотрено три визита – через 4, 12 и 16 нед. от начала приема препарата.
Критерии эффективности и безопасности
Для оценки эффективности терапии проводился анализ изменений значений среднего балла опросников IPSS, EQ-5D, МИЭФ-5 через 4, 12 и 16 нед. лечения препаратом Афалаза по сравнению с исходным состоянием. Безопасность оценивалась на основании характера и количества НЯ в период терапии, их интенсивности (степени тяжести), связи с приемом препарата Афалаза, исхода.
Статистика
Динамика показателей анализировалась методами попарного сравнения между разными визитами (парный критерий Стъюдента для нормально распределенных рядов значений или парный критерий Вилкоксона при нарушении нормальности) и с помощью дисперсионного (ковариационного) анализа с учетом данных всех четырех визитов.
Результаты
Исходные демографические и клинические данные
В наблюдательной программе приняли участие 73 мужчины из трех городов РФ (Санкт-Петербург, Ростов-на-Дону, Барнаул). Средний возраст пациентов составил 58,7±5,6 года (минимальный – 46, максимальный – 65 лет).
В среднем период от начала заболевания COVID-19 до включения участника в наблюдательную программу продолжался 107±101 день (от 14 до 402 дней).
Данные пациентов в первичной документации частично отсутствовали, поэтому демографические и клинические параметры анализировались на основании имевшихся сведений (количество участников указано индивидуально для каждого критерия). При анализе безопасности учитывались данные всех 73 участников, включенных в программу.
Сопутствовавшие заболевания
Сопутствовавшие заболеваниями были отмечены у 20 (27,4%) пациентов. Наиболее часто регистрировалась патология сердечно-сосудистой системы (артериальная гипертензия у 5 [6,8%] пациентов, ишемическая болезнь сердца у 2 [2,7%]) и сопутствовавшая урологическая патология (мочекаменная болезнь у 3 [4,1%] пациентов, хронический простатит у 2 [2,7%]). Также выявлялись сахарный диабет 2 типа, хронический гастрит: каждое заболевание у 2 (2,7%) пациентов. Хронический бронхит, пояснично-крестцовый остеохондроз, хронический холецистит, хроническое нарушение мозгового кровообращения регистрировались как единичные случаи (по 1,4%).
Сопутствовавшая терапия
Участники исследования принимали на постоянной основе препараты комплексной терапии сердечно-сосудистых заболеваний: антиагреганты (3 пациента [4,1%]), бета-адреноблокаторы (2 пациента [2,7%]) и ингибиторы ангиотензинпревращающего фактора (2 пациента [2,7%]). Один (1,4%) участник применял комбинированный обезболивающий препарат.
Исходная клиническая характеристика пациентов
Для более подробного изучения течения СНМП/ДГПЖ был проведен анализ динамики симптомов в зависимости от давности COVID-19. Шестьдесят участников были стратифицированы в четыре группы: перенесшие COVID-19 в пределах 1 мес. до включения в программу (n=15), в течение 1–2 мес. (n=22), в течение 3–6 (n=18) и более 6 мес. (n=13). Данные сроки давности были выбраны для оценки динамики симптомов в соответствии с установленной этапностью течения COVID-19, согласно рекомендациям NICE: до 1 мес. – острый период («acute COVID-19»), от 1 до 3 мес. – период продолжающихся симптомов («ongoing symptomatic COVID-19») и более 3 мес. – период последствий («post-COVID-19») [11]. Наибольшие значения среднего балла IPSS на Визите 1 (до начала лечения) наблюдались в группах пациентов, перенесших инфекцию менее чем за 1 мес. и за 1–2 мес. до обращения к урологу (т.е. вступивших в программу в остром и подостром периодах COVID-19): 30,8±1,7 и 24,4±8,9 балла соответственно; в группах с большей давностью COVID-19 показатели были значительно ниже: 16,6±6,4 балла в группе «3–6 мес.» и 14,8±2,0 в группе «более 6 мес.».
Динамика среднего балла шкалы IPSS
Средний суммарный балл по шкале IPSS на первом визите составил 21,6±8,6 балла (на основании данных 71 пациента), через 4 нед. терапии – 14,8±3,7 балла (n=71), через 12 – 7,4±2,9 (n=59), через 16 нед. – 6,4±2,4 балла (n=55). Среднее снижение суммарного балла по шкале IPSS через 16 нед. терапии составило 17,5±9,4 балла. На каждом визите изменения показателя от исходного были статистически значимы (p<0,0001).
Отдельно проанализирована динамика средних значений ирритативной и обструктивной симптоматики (подшкалы симптомов наполнения IPSS-I и симптомов опорожнения IPSS-O соответственно) Было показано, что через 16 нед. терапии выраженность симптомов наполнения у пациентов снизилась на 7,9±4,3 балла, симптомов опорожнения – на 9,4±5,6 при оценке средних баллов соответствовавших субшкал опросника IPSS. Как и для изменения суммарного балла IPSS, на каждом визите показана достоверность выявленных различий по сравнению с исходными баллами подшкал наполнения и опорожнения (p<0,0001).
Динамика изменений среднего суммарного балла по шкале IPSS, а также средних баллов по подшкалам IPSS-I и IPSS-O представлена на рис. 1.
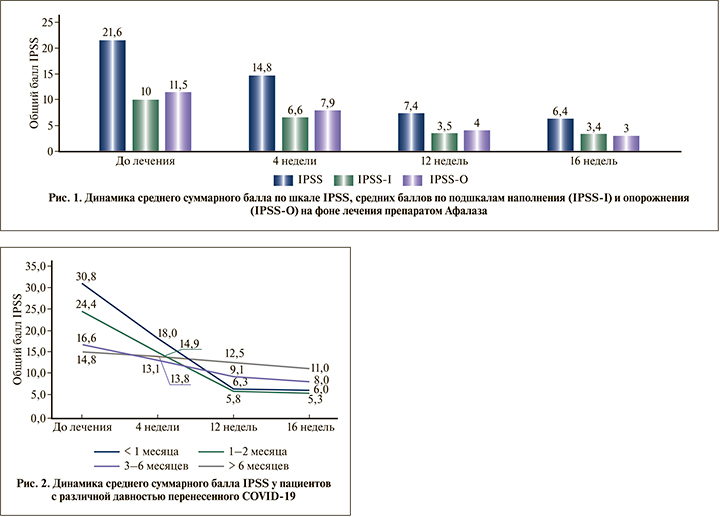
Дополнительный анализ в группах с различной давностью коронавирусной инфекции показал максимально выраженную динамику симптомов у пациентов, перенесших COVID-19 в течение 1 мес. до включения в программу: с 30,8±1,7 до 6,0±0,0 балла по шкале IPSS через 16 нед. терапии (на 80,5%). В группе участников, вошедших в исследование и начавших терапию в продолжение 1–2 мес. после перенесенной инфекции, изменения также были значительными: с 24,4±8,9 до 5,3±1,7 балла (на 78,3%). Менее выраженный тренд отмечался у пациентов, перенесших инфекцию за 3–6 мес. до начала лечения: с 16,6±6,4 до 8,0±2,4 балла (на 51,8%). Наконец, наименьшие изменения наблюдались в группе пациентов, перенесших COVID-19 более полугода назад: с 14,8±2,0 до 11,0±2,8 балла (на 25,7%). Динамика среднего суммарного балла IPSS в перечисленных подгруппах представлена на рис. 2.
Однофакторный дисперсионный ковариационный анализ (ANCOVA) показателей среднего балла IPSS на всех четырех визитах с контролем давности перенесенного COVID-19 в качестве ковариаты выявил достоверность как фактора «Визит» (p<0,0001) и ковариаты «давность COVID-19» (p=0,0007), так и их взаимодействия (p<0,0001), подтверждая таким образом зависимость выраженности снижения симптомов от сроков начала терапии после перенесенного COVID-19.
Последующий корреляционный анализ показал достоверную отрицательную взаимосвязь между давностью перенесенной инфекции COVID-19 и средним баллом IPSS на визите включения в программу и через 4 нед. терапии (r=-0,57; p<0,0001 и r=-0,36; p=0,0128 соответственно) и, напротив, достоверную положительную взаимосвязь давности перенесенной инфекции с показателями IPSS на завершающих этапах исследования (r=0,69; p<0,0001 и r=0,72; p<0,0001, для визитов через 12 и 16 нед. соответственно). Соответственно, максимально выраженная динамика СНМП отмечалась у пациентов в период до 3 мес. назначения препарата Афалаза после перенесенного COVID-19.
Динамика среднего балла шкалы EQ-5D
Опросник EQ-5D, предназначенный для оценки качества жизни пациентов, включает пять вопросов о субъективных ощущениях физического и психического здоровья человека с тремя вариантами выраженности нарушений (0–2). После заполнения опросника оценки по всем вопросам суммируются.
Качество жизни до лечения, оцененное пациентами по опроснику EQ-5D, составило 3,4±2,2 балла (по данным 73 участников). Через 4 нед. лечения значение этого показателя уменьшилось до 2,1±1,5 балла (n=73), через 12 – до 1,3±1,0 (n=60), через 16 нед. – до 0,5±1,0 балла (n=55), т.е. к концу курса лечения нарушение качества жизни практически отсутствовало. Различия по сравнению с исходным значением были достоверны на каждом визите (p<0,0001). Среднее снижение показателя качества жизни по шкале EQ-5D через 16 нед. составило 3,5±2,2 балла. Данные представлены на рис. 3.
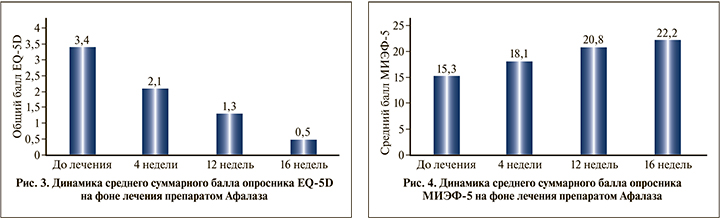
Динамика среднего балла шкалы МИЭФ-5
На этапе включения в программу значение среднего суммарного балла по шкале МИЭФ-5 составило 15,3±3,1 балла (по данным 71 пациента). Через 4 нед. данный показатель увеличился до 18,1±2,1 балла (n=71), через 12 – до 20,8±2,1 (n=60) и через 16 нед. – до 22,2±2,6 балла (n=51), что интерпретируется как отсутствие эректильной дисфункции (ЭД). Отличия от исходного значения были достоверными на каждом визите (p<0,0001). Средний суммарный прирост балльной оценки по шкале МИЭФ-5 через 16 нед. составил 7,5±4,5 балла. Динамика показателя приведена на рис. 4.
Безопасность
В ходе наблюдательной программы зарегистрировано 9 НЯ у 9 (12,3%) участников исследования. Ни одно из них не удовлетворяло критериям серьезности. Наиболее часто отмечались НЯ со стороны желудочно-кишечного тракта (диарея у 4 [5,5%] участников, тошнота у 1 [1,4%]), нервной системы (головная боль и головокружение у 2 [2,7%] и 1 (1,4%) участника соответственно), кроме того, 1 (1,4%) пациент перенес острую респираторную вирусную инфекцию. Все НЯ расценивались исследователями как не связанные с терапией, имели легкую степень тяжести, не требовали отмены терапии и завершились выздоровлением.
Обсуждение. В статье представлены результаты Всероссийской наблюдательной программы АТЛАНТ, посвященной изучению возможностей применения препарата Афалаза в терапии СНМП на фоне ДГПЖ у пациентов, перенесших COVID-19.
В программу АТЛАНТ были включены 73 пациента с СНМП/ДГПЖ, ранее перенесших COVID-19, в возрасте 46–65 лет. Все участники получали препарат Афалаза по 2 таблетки 2 раза в сутки в течение 16 нед. в режиме монотерапии.
На фоне лечения значимо уменьшилась симптоматика СНМП, по данным опросника IPSS, начиная с 4 нед. применения препарата Афалаза. Средние значения суммарного балла IPSS на этапе включения в программу и через 4, 12 и 16 нед. составили 21,6±8,6, 14,8±3,7, 7,4±2,9, 6,4±2,4 балла соответственно (p<0,0001 для каждого из визитов). Среднее снижение суммарного балла по шкале IPSS через 16 нед. терапии составило 17,5±9,4 балла (70,4%). Отдельно была проанализирована динамика симптомов наполнения и опорожнения при оценке по соответствующим подшкалам опросника IPSS (через 16 нед. среднее снижение значений составило 7,9±4,3 (66,0%) и 9,4±5,6 балла (73,9%) соответственно.
Стратификация пациентов по срокам перенесенного COVID-19 позволила сделать ряд интересных наблюдений и выводов. Были выявлены выраженные различия клинического течения СНМП/ДГПЖ в зависимости от давности COVID-19. В подгруппе пациентов, перенесших инфекцию в пределах 1 мес. до включения в программу (т.е. в остром периоде COVID-19), регистрировались максимальные значения среднего балла IPSS до начала лечения – 30,8±1,7 балла. У пациентов, находившихся в периоде последствий COVID-19 (3–6 и более 6 мес. от выявления инфекции), эти значения были существенно ниже: 16,6±6,4 и 14,8±2,0 балла соответственно. Проведенный корреляционный анализ давности заболевания COVID-19 и выраженности СНМП (на основании опросника IPSS) на этапе включения пациента в программу подтвердил наличие достоверной отрицательной корреляции: в более ранний период после инфекции СНМП были выражены сильнее. Это наблюдение подтверждают данные литературы о негативном влиянии COVID-19 на течение СНМП/ДГПЖ. В исследовании Н. Nabeeh et al., 2021, проанализирована клиническая динамика СНМП у 50 пациентов с ДГПЖ в течение 3 мес. заболевания COVID-19 по сравнению с исходной симптоматикой [3]. Средний балл IPSS при выявлении COVID-19, через 1 и 3 мес. наблюдения составил соответственно 26,6±5,8 б, 25,4±5,9, 25,1±6,3 балла по сравнению со значением до заболевания 13,4±4,3 балла [3]. То есть при заболевании COVID-19 у пациентов с ДГПЖ произошло нарастание СНМП практически в 2 раза с последующим постепенным уменьшением симптомов в подостром периоде (1–3 мес.). В программе АТЛАНТ при сравнении среднего балла IPSS у пациентов в острой стадии инфекции и через 6 мес. после нее также наблюдалось отличие в 2,1 раза, что дополнительно позволяет предположить, что последствия COVID-19 в отношении СНМП/ДГПЖ сохраняются как минимум до полугода.
Также при анализе в подгруппах с разной давностью COVID-19 показано, что у пациентов, перенесших инфекцию в течение 0–2 мес. до включения в программу, отмечалось максимальное снижение СНМП – на 78,2– 80,5% за 16 нед. терапии. Если провести параллель с приведенными выше данными Н. Nabeeh et al., то за 3 мес. у пациентов с СНМП/ДГПЖ и COVID-19 средний балл IPSS снизился всего лишь на 5,6% (с 26,6 до 25,1 балла) против 79,5% (с 30,8 до 6,3 балла) у участников программы АТЛАНТ, перенесших COVID-19 менее 1 мес. до включения. [3]. Это наблюдение достаточно убедительно демонстрирует, что у пациентов с СНМП/ДГПЖ, получавших терапию, регресс симптоматики происходит значительно эффективнее, чем в отсутствие лечения.
По данным корреляционного анализа, в отличие от достоверной обратной зависимости давности перенесенной инфекции и среднего балла IPSS на визите включения и через 4 нед. терапии, те же показатели через 12 и 16 нед. коррелировали достоверно положительно. То есть к 4-му месяцу после COVID-19 динамика СНМП на фоне лечения становилась более плавной по сравнению с начальным периодом, что связано со значительной спонтанной редукцией симптомов в первые 12 нед. после заболевания (стиханием обострения, обусловленного коронавирусной инфекцией). Выявленная закономерность указывает на целесообразность раннего назначения препарата Афалаза.
Если рассуждать о патогенетических аспектах реализации эффектов Афалазы у пациентов с СНМП/ДГПЖ на фоне COVID-19, одной из ключевых точек представляется влияние вируса SARS-CoV-2 на ренин-ангиотензин-альдостероновую систему (РААС) [2]. Так, в обзоре А. Haghpanah et al., 2021, систематизированы данные о негативной роли ангиотензина II в патогенезе обострения СНМП на фоне COVID-19. Описано, что SARS-CoV-2 подавляет активность фермента АПФ-II (ангиотензин-превращающий фактор-II) и снижает продукцию ангиотензина (1–7), в норме оказывающего противоположные ангиотензину II положительные эффекты в ткани предстательной железы: противовоспалительный, антипролиферативный, антиоксидантный, антифибротический, вазорелаксирующий.
В том числе один из путей реализации этого действия – активация эндотелиальной NO-синтазы. Еще один возможный путь влияния SARS-CoV-2 на течение СНМП/ДГПЖ связан с андрогенной системой регуляции, играющей главенствующую роль в пролиферации клеток предстательной железы [2]. При этом простатспецифический антиген является одним из ферментов, активно вовлеченных в функционирование этой системы и реализующих свое действие (антиангиогенное, антипролиферативное и др.) в тесной связи с экспрессией андрогенных рецепторов [12]. Таким образом, основываясь на знаниях о механизме действия препарата Афалаза, можно утверждать, что его эффективность в отношении редукции обострения СНМП, вызванного COVID-19, патогенетически обоснована. Препарат способствует нормализации эндогенных регуляторных процессов в ткани простаты, нарушенных вирусом SARS-CoV-2, как минимум в двух важнейших си-стемах – андрогенной и ренин-ангиотензин-альдостероновой, тем самым ускоряя регресс СНМП на фоне COVID-19.
Также в программе анализировалась динамика качества жизни пациентов, оцененная на основании опросника EQ-5D. Было продемонстрировано, что через 16 нед. этот показатель улучшился в среднем на 85,3% (-3,5±2,2 балла по опроснику EQ-5D). В литературных источниках многие авторы утверждают о влиянии COVID-19 на качество жизни пациентов с СНМП/ДГПЖ, однако конкретные статистические данные по этой проблеме не приводятся [2, 3, 5].
Исследования влияния COVID-19 на эректильную функцию также представлены в основном научными обзорами. Многофакторность патогенеза ЭД на фоне пандемии – от вызываемой вирусом эндотелиальной дисфункции и микроциркуляторных нарушений до психосоциальных факторов стресса – затрудняет методы ее оценки в клинических исследованиях. По данным Е. Bulut et al. выявлены значительные нарушения эректильной функции у лиц, вовлеченных в борьбу с пандемией COVID-19: средний балл МИЭФ-5 составил 13 баллов (vs 21 балл в контрольной группе) [13]. В программе АТЛАНТ получены схожие данные: значение среднего балла МИЭФ-5 в ходе лечения увеличилось с 15,3±3,1 балла до уровня, соответствовавшего норме (22,2±2,6 балла). В отечественном исследовании Д. В. Ергакова и А. Г. Мартова рассматривались возможности оптимизации медикаментозного лечения СНМП/ДГПЖ в условиях пандемии COVID-19 [14]. При более эффективной коррекции СНМП (замена препарата из группы ингибиторов 5-альфа-редуктазы на комбинацию альфа-адреноблокатора и холинолитика) у пациентов одновременно отмечалось улучшение эректильной функции – с 16,3 до 18,3 балла по шкале МИЭФ-5 через 3 мес. терапии, достигая уровня статистической значимости через 6 мес. (18,9 балла). В программе АТЛАНТ эректильная функция, оцененная по опроснику МИЭФ-5, улучшалась более отчетливо: в среднем на 5,9±3,7 балла через 12 нед. терапии (p<0,0001), однако во многом это могло было быть связано с естественным регрессом симптоматики, вызванной COVID-19. Так, например, в исследовании [10] средний балл по шкале МИЭФ-5 у пациентов с СНМП/ДГПЖ через 12 нед. терапии Афалазой повысился на 2,5±3,8 балла, что, тем не менее, демонстрирует высокий уровень статистической достоверности (p<0,0001). Полученные данные свидетельствуют о положительном влиянии препарата Афалаза на качество эректильной функции у пациентов с СНМП/ДГПЖ, перенесших COVID-19.
В программе АТЛАНТ показана хорошая переносимость препарата Афалаза: НЯ были отмечены у 9 (12,3%) участников. Все НЯ, по мнению врачей, не имели связи с исследуемой терапией и не требовали ее отмены, не удовлетворяли критериям серьезности, носили характер легких.
Резюмируя вышесказанное, результаты наблюдательной программы АТЛАНТ могут представлять ценность для практикующего врача-уролога при выборе тактики ведения пациентов с СНМП/ДГПЖ, перенесших COVID-19. Так, в программе показано, что COVID-19 имеет существенное негативное влияние на СНМП/ДГПЖ, максимально выраженное в остром и подостром периодах инфекции, и постепенно нивелирующееся примерно в течение полугода. Продемонстрирован более выраженный регресс урологической симптоматики у пациентов с COVID-19, получавших препараты для ее коррекции, чем у пациентов без лечения, при этом раннее начало терапии ассоциировалось с достоверно более выраженным результатом через 16 нед. Данные программы АТЛАНТ представляют доказательства эффективности и безопасности препарата Афалаза, полученные из реальной клинической практики лечения пациентов с СНМП/ДГПЖ, перенесших COVID-19. Таким образом, в отличие от большинства лекарственных средств, традиционно применяемых при СНМП/ДГПЖ, Афалаза может стать препаратом аргументированного выбора для терапии указанной группы пациентов.
С учетом имеющихся ограничений программы, таких как субъективность методов оценки симптомов, относительно небольшие срок наблюдения и размер выборки пациентов, отсутствие рандомизированных и ослепленных групп сравнения, выводы в статье носят предположительный характер и требуют дальнейшего уточнения в последующих рандомизированных клинических исследованиях и наблюдательных программах.



