Введение. Проблема мужского здоровья, а также диагностика причин мужского бесплодия остаются многоплановыми и довольно актуальными, с каждым годом привлекая все большее внимание исследователей и имея существенное значение для современной урологии, андрологии и репродуктологии.
Несмотря на большие научно-практические достижения в вышеперечисленных областях медицины, молекулярные основы формирования фертильности еще недостаточно раскрыты, во многом остаются не выясненными причины ее нарушения. Актуально в этом плане исследование биохимических компонентов урогенитального тракта мужчин как фактора регуляции процесса апоптоза половых клеток, поскольку индукция или торможение апоптоза могут лежать в основе нарушения фертильности у мужчин [1, 2].
Среди таких биомолекул известны полиамины (ПА) – низкомолекулярные органические эндогенные поликатионы, играющие важную роль в репродуктивных процессах человека и содержащиеся во всех биологических жидкостях урогенитального тракта мужчин [3].
Полиамины – нормальный компонент мочи здоровых людей (с мочой в среднем выделяется от 2 до 10 мг в сутки). Уровень ПА в моче у мужчин и женщин одинаков. Концентрация ПА в моче изменяется при некоторых патологических процессах: снижение экскреции ПА наблюдается у больных почечной недостаточностью; увеличение содержания ПА выявлено в малодифференцированных карциномах по сравнению с высокодифференцированными при исследовании опухолей почек человека [4].
В половом тракте мужчин ПА синтезируются в яичках сперматогенными клетками, клетками Сертоли и Лейдига, где их концентрация увеличивается в период полового созревания. Полиамины необходимы для сперматогенеза, со стадиями которого коррелирует их синтез. Отсутствие или недостаток ПА приводит к бесплодию, однако их избыточное накопление токсично для клеток. Полиамины активируют стероидогенез в яичках, а подавление их синтеза в ответ на кастрацию животных коррелирует с уменьшением синтеза ДНК в семенных пузырьках [3].
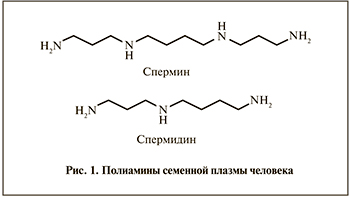 К ПА семенной плазмы человека, которая формирует фоновую фертильность эякулята, создавая благоприятные условия для оптимального выполнения сперматозоидами прокреативной функции, относятся спермин и спермидин (рис. 1).
К ПА семенной плазмы человека, которая формирует фоновую фертильность эякулята, создавая благоприятные условия для оптимального выполнения сперматозоидами прокреативной функции, относятся спермин и спермидин (рис. 1).
До настоящего времени ПА как низкомолекулярные компоненты семенной жидкости человека малоизучены. Однако с учетом их важной роли в обмене нуклеиновых кислот нормальный метаболизм этих соединений необходим для формирования оплодотворяющих свойств спермы [4, 5].
Содержание свободных ПА в семенной плазме и секрете предстательной железы человека существенно выше, чем в любой другой физиологической жидкости организма, что указывает на чрезвычайную важность ПА для мужской репродуктивной функции. Так, в секрете предстательной железы фертильных мужчин средняя концентрация спермина составляет 6525 нмоль/мл, спермидина – от 206,6 до 2548,2 нмоль/мл; в семенной плазме фертильных мужчин содержание спермина варьируется от 138,4 до 21749,9, а спермидина – от 17,9 до 1170,8 нмоль/мл. Для сравнения: уровень ПА в крови очень низкий и не превышает 1 нмоль/мл [3].
Спермин вырабатывается предстательной железой и придает эякуляту характерный специфический запах, способен стимулировать половые функции. Полиамины участвуют в стабилизации структуры ДНК сперматозоидов. Нормальный метаболизм ПА необходим для регуляции рН семенной плазмы и становления функциональной зрелости гамет. Обладая бактериостатическими свойствами, ПА защищают урогенитальный тракт от инфекционных агентов. Спермин и, возможно, спермидин являются природными акцепторными аминами семенного трансглутаминазного действия, тем самым ослабляя сшивание белков и преждевременное свертывание эякулята [3, 6, 7].
Полиамины семенной жидкости по-разному влияют на различные звенья фертилизации сперматозоидов: в физиологических концентрациях спермидин увеличивает скорость гамет и число прогрессивно подвижных форм, а спермин препятствует агглютинации и агрегации сперматозоидов [3, 6]. Есть данные, согласно которым спермин способен активизировать подвижность неподвижных гамет, взятых из семявыносящего протока у животных [1, 8].
Механизмы, при помощи которых ПА влияют на подвижность, неизвестны, но благодаря исследованиям in vitro можно заключить, что существует несколько путей регуляции с участием ПА, связанных с внутриклеточной сигнализацией и энергетическим метаболизмом. Например, присутствие спермина и спермидина в культуральной среде улучшает гликолиз у зрелых гамет крысы, выделенных из эпидидимиса, стимулирует аденилатциклазу у сперматозоидов быка и человека [9].
Известно, что у сперматозоидов мужчин с олигоастенозооспермией (у которых ферментативная активность тройной аденозинтрифосфатазы [АТФазы] меньше, чем у сперматозоидов фертильных мужчин) увеличение подвижности под действием ПА связано со способностью последних повышать активность АТФазы [1].
Более высокий процент положительного исхода при искусственном оплодотворении получен при использовании сперматозоидов из придатка, предварительно инкубированных в присутствии спермина [9].
Выявлено, что у животных спермин локализуется преимущественно в акросомальной области сперматозоида и, вероятно, участвует в контроле инициации акросомальной реакции. Последняя может индуцироваться при недостатке спермина при капацитации, в то время как повышение концентрации этот эффект ингибирует. Таким образом, спермин – декапацитирующий фактор в эякуляте, предотвращающий преждевременную капацитацию и акросомальную реакцию [1, 3].
Вероятно, ПА, связываясь с участками мембран сперматозоидов, участвуют в процессах регуляции структурной целостности цитоскелета, способствуя «расплавлению» мембран сперматозоидов во время процесса оплодотворения [9].
При различных формах субфертильности наблюдается изменение концентрации ПА в эякулятах [3, 6].
Превышение уровня ПА в семенной жидкости выше физиологического уровня способно губительно влиять на мужские половые клетки, вызывая снижение подвижности сперматозоидов. Так, выявлены повышение уровня спермина и отношения спермин/спермидин в сперме мужчин с большим количеством мертвых гамет [6]. Однако снижение уровня ПА может также инициировать гибель клеток [2, 3, 10].
Утрата клеткой жизнеспособности может быть результатом одного из видов клеточной гибели – апоптоза. Вероятнее всего, уровень ПА в семенной жидкости мужчин может быть одним из факторов регуляции процесса апоптоза клеток [2, 11–13].
Апоптоз характеризуется стадиеспецифическими изменениями морфологии и биохимии клетки, происходящими как в ядре, так и в клеточной мембране сперматозоида. Выражением биохимических изменений в мембране могут быть, в частности, изменения в динамике липидов.
Одним из ранних биохимических признаков начавшегося апоптоза является перемещение (экстернализация) фосфатидилсерина (ФС) на внешнюю сторону ее мембраны. Фосфолипид ФС, локализуясь на клеточной поверхности в процессе апоптоза, формирует специфический сигнал для распознавания апоптотической клетки [2].
Экстернализацию ФС при апоптозе можно детектировать при помощи белка Аннексина-V (AnV), коньюгированного с флуорохромом, в комбинации с катионным красителем йодидом пропидия (PI). Живые гаметы не связывают AnV и непроницаемы для катионного красителя PI. На ранней стадии апоптоза сперматозоиды связывают AnV, но, как и живые гаметы, непроницаемы для PI, поэтому расцениваются как AnV-положительные/PI-отрицательные, т.е. (AnV+/PI-)-сперматозоиды. Мертвые клетки проницаемы для PI [11, 14].
К маркерам апоптоза также относится рецептор инициации CD95(Fas), обнаружение которого на клетках свидетельствует о готовности клетки вступить в апоптоз по рецепторному механизму при взаимодействии с инициирующим молекулярным компонентом – лигандом CD95L (FasL). CD95-рецепторно-лигандная система используется при управлении апоптозом в процессе сперматогенеза: в регуляции численности сперматогенных клеток и обеспечении удаления поврежденных гамет [15, 16].
Однако в норме апоптоз не должен запускаться в эякуляторных сперматозоидах, поскольку их цель – формирование нового организма, продолжение жизни и для них важна длительная жизнеспособность [2, 11].
Учитывая возможность ПА выступать в качестве факторов, координирующих процесс апоптоза, представляло интерес сравнить содержание ПА в семенной плазме мужчин разной фертильности и выявить: есть ли связь между их уровнем в сперме и наличием маркеров апоптоза у гамет? Это и стало целью исследования.
Материалы и методы. Были изучены эякуляты от 34 здоровых фертильных мужчин и 40 бесплодных пациентов с разными формами субфертильности, давших согласие на проведение исследований. Возраст всех обследованных мужчин варьировался от 22 до 40 лет. Сбор эякулятов проводился после 72 ч сексуального воздержания. Оценку показателей стандартной спермограммы проводили в соответствии с нормативами ВОЗ 5-го издания от 2010 г. [17].
Образцы эякулятов после разжижения и анализа на физико-химические и морфофункциональные критерии качества центрифугировали 15 мин при 12 тыс. об/мин для отделения сперматозоидов от семенной плазмы, которую использовали для определения содержания в ней свободных ПА.
Определение спермина и спермидина в семенной плазме мужчин проводили запатентованным способом (патент на изобретение RUS № 2225981 от 28.02.2002), экстрагируя ПА н-бутанолом (1:1) при рН=10,0 в течение 1 ч, выпаривая ПА из бутанольной фазы с последующим электрофоретическим разделением в 1,5%-ном агаровом геле в течение 1 ч при комнатной температуре в 0,1 М лимоннокислом буфере (рН=3,4–3,6) при напряжении 200 В и силе тока 40 мА. Полиамины проявлялись в виде розовато-фиолетовых пятен после окраски нингидриновым красителем. Идентифицировали фракции ПА при помощи стандартных препаратов («Fluka», Швейцария) [6].
Количественное определение фракций ПА проводили, сканируя электрофореграммы на сканере, полученный материал переводили в цифровой формат на ПЭВМ с помощью запатентованной специальной компьютерной программы «ПН 5108» (Свидетельство о регистрации программы для ЭВМ RUS 2003612170 от 21.07.2003), получали денситограммы ПА. Концентрации спермина и спермидина рассчитывали по калибровочным графикам, выражающим зависимость площадей пиков денситограмм, соответствующих пятен стандартных препаратов ПА от содержания последних [6].
Сперматозоиды, отделенные от семенной плазмы, отмывали в фосфатно-солевым буфере (pH=7,4) и определяли наличие у них маркеров апоптоза. Для определения ФС использовали аннексиновый метод, окрашивая гаметы AnV-FITC и PI (BD, США), согласно инструкции изготовителя. Отношение количества (AnV+/PI–)-сперматозоидов к общему количеству гамет в мазке выражали в процентах [18–20].
Для обнаружения CD95 использовали меченные фикоэритрином (РЕ) моноклональные антитела CD95 (CD95-РЕ, IgG1, Caltag Lbs.), согласно инструкции производителя [15]. Все микроскопические исследования проводили на флуоресцентном микроскопе «МИКРОМЕД 3 ЛЮМ» (Санкт-Петербург).
Статистическую обработку данных выполняли с использованием программы «Statistica 6.1 for Windows» (StatSoft Inc.) и EXСEL-2007. После проверки распределения на нормальность статистическую значимость различий сравниваемых величин оценивали с помощью t-критерия Стьюдента при значении р<0,05. Данные представлены в виде М±m. Взаимосвязь исследуемых показателей оценивали путем расчета коэффициента корреляции (r) Пирсона.
Результаты. Использованный нами электрофоретический метод в агаровом геле дал возможность быстро и четко, без образования «хвостов», полностью разделить смесь ПА на фракции спермина и спермидина и получать их уже в виде отдельно расположенных зон (пятен), обеспечив хорошее окрашивание и последующее высушивание агаровых пластинок, показав достаточно высокую воспроизводимость результатов, одновременно являясь простым и доступным для практического использования. После сканирования электрофореграмм на ПЭВМ имеется возможность длительно хранить изображения без потери качества, благодаря чему можно сравнить образцы между собой.
Разработанным способом было проведено исследование содержания спермина и спермидина в семенной плазме мужчин разной фертильности (рис. 2, 3).

Результаты исследования показали, что процентное содержание спермина и спермидина в семенной плазме бесплодных пациентов ниже, чем у фертильных мужчин (р<0,001): концентрация спермина ниже почти в 2 раза, спермидина – почти в 7 раз. Однако отношение спермин/спермидин оказалось в 4 раза выше, чем у здоровых мужчин (см. таблицу).

Применение «аннексинового» метода позволило выявить, что у субфертильных мужчин процентное содержание (АnV+/PI–)-сперматозоидов в эякулятах почти в 2 раза выше, чем у фертильных (см. таблицу).
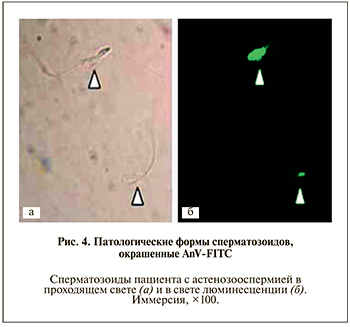 На рис. 4 показаны атипичные сперматозоиды с признаками экстернализации ФС, окрашенные АnV-FITC.
На рис. 4 показаны атипичные сперматозоиды с признаками экстернализации ФС, окрашенные АnV-FITC.
Результаты определения другого биомаркера – рецептора инициации апоптоза CD95 тоже выявили различия в экспрессии этого антигена на поверхности мембраны сперматозоидов между фертильными и субфертильными пациентами. Оценивая экспрессию CD95, следует отметить, что это маркер готовности клетки к рецепторному апоптозу и его выявление не служит доказательством апоптоза. Подтверждением стало отсутствие корреляции между количеством (CD95+)- и (AnV+)-сперматозоидов в эякулятах мужчин разной фертильности (р>0,05), а по данным литературы, и отсутствие корреляции с фрагментацией ДНК гамет [21].
Установлено, что у субфертильных мужчин число (CD95+)-сперматозоидов в эякулятах в 3 раза выше, чем у фертильных доноров (см. таблицу).
Для выявления связи между уровнем спермина и спермидина в семенной плазме и наличием маркеров апоптоза у сперматозоидов был проведен корреляционный анализ, который выявил связь между экстернализацией ФС у гамет и концентрацией сермина в семенной плазме: так, между содержанием (АnV+/PI-)-сперматозоидов в эякулятах бесплодных пациентов и уровнем спермина спермоплазмы установлена положительная корреляция (r=0,5; р<0,01).
Обсуждение. Полученные данные согласуются с таковыми других исследователей о том, что процентное содержание мужских половых клеток с маркерами апоптоза в эякулятах у бесплодных пациентов выше, чем у мужчин с нормозооспермией [22, 23]. Кроме того, есть данные, согласно которым около 20% эякуляторных сперматозоидов мужчин с различными параметрами спермограммы при исследовании выявляются и аннексиновым методом, и методом TUNEL как апоптотические [24].
Нарушение фертильности у мужчин может быть связано с нарушением биохимического гомеостаза семенной плазмы, в частности, как доказывают результаты нашего исследования, с изменением уровня ПА в семенной жидкости. На фоне общего снижения концентрации ПА в эякуляте у бесплодных мужчин наблюдается изменение соотношения спермина и спермидина в сторону преобладания Сп в семенной жидкости. Это в свою очередь служит инициирующим фактором для запуска процесса апоптоза у гамет, ранним доказательством которого является изменение в динамике липидов мембраны клетки и переориентация ФС на ее внешнюю сторону.
Известно, что ПА способны к транспорту внутрь клеток, где они участвуют (особенно спермин) в стабилизации мембран и в модулировании метаболизма связанных с мембранами ферментов [3, 4, 9].
Полиамины обладают способностью регулировать поток Ca2+ через мембрану, уменьшая пороговый уровень этих ионов в клетке [25]. Изменение уровня ПА может повлечь изменение потоков Ca2+ через мембрану клетки, увеличение концентрации которого приведет к нарушению существующей в живой клетке фосфолипидной асимметрии клеточной мембраны и накоплению ФС в ее наружном слое. Известно об увеличении содержания спермина в стареющих клетках [3, 6].
Так, нами ранее на клеточной модели лимфоцитов периферической крови человека были подтверждены схожесть воздействия спермина и спермидина при более выраженной апоптотической активности спермина и разнонаправленность действия повышенных и физиологических доз ПА: физиологические концентрации ПА вызывают антиапоптический эффект, а повышенные дозы инициируют экстернализацию ФС [26].
Однако механизм регуляции апоптоза этими биологически активными веществами может иметь и опосредованный характер, так как известна способность ПА связываться с индукторами апоптоза половых клеток – свободными радикалами [14, 27, 28].
Известно, что у мужчин при патоспермии независимо от ее вида по сравнению с нормозооспермией в семени увеличивается интенсивность процессов перекисного окисления липидов и происходит снижение мощности антиоксидантной защиты [29–31]. С этой позиции, возможно, объясним тот факт, что на фоне пониженной концентрации ПА в семенной плазме бесплодных мужчин наблюдается больше сперматозоидов с маркерами апоптоза по сравнению с фертильными донорами.
Заключение. Результаты нашего исследования подтверждают данные, согласно которым ПА служат необходимым фактором фертилизации сперматозоидов, указывая на важность данных соединений в нормальном функционировании мужской репродуктивной системы. Эффекты ПА на клеточном уровне достаточно активно изучаются, однако еще мало сведений о молекулярных механизмах, посредством которых ПА влияют на клеточные процессы, особенно репродуктивных, и воздействия на гаметы [32–34]. Данные, полученные в этом исследовании, подтверждают, что одной из основных внутриклеточных мишеней ПА служит программа апоптоза.
С учетом структурных особенностей и поликатионной природы этих биологически активных веществ спермин и спермидин семенной плазмы активно участвуют в формировании оплодотворяющих свойств эякулята, а механизм действия ПА очень зависим от их концентрации. Изменение концентрации ПА в семенной жидкости мужчин служит одним из факторов регуляции процесса апоптоза половых клеток. Очевиден отрицательный эффект изменения в соотношении спермина и спермидина в семенной жидкости мужчин вследствие сбоев в регуляции их синтеза [35–37].
Таким образом, ПА – не просто биологически активные вещества, участвующие в становлении функциональной зрелости сперматозоидов, а фундаментальные механизмы, направленные на контроль и регуляцию жизнеспособности гамет. Все это подтверждает высокую активность ПА на клеточном уровне и служит основанием для дальнейшего обсуждения возможных механизмов действия спермина и спермидина на гаметы, а также делает ПА не просто объектом исследования, но и возможным инструментом для применения в урологии и андрологии.
Определение содержания ПА в семенной плазме мужчин может быть рекомендовано для повышения информативности исследования причин нарушения фертильности эякулята за счет более детального изучения биохимического состава спермоплазмы. Кроме того, определение маркеров апоптоза у сперматозоидов расширит диагностический арсенал при оценке репродуктивной функции мужчин. Полученные результаты исследования будут полезными в разработке алгоритма обследования бесплодных пациентов, что особо значимо для супружеских пар, имевших неудачи в программах вспомогательных репродуктивных технологий.



