Ряд заболеваний и повреждений мочевыводящих путей (МВП) может приводить к их необратимым деструктивным изменениям [1, 2]. При особо тяжелых состояниях в патологический процесс вовлекается один или оба мочеточника на большом протяжении и мочевой пузырь (МП). В таких случаях только сложная заместительная кишечная пластика позволяет восстановить пассаж мочи, избавить пациентов от мочевых свищей и сохранить функцию почек. Лучшим пластическим материалом при этом является подвздошная кишка [3–5].
Мы располагаем опытом желудочно-кишечной реконструкции МВП у 557 больных. В качестве пластического материала сегменты желудка были использованы у 24 (4,3%) человек, сегменты подвздошной кишки – у 477 (85,6%), червеобразный отросток – у 27 (4,8%) и участки толстой кишки – у 29 (5,2%) больных. Кишечная и аппендикулярная пластика мочеточников проведена 196 (35,2%) пациентам, МП – 304 (54,6%), одновременная пластика мочеточников и МП – 57 (10,2%). В целом нам приходилось одновременно замещать разные отделы мочеточников и МП или выполнять тотальную двустороннюю пластику мочеточников [6]. Однако мы впервые столкнулись с ситуацией, требующей полного замещения обоих мочеточников и МП, возникшей в результате сочетания у пациентки двух редких заболеваний: интерстициального цистита с исходом в сморщивание МП и тяжелой формы болезни Ормонда.
Приводим данное клиническое наблюдение.
Пациентка Н. 63 лет поступила в нашу клинику в плановом порядке 23.09.2019 с жалобами на наличие нефростомических дренажей с обеих сторон.
Из анамнеза известно, что с 2011 г. стала отмечать учащенное мочеиспускание. Обследовалась и лечилась с диагнозом «интерстициальный цистит», который был подтвержден гистологически. Медикаментозная терапия и неоднократные гидробужирования МП не давали эффекта, и к 2017 г. сформировался микроцистис. Частота мочеиспусканий достигла 70 раз в сутки. Периодически стали беспокоить боли в поясничной области. Установлена гидронефротическая трансформация с обеих сторон. В мае 2018 г. была экстренно госпитализирована в областную больницу по месту жительства с жалобами на повышение температуры тела до 39°C, озноб, сухость во рту, отсутствие мочи. Диагностирована постренальная анурия в результате болезни Ормонда. Выполнена чрескожная перкутанная нефростомия с обеих сторон. Проведена дезинтоксикационная терапия. Состояние пациентки улучшилось, нормализовались лабораторные показатели. Больная была выписана на амбулаторное лечение, затем направлена в нашу клинику.
При поступлении: состояние удовлетворительное, температура тела нормальная, гемодинамика стабильная, живот мягкий, умеренно болезненный в нижних отделах. Нефростомические дренажи функционируют. Суточный диурез – 1600–1800 мл. В клиническом анализе крови от 24.09.2019: эр. – 4,82•1012/л; Hb – 132 г/л; л. – 6,23•109/л. Биохимический анализ крови: АлАТ – 9 ЕД/л, АсАТ – 12 ЕД/л, креатинин – 105 мкмоль/л, общий белок – 85,5 г/л, глюкоза – 6 ммоль/л. Общий анализ мочи: реакция кислая; белок – 1,2 г/л; эритроциты – 100–150 в поле зрения; лейкоциты – 20–30–40 в поле зрения. По данным цистографии, объем МП около 15 мл (рис. 1). Мультиспиральная компьютерная томография с антеградным контрастированием выявила двустороннюю облитерацию мочеточников (рис. 2). Забрюшинная клетчатка уплотнена до 38 HU. Объем МП – 17 мл, стенка МП утолщена до 12 мм. Диагностированы интерстициальный цистит с исходом в микроцистис и тяжелая форма болезни Ормонда с поражением обоих мочеточников на всем протяжении.
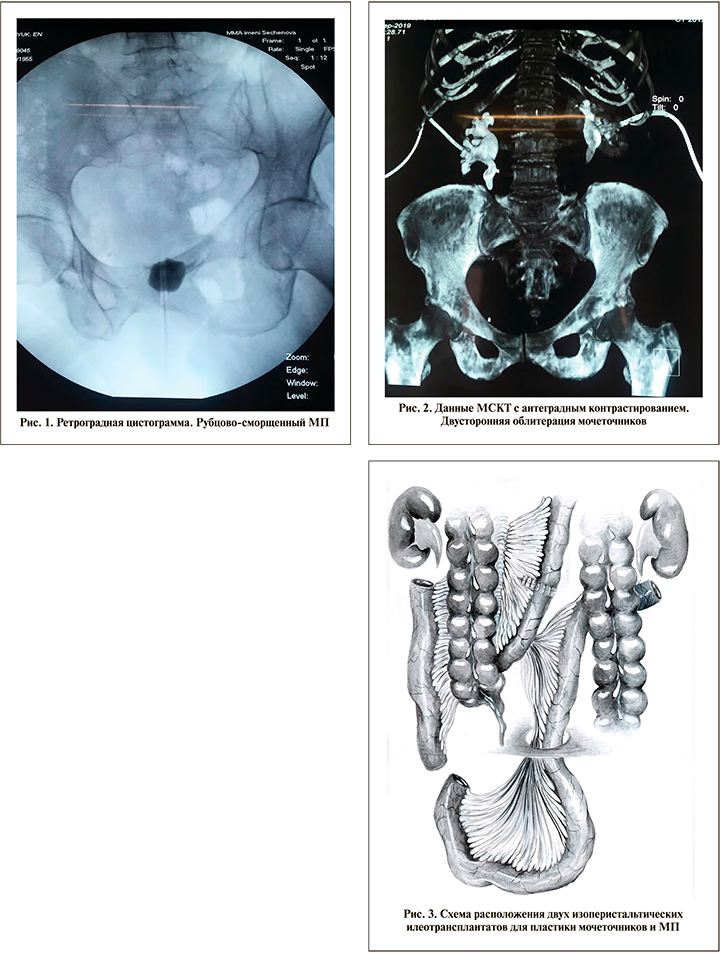
25.09.2019 бригадой урологов проведена операция. Выполнена нижнесрединная лапаротомия. При ревизии: МП резко уменьшен и представляет собой плотный рубцовый конгломерат; забрюшинная клетчатка с обеих сторон инфильтрирована, уплотнена; мочеточники с трудом дифференцируются, имеют тонкие стенки с участками рубцовых изменений. Органы брюшной полости без патологии. Проведена цистэктомия с удалением правого и большей части левого деструктивно измененных мочеточников. Затем, с отступом 20 см от илеоцекального угла резецирован сегмент подвздошной кишки длиной около 90 см. Проходимость кишки восстановлена аппаратным швом. Трансплантат разделен на два неравных участка: проксимальный, расположенный выше межкишечного анастомоза длиной 25–30 см, и дистальный ниже межкишечного анастомоза длиной 55–60 см. Короткий илеотрансплантат в изоперистальтическом положении проведен через брыжейку восходящего отдела толстой кишки в правый боковой канал. Проксимальный конец более длинного J-образного илеотрансплантата, предназначенного для замещения левого мочеточника и формирования артифициального МП, заглушен и выведен в забрюшинное пространство к области ворот левой почки, где временно фиксирован (рис. 3).
Нижний конец данного трансплантата через отверстие в париетальной брюшине проведен в малый таз, где из него с помощью сшивающего аппарата сформирован Y-образный неоцистис. Через уретру в него заведен интубатор и катетер Фолея. Сформирован уретрорезервуарный анастомоз узловыми швами викрилом 2/0. Правый антиперистальтический недетубуляризированный участок артифициального МП длиной примерно 7 см аппаратным швом соединен с изоперистальтически расположенным правым трансплантатом на полихлорвиниловом интубаторе 10 Ch. Проксимальный конец его анастомозирован с лоханкой правой почки узловыми швами викрилом 3/0. Брюшная полость ушита. Малый таз дренирован, рана послойно ушита. Пациентка переведена в положение на правом боку. Разрезом в 11-м межреберье слева вскрыто забрюшинное пространство. Тупо и остро с поэтапным гемостазом вместе с плотной фиброзно-измененной жировой клетчаткой выделены левая почка, лоханка и рубцово-измененная оставшаяся верхняя часть левого мочеточника. Последний удален вместе с забрюшинной клетчаткой. Через нефростомический свищ проведены почечный дренаж и интубатор. Брюшная полость вскрыта, проксимальный конец левого кишечного трансплантата выведен в забрюшинную рану, на интубаторе сформирован пиелоилеоанастомоз узловыми швами викрилом 3/0 (рис. 4). Длительность операции – 6 ч 55 мин. Кровопотеря – 500 мл.
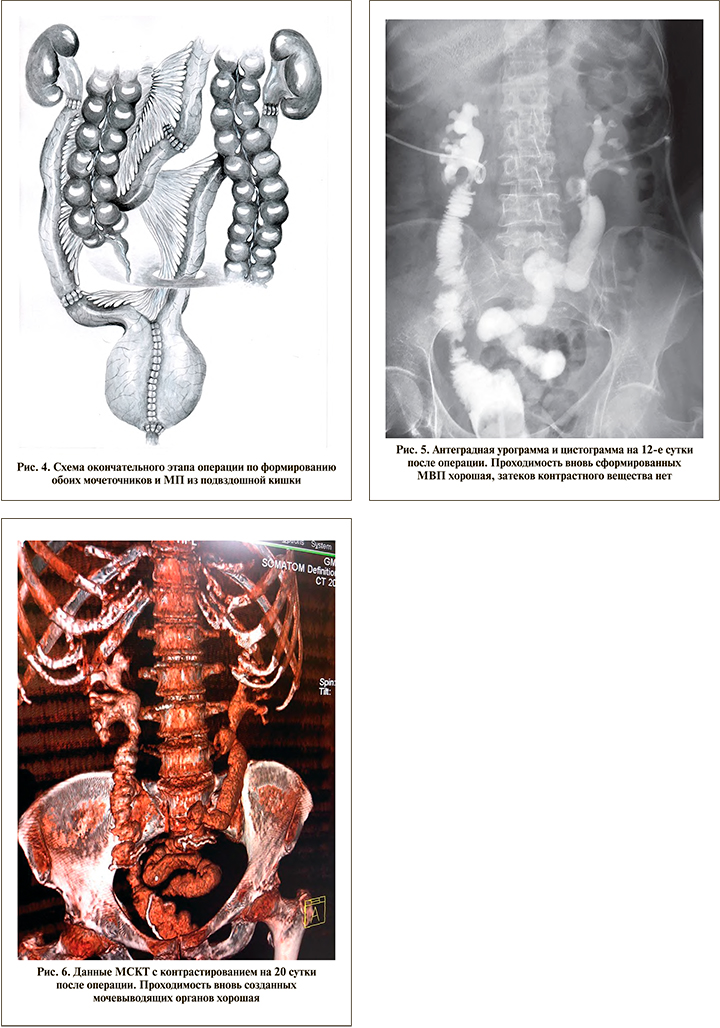
В течение 2 сут. после операции пациентка находилась в отделении общей реанимации. Получала антибактериальную, инфузионную, противовоспалительную, детоксикационную терапию, проводилась гемотрансфузия, стимуляция кишечной деятельности, коррекция гипопротеинемии. С 3-х суток стала получать питательные детские смеси, с 4-х – диету (стол) № 9. На 10-е сутки выявлен метаболический ацидоз (ВЕ – 6,9 ммоль/л, К+ – 4,6 ммоль/л, рН – 7,29, НСО3 – 19,2 ммоль/л, рСО2 – 40 мм рт.ст.). Проведена коррекция электролитных нарушений (ацидоза) 10%-ным раствором гидрокарбоната натрия и электролитными смесями с положительным эффектом. На 12-е сутки выполнены антеградная урография и цистография (рис. 5). Проходимость вновь сформированных МВП хорошая, затеков контрастного вещества нет. На следующий день удалены интубаторы и катетер Фолея, а еще через 2 сут. – нефростомические дренажи. Восстановилось самостоятельное мочеиспускание, недержания мочи нет. На 20-е сутки после операции выполнена МСКТ почек и сформированных из тонкой кишки МВП с контрастированием (рис. 6). Проходимость вновь созданных мочевыводящих органов хорошая. Гистологическое заключение от 26.09.2019: микроцистис. Хронический интерстициальный цистит, неактивная фаза. Хронический двусторонний уретерит минимальной степени активности. Фиброз периуретеральной жировой клетчатки с очаговой лимфоцитарной инфильтрацией. 15.10.2019 пациентка в удовлетворительном состоянии выписана на амбулаторное лечение.
В течение 1 мес. получала следующее лечение: по 10 г сухого порошка соды, разведенного в стакане теплой воды, ежедневно; панангин по 1 таблетке 2 раза в день, леспенефрил по 1 столовой ложке 3 раза в день, АЦЦ лонг по 1 таблетке в день, фитомочегонные.
Через 3 мес. после операции обследована в клинике. Жалобы на небольшую слабость. Мочеиспускание самостоятельное до 8 раз в сутки. Клинический анализ крови: эр. – 3,84•1012/л, Hb – 107 г/л, л. – 6,11•109/л; биохимический анализ крови: АлАТ – 15 ЕД/л, АсАТ – 16 ЕД/л, креатинин – 138 мкмоль/л, общий белок – 85,8 г/л, глюкоза – 6,54 ммоль/л; общий анализ мочи: реакция кислая, белок – 0,389 г/л; эритроциты– 4–5 в поле зрения, лейкоциты – 30–35 в поле зрения. Кислотно-основное состояние: ВЕ – 0,3 ммоль/л; К+ – 4,2 ммоль/л; рН – 7,39; НСО3 – 25,4 ммоль/л; рСО2 – 42 мм рт.ст.
Интерстициальный цистит и болезнь Ормонда относятся к редким и до конца не изученным заболеваниям. Первое из них является неспецифическим воспалением МП, по мере прогрессирования которого происходит постепенное рубцовое перерождение его стенки с развитием микроцистиса. Частота встречаемости данного заболевания, по данным разных авторов, варьируется от 10 до 50 на 100 тыс. населения [7, 8]. Диагноз интерстициального цистита устанавливается через 3–4 года от начала заболевания и подтверждается биопсией при характерной гистологической картине. Консервативное лечение его малоэффективно и заключается в назначении антигистаминных препаратов, инстилляции гепарина натрия, диметилсульфоксида, гиалуроновой кислоты и др. Со временем, как правило, наступает рубцовое сморщивание МП, требующее оперативной коррекции.
Еще более редким заболеванием является ретроперитонеальный фиброз, впервые описанный в 1948 г. Ормондом. Это неспецифический воспалительный процесс забрюшинной клетчатки, сопровождающийся образованием фиброзной ткани, которая приводит к сдавлению мочеточников, нижней полой вены, аорты, брыжеечных сосудов и нервных стволов. Болезнь Ормонда встречается с частотой 0,5 случая на 100 тыс. населения. Мужчины болеют в 2 раза чаще, чем женщины. Прогноз зависит от активности склерозирующего процесса и эффективности иммуносупрессивной терапии. Наиболее ранним проявлением заболевания является компрессия мочеточников с развитием гидроуретеронефроза. Таким образом, интерстициальный цистит и болезнь Ормонда являются разными нозологическими формами с различной характерной морфологической картиной. В литературе отсутствует описание забрюшинного фиброза с такой степенью распространения, которая привела бы к сдавлению МП. Нет также упоминания о сочетании этих двух разных заболеваний у одного пациента. В нашем клиническом наблюдении такое произошло. У пациентки, в течение ряда лет страдавшей интерстициальным циститом, приведшим к сморщиванию МП, появилась клиника двусторонней обструктивной уропатии. Диагностирован ретроперитонеальный фиброз. Длительный временной интервал между началами этих заболеваний и различная гистологическая картина свидетельствуют о наличии у нее двух заболеваний: интерстициального цистита и болезни Ормонда. Такое патологическое состояние привело к деструкции обоих мочеточников и МП, что потребовало их полного замещения подвздошной кишкой. Операция проведена одноэтапно из двух доступов с использованием двух изоперистальтически расположенных илеотрансплантатов.
В литературе мы не нашли описания подобных клинических наблюдений. Технически выполнить такую по объему операцию с хорошим ближайшим результатом оказалось возможным. Тем не менее необходимо тщательно изучить уродинамику таким образом вновь созданных МВП, функцию почек и кислотно-основное состояние в отдаленном послеоперационном периоде. Полученные в поздние сроки данные обследования позволят окончательно судить о целесообразности такого оперативного вмешательства.



