Введение. Синдром болезненного мочевого пузыря/интерстициальный цистит (СБМП/ИЦ) – хроническое состояние мочевого пузыря (МП), характеризующееся постоянным или рецидивирующим ощущением боли в области анатомического расположения органа, сопровождающееся как минимум одним из следующих симптомов: болью, нарастающей при наполнении МП, дневной или ночной поллакиурией или ургентностью при условии отсутствия доказанной инфекции мочевыводящих путей или какой-либо иной явной локальной патологии [1, 2].
В большинстве случаев СБМП/ИЦ сопровождается сексуальной дисфункцией, нарушениями сна и значимым снижением качества жизни [3]. Неоднозначность симптоматики обусловливает большой разброс значений показателей встречаемости данного заболевания, приводимых в литературе. Современные исследования и мета-анализы последних лет свидетельствуют о росте заболеваемости СБМП/ИЦ, составляющей на сегодня 300 случаев на 100 тыс. населения [4]. Эпидемиологические исследования однозначно указывают на превалирование СБМП/ИЦ у женщин: 2,7% против 1,7% у мужчин [5].
Между тем этиология СБМП/ИЦ до сих пор остается малопонятной. Исследователями предложена масса гипотез, включая скрытую инфекцию, аутоиммунные процессы, дисфункцию уротелия, патологическую активацию тучных клеток, нейрональное воспаление, проявление интоксикаций или особенностей диеты и психосоматические факторы [6, 7]. Одна из наиболее широко распространенных теорий основана на повреждении защитного глюкозаминогликанового (ГАГ) слоя уротелия [8]. Основные химические компоненты ГАГ-слоя – гиалуроновая кислота (ГК), гепарансульфат, хондроитинсульфат (ХС), дерматансульфат и кератансульфат. Нарушение функции ГАГ-слоя уротелия может стать причиной проникновения в субуротелиальную выстилку как нормальных, так и патологических компонентов мочи, вызывающих ответную воспалительную реакцию, препятствующую своевременному заживлению поврежденного уротелия. Это поражение может служить пусковым механизмом последующего каскада воспалительного и нейрогенного ответов, приводящих к появлению болевого синдрома, нарушению мочеиспускания и персистирующим изменениям в структуре тканей МП [9].
Опираясь на последнюю теорию, для восстановления защитных свойств поврежденного ГАГ-слоя применяются различные химические агенты, такие как пентозанполисульфат, гепарансульфат, ГК, ХС или комбинация вышеназванных препаратов. Гиалуроновая кислота считается одним из основных компонентов ГАГ-слоя, и ряд исследований показал эффективность инстилляций ГК в МП при СБМП/ИЦ [9, 10]. Кроме того, внутрипузырные инстилляции ГК рекомендуются как один из основных видов терапии СБМП/ИЦ в последних версиях урологических руководств [1]. Вместе с тем ХС также применяется в лечении СБМП/ИЦ достаточно широко и с хорошими результатами [11]. В отличие от ГК ХС доступен как в виде внутрипузырных инстилляций, так и в пероральной форме. Биодоступность ХС при пероральном приеме невысока, однако прием препарата не требует визита пациента в медицинское учреждение, что делает такую терапию более удобной для больного и снижает ее стоимость.
В доступной литературе представлено достаточное количество исследований, сравнивающих эффективность применения ГК и ХС в виде инстилляций как по отдельности, так и в комбинации [9–11]. Однако указаний на эффективность инстилляций ГК в комбинации с пероральным приемом ХС (поХС) мы не встретили. В связи с этим целью данного исследования было сравнить эффективность инстилляций ГК отдельно и в комбинации с длительным пероральным приемом ХС у пациентов с СБМП/ИЦ.
Материалы и методы. С июля 2017 г. по сентябрь 2018 г. в исследование были включены 59 женщин с СБМП/ИЦ. Основной критерий включения – наличие у пациентки болевого синдрома, локализующегося в проекции МП и имеющего связь с наполнением МП. Все страдали хотя бы одним из следующих симптомов: частота мочеиспусканий более 8 раз в сутки, ночные мочеиспускания 2 и более раз или персистирующая ургентность на протяжении как минимум 12 нед. Кроме того, критериями включения стали возраст старше 18 лет, отрицательный тест на беременность, отрицательные результаты посева мочи. Пациенток с инфекцией мочевыводящих путей; заболеваниями, передающимися половым путем; химическим или лучевым циститом; уролитиазом; злокачественными новообразованиями; дивертикулом уретры и кормящих грудью в исследование не включали.
Всем пациенткам с целью подтверждения диагноза СБМП/ИЦ и исключения иных заболеваний МП провели комплексное уродинамическое исследование и амбулаторную диагностическую цистоскопии. В связи с необходимостью проведения в рамках исследования монотерапии ГК стандартную гидродистензию при этом не выполняли. Таким образом, не было выделения групп с язвенной и безъязвенной формами СБМП/ИЦ. Все пациенты до начала исследования, а также спустя 1 нед. после завершения лечения заполняли визуальную аналоговую шкалу (ВАШ), опросник О’Лири-Сант (состоит из двух разделов: индекс симптомов интерстициального цистита [ИСИЦ] и индекс проблем при интерстициальном цистите [ИПИЦ]), а также дневник мочеиспусканий в течение 3 сут.
Пациентки были рандомизированы в две группы. Тридцать женщин (средний возраст – 57,1 года) получали только инстилляции препарата ГК в виде вискоэластического раствора гиалуроната натрия 50 мл (Уролайф®, «Riviera Biotech») 1 раз в неделю в течение 12 нед. (группа ГК). Двадцати девяти пациенткам (средний возраст – 58,63 года) была назначена комплексная терапия, включившая вышеуказанные инстилляции и поХС 0,39 г (Уролайф® капсулы, «Riviera Biotech») по 2 капсулы 3 раза в день также в течение 12 нед. (группа ГК+поХС). Внутрипузырные инстилляции выполняли с помощью катетера Нелатона 10 Ch. Пациенток инструктировали стараться воздерживаться от посещения туалета в течение не менее 1 и не более 2 часов после введения препарата.
Данные собирали проспективно с последующим ретроспективным анализом. Статистический анализ проводили с помощью программы MS Exel с расчетом t-критерия Стьюдента. Различия считали статистически значимыми при p<0,05.
Результаты. При выполнении цистоскопии у всех пациенток были исключены камни МП, опухоли и иные состояния, являющиеся критериями исключения диагноза СБМП/ИЦ. С помощью уродинамического исследования исключена нейрогенная дисфункция нижних мочевыводящих путей.
До лечения средний балл по ВАШ в обеих группах составил 7, средний ИСИЦ в группе ГК – 17, в группе ГК+поХС – 18 (p>0,1), средний ИПИЦ в обеих группах – 15. Частота мочеиспусканий в сутки в группе ГК составила 11,4, в группе ГК+поХС – 11,6 микции (p>0,1), средний объем мочеиспускания – 138±24,6 и 131±18,6 мл соответственно.
По прошествии 12 нед. терапии в обеих группах отмечено значимое улучшение по ВАШ, ИСИЦ, ИПИЦ, а также частоты и объема мочеиспусканий, но в группе ГК+поХС улучшение почти по всем исследуемым параметрам было более значимым (по ВАШ, ИПИЦ и частоте мочеиспусканий p<0,05, по ИСИЦ p<0,01). Абсолютные значения изменений отображены на рис. 1.
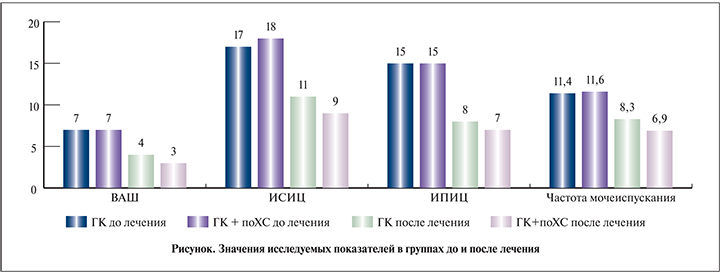
Исключение составил только объем мочеиспускания: 189±44,3 мл – в группе ГК и 213±29,4 мл – в группе ГК +поХС.
Несмотря на значимое увеличение емкости в обеих группах после проведенной терапии, разница между группами оказалась статистически незначимой (p>0,05).
Каких-либо значимых нежелательных эффектов ни у одной из пациенток не наблюдалось. Восемь пациенток (3 в группе ГК и 5 в группе ГК+поХС) отмечали появление незначительных резей в течение 1–2 сут. после проведенных инстилляций, однако данный побочный эффект мы связываем не с действием введенного препарата, а с самой катетеризацией.
Обсуждение. Лечение СБМП/ИЦ – известная проблема для урологов вследствие неясности этиологии и плохо предсказуемой эффективности терапии, включающей пероральные препараты, внутрипузырные инстилляции или хирургические манипуляции. В связи с этим исследователи продолжают поиск оптимального вида лечения или их сочетания.
Теория, предложенная Hurst, согласно которой дефекты ГАГ-слоя могут приводить к СБМП/ИЦ, сегодня общепризнанна [12]. Гиалуроновая кислота в виде внутрипузырных инстилляций была первым из предложенных для лечения СБМП/ИЦ глюкозаминогликаном. Первое исследование влияния ГК на симптомы СБМП/ИЦ было опубликовано в 1996 г. Morales et al., которые констатировали улучшение у 71% пациентов после 12-недельной терапии [10]. В последующем был выполнен еще ряд исследований, показавших эффективность внутрипузырной терапии ГК, варьирующуюся от 30 до 80%. С другой стороны, еще в двух исследованиях 2003 и 2004 гг. не было выявлено статистически значимой разницы эффективности ГК по сравнению с плацебо у пациентов с СБМП/ИЦ. Однако условия отбора пациентов и параметры улучшения из приведенных источников не ясны [13].
Вместе с тем было показано, что и дефицит ХС в поверхностном слое выстилки МП может играть значимую роль в патогенезе СБМП/ИЦ [12]. В связи с этим предложено использовать внутрипузырное введение ХС для лечения пациентов с СБМП/ИЦ. G. Steimhoff et al. [14], оценив эффективность применения ХС в течение 12 мес., констатировали улучшение состояния у 67% пациентов. Однако существуют и иные работы, сообщающие о низкой или вовсе сравнимой с плацебо эффективностью внутрипузырного введения ХС в течение 12 нед. [14].
Хорошая эффективность внутрипузырного применения сочетания ГК и ХС также показана в ряде работ. В частности, D. Porru et al. [15] сообщили о значительном улучшении от применения сочетанной терапии балла ВАШ, объема и частоты мочеиспусканий и ИСИЦ у 20 пациентов с СБМП/ИЦ. Схожие результаты получены M. Cervigni et al. [16], при этом авторы также отмечали улучшение симптомов и качества жизни на протяжении 3-летнего периода последующего наблюдения.
Несмотря на немалое число публикаций, посвященное внутрипузырному применению ГК и ХС, исследований эффективности перорального применения ГАГ в доступной литературе крайне мало. Так, сообщается об эффективности перорального применения ГК, ХС, куркумина и кверцетина для женщин постменопаузального периода с частыми рецидивами хронической инфекции мочевыводящих путей [17]. Описано улучшение симптомов СБМП/ИЦ на 48% после 12 мес. терапии пероральным препаратом, содержащим ГК, ХС, глюкозаминсульфат, кверцетин и рутин [18]. Однако работ, посвященных оценке эффективности сочетанного применения внутрипузырного и перорального применения ГАГ при СБМП/ИЦ, мы не обнаружили.
С учетом данных доступной литературы наша работа – первое в своем роде исследование, сравнившее эффективность только внутрипузырной терапии в сочетании с пероральным приемом ГАГ, в частности поХС. Кроме того, нами установлены статистически значимые различия результатов применения этих двух видов лечения: выявлены преимущества сочетанной терапии в показателях ВАШ, ИСИЦ, ИПИЦ и частоте мочеиспускания. В плане объема мочеиспускания разница оказалась недостоверной.
Нормальный ГАГ-слой МП состоит из сульфатированных ГАГ (таких, как ХС и дерматансульфат) и несульфатированных, например ГК. Около 80–90% всей поверхности ГАГ связаны с интегральными мембранными белками, в частности 55% белков связаны с гепарансульфатом, 26% – с ХС, оставшиеся – с неидентифицированными ГАГ или дерматансульфатом [19]. Таким образом, применение только несульфатированного ГАГ, ГК не может обеспечить полноценного восстановления ГАГ-слоя слизистой МП, а следовательно, не позволит получить максимальную эффективность лечения симптомов СБМП/ИЦ.
Несмотря на довольно низкую биодоступность перорального ХС, не превышающую 13%, результаты нашего исследования показывают несомненную эффективность такого его применения совместно с инстилляциями ГК. Кроме того, пероральный прием не требует посещения пациентом медицинского учреждения, что снижает стоимость лечения и позволяет восполнять дефицит ГАГ постоянно на протяжении продолжительного времени. В данном случае применяемый нами препарат Уролайф является наиболее удобным средством, так как выпускается как в виде вискоэластического раствора для инстилляций, основным компонентом которого является ГК, так и в виде капсул, содержащих ХС.
Недостатком нашего исследования служит отсутствие сравнения эффективности применения ГК в виде инстилляций и ГК совместно с поХС с плацебо. Однако, с нашей точки зрения, применение заведомо неэффективного препарата пациентами с СБМП/ИЦ неэтично, так как большинство из них страдают от довольно интенсивного болевого синдрома и отчаялись получить облегчение от лечения. Длительность наблюдения и количество пациенток, включенных в наше исследование, также относительно небольшие, хотя и достаточные для статистической оценки и сравнимы с размерами групп в доступных в литературе похожих исследованиях.
Заключение. Данные литературы о сравнительных исследованиях лечения пациентов с СБМП/ИЦ с помощью различных ГАГ, а также их сочетания довольно ограничены. В проведенном нами исследовании внутрипузырное введение ГК в сочетании с поХС показало преимущество по сравнению с использованием только внутрипузырной ГК как в плане болевого синдрома, так и в отношении частоты мочеиспусканий. С целью получения более точных данных о преимуществе тех или иных ГАГ в лечении СБМП/ИЦ необходимо проведение более длительных исследований на больших группах пациентов, желательно многоцентровых, с оценкой эффективности не только в ходе и сразу после лечения, но и в отдаленном периоде.



