Актуальность. Варикоцеле – это варикозное расширение вен семенного канатика и гроздевидного сплетения (ГС) вокруг яичка, вызванного ретроградным кровотоком по внутренней семенной вене (ВСВ) [1]. Хотя варикоцеле считается фактором бесплодия мужчин, степень его влияния на фертильность достоверно неизвестна. Коррекция варикоцеле улучшает параметры спермограммы и реальную фертильность некоторых мужчин с бесплодием [2, 3], может улучшить результаты вспомогательных репродуктивных технологий (ВРТ) [3, 4]. В настоящее время неясно, от каких пациентов можно ожидать восстановления фертильности после коррекции с учетом того, что варикоцеле встречается приблизительно у 15% всей мужской популяции [5–7]. Не от всех мужчин с варикоцеле, страдающих бесплодием, можно ожидать улучшения фертильности после операции. По данным большинства исследований, коррекция варикоцеле при бесплодии должна выполняться при клиническом варикоцеле и с отклонениями в спермограмме [8].
Рождение ребенка служит основным критерием эффективности лечения бесплодия любой этиологии. Однако получение такого рода данных зачастую представляет собой довольно сложную задачу, поэтому улучшение параметров спермы часто используется в качестве суррогатного индикатора при определении эффективности коррекции варикоцеле. В целях правильной интерпретации данных спермограммы после лечения некоторыми авторами использована концепция «увеличение ЧПСЭ» [9, 10]. Увеличение ЧПСЭ после варикоцелэктомии, достаточное для естественного зачатия или успешного применения внутриматочной инсеминации (ВМИ), у мужчины с исходно очень низкими концентрацией и подвижностью сперматозоидов, которому можно было провести только ЭКО или ЭКО+ИКСИ, является клинически значимым изменением [11]. По данным некоторых авторов [12, 13], число прогрессивно подвижных сперматозоидов (ЧППСЭ) является надежным индикатором фертильности мужчины и предиктором успешности ВМИ у бесплодных пар.
Необходимо отметить, что после варикоцелэктомии улучшение спермограммы обычно имеет место в 60–70% случаев, беременность в естественном цикле наступает у 30–40% пар [14, 15]. На сегодняшний день исследований, посвященных изучению совокупного влияния исходных клинико-анамнестических и лабораторных данных пациентов на эффективность варикоцелэктомии, немного.
В нескольких исследованиях сделан акцент на поиске надежных клинико-лабораторных предикторов эффективности коррекции варикоцеле у бесплодных мужчин [16, 17], но их результаты во многом противоречивы.
В связи с этим особую актуальность приобретает разработка простых и надежных (для применения в повседневной практике) прогностических моделей для прогнозирования исходов коррекции варикоцеле у конкретных больных, а также изучение роли такого индикатора качества спермы, как ЧППСЭ.
Цель исследования: оценить значение ЧППСЭ в комплексе с другими клинико-лабораторными предикторами в восстановлении фертильности мужчины после варикоцелэктомии.
Материалы и методы. В рамках проспективного открытого многоцентрового исследования проанализированы результаты микрохирургического ингвинального и субингвинального лигирования вен семенного канатика у 93 мужчин в возрасте 21–55 лет из бесплодных пар, обследованных и прооперированных в условиях Республиканского специализированного научно-практического медицинского центра урологии (РСНПМЦУ, Ташкент, Узбекистан) и Медицинского научно-образовательного центра МГУ им. М. В. Ломоносова (МНОЦ МГУ, Москва, Россия) в 2015–2019 гг.
Критерии включения: наличие результатов исследования эякулята, полученного до и после варикоцелэктомии (в срок от 3 до 12 мес.); отклонение как минимум одного из исследуемых параметров эякулята; жалобы на бесплодный брак длительностью 12 мес. и более; I–III степени варикоцеле.
Критерии исключения: азооспермия и нормозооспермия; субклиническая форма варикоцеле; наличие других ко-факторов мужского бесплодия.
В ходе исследования оценивали объем эякулята, концентрацию сперматозоидов, процент прогрессивно-подвижных форм, общую подвижность, ЧПСЭ и ЧППСЭ в соответствии со стандартами ВОЗ (2010) [18]. Кроме того, нами изучена частота естественных беременностей в исследуемых парах после варикоцелэктомии, наступивших в течение года после операции.
Наличие варикоцеле определяли пальпаторным методом, а также при помощи допплерографического исследования сосудов органов мошонки на основании классификации ВОЗ (2000), в соответствии с которой выделяют субклиническое варикоцеле, клиническое варикоцеле I–III степеней [19].
Статистический анализ данных проводили с применением пакетов для статистического анализа Microsoft Excel, 2019, и IBM SPSS© Statistics. 21.0. Анализ соответствия распределения признака закону нормального распределения проводили по одновыборочному критерию Колмогорова–Смирнова. Средние значения по группам представляли в виде выборочного среднего значения (параметрические критерии) и стандартного отклонения (M±SD), а также в виде медианы (непараметрические критерии) с 25-м и 75-м квартилями [Me (Q1–Q3)]. Значимость различий между группами проверяли с помощью критериев Стьюдента (t), Манна–Уитни и Вилкоксона; различия считали статистически значимыми при p<0,05, а при множественном сравнении при уровне р<0,05 с поправкой Бонферрони. Чтобы установить статистическую значимость наблюдаемых различий между группами сравнивали: 1) средние величины этих изменений по t-критерию для независимых групп c поправкой Бонферрони; 2) средние ранги значений с помощью критерия Манна–Уитни для двух независимых выборок (с поправкой Бонферрони) и критерия Вилкоксона для двух связанных выборок. Значимость связи (влияния) между зависимой номинативной переменной (беременность) и независимыми переменными (предикторами) определяли в ходе дискриминатного анализа с пошаговым отбором, используя статистический пакет IBM SPSS© Statistics 21.0.
В целях индивидуальной оценки степени изменений качества эякулята у отдельно взятого пациента для их распределения в соответствующие группы использовали фиксированное по величине изменение, превышение которого считали клинически значимым. Потенциальным индикатором степени изменения реальной фертильности принято увеличение ЧППСЭ; в качестве клинически значимого, или порогового, значения приняли увеличение ЧППСЭ на 12,5 млн – величину, рассчитанную из референсных значений спермограммы по ВОЗ [18]: 39 млн сперматозоидов в эякуляте • 0,32 (32%) прогрессивно подвижных.
На втором этапе на базе статистического пакета IBM SPSS© Statistics. 21.0, проведен дискриминантный анализ с пошаговым отбором для выявления предикторов наступления беременности с включением в модель следующих независимых переменных: возраст мужчины, индекс массы тела (ИМТ), степень и сторона варикоцеле, объем яичек, первичное или вторичное бесплодие, послеоперационная антиоксидантная терапия (проводилась или не проводилась), исходный объем эякулята, концентрация сперматозоидов, процент прогрессивно подвижных форм, общая подвижность, ЧППСЭ, ЧПСЭ, послеоперационное увеличение ЧППСЭ и ЧПСЭ.
Результаты. На первом этапе анализа пациенты были распределены на три группы в зависимости от направления и величины изменения ЧППСЭ в послеоперационном периоде. Группу I (n=48) составили пациенты, у которых имело место увеличение ЧППСЭ не менее чем на одно пороговое значение, т.е. на 12,5 млн; группу II (n=20) – пациенты, у которых увеличение ЧППСЭ было меньше 12,5 млн; группу III (n=25) – мужчины, у которых величина ЧППСЭ не изменилась или уменьшилась на любое значение.
Анализ клинико-анамнестических данных по группам показал (табл. 1), что по возрасту, ИМТ, длительности бесплодия, степени и стороне варикоцеле различия были незначимыми (р>0,05).
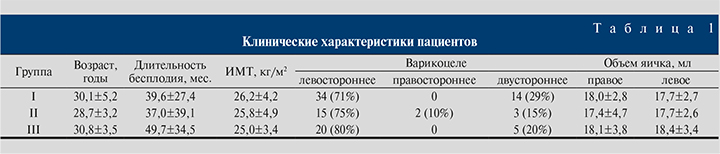
Группы различались по исходным и послеоперационным показателям спермограммы (табл. 2).
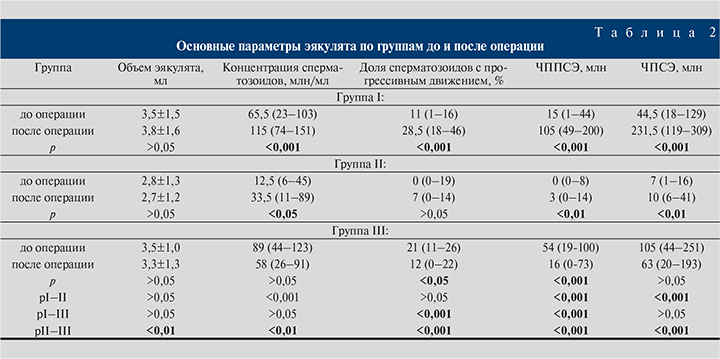
Из табл. 2 видно, что самые высокие исходные показатели были у пациентов группы III, однако варикоцелэктомия в ней привела к снижению качества спермы.
В послеоперационном периоде (через 3–12 мес.) в группах I и II (у 68 из 93 пациентов, 73%) отмечено улучшение средних показателей спермограммы. Самое значимое улучшение наблюдалось у мужчин группы I, в то время как в группе II также наблюдалось улучшение качества спермы, однако оно было не столь существенным.
Также нами была изучена частота естественных беременностей у 75 пар в группах I–III, которая составила 46% (17 пар из 37), 10% (2 пары из 20) и 12% (2 пары из 18) соответственно. То есть в группе I частота беременностей была значимо выше, чем в группах II и III (р<0,05).
По итогам дискриминантного анализа достоверным предиктором наступления беременности после коррекции варикоцеле оказались увеличение ЧППСЭ, возраст мужчины и исходная общая подвижность сперматозоидов. Прогностическая точность функции составила 84%, специфичность – 87%, чувствительность – 76% (табл. 3).
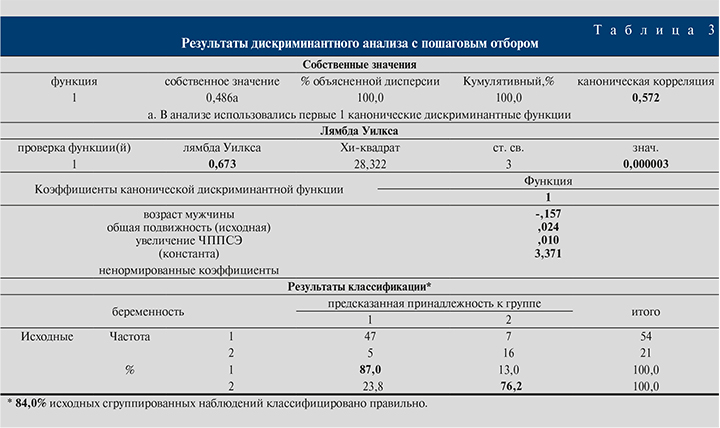
Итоговая дискриминантная функция выглядит следующим образом:
D = a • (-0,157) + b • 0,024 + с • 0,01 + 3,37,
где а – возраст больного, b – общая подвижность исходная, с – увеличение ЧППСЭ, 3,37 – константа. Пороговое значение наступления беременности составило ≥0,42 с вероятностью наступления беременности, равной 53%.
Обсуждение. Варикоцеле – наиболее частая, хирургически корригируемай причина мужского бесплодия [20]. При этом методом выбора в лечении варикоцеле является микрохирургическое лигирование вен семенного канатика [21–24]. Между тем до сих пор нет ответа на вопрос: почему у довольно большой когорты субфертильных мужчин (30–40%) варикоцелэктомия не приводит к улучшению фертильности [10, 14, 15, 25]? Отсутствует единое мнение о факторах, влияющих на эффективность коррекции варикоцеле. Также до сих пор нет единого мнения о предикативной роли синтезированного индикатора качества спермы – ЧПСЭ, так как, по данным некоторых авторов, ЧППСЭ может быть более точным индикатором фертильности мужчины и может точнее прогнозировать исход применения ВРТ, будь то ВМИ, ЭКО или ЭКО+ИКСИ [12, 13, 26].
Наше исследование было ориентировано на установление клинической и предикативной роли ЧППСЭ как индикатора фертильного статуса и восстановления репродуктивной функции субфертильного мужчины после варикоцелэктомии. С целью построения надежной прогностической модели были изучены клинико-лабораторные предикторы эффективности варикоцелэктомии для выявления факторов, значимо влияющих на исход лигирующих операций.
Многими авторами исходные параметры эякулята (ЧПСЭ, общая подвижность, прогрессивная подвижность и концентрация сперматозоидов) считаются наиболее достоверным фактором прогнозирования эффективности варикоцелэктомии у бесплодных мужчин [15–17], что соответствует нашим данным. При этом демонстрируют сильную положительную взаимосвязь между исходными и послеоперационными параметрами спермы и частотой беременности. Однако в нашем исследовании пациентов с исходно высокими показателями спермограммы коррекция варикоцеле привела к некоторому ухудшению качества спермы. Мы предполагаем, что данное явление может быть связано с известным статистическим феноменом «регрессия к среднему» или естественными биологическими колебаниями параметров спермограммы [27, 28].
Молодой возраст мужчины, по нашим данным, также является достоверным предиктором улучшения фертильности после варикоцелэктомии [16, 29, 30]. В то же время некоторые авторы утверждают, что возраст мужчины существенно не влияет на исход варикоцелэктомии [15, 17, 31]. Очевидно, возраст можно рассматривать как ко-фактор, влияние которого проявляется в зависимости от исходных показателей спермограммы.
К одним из основных ограничений нашего исследования относится небольшое количество вошедших в исследование мужчин, особенно это было заметно при распределении их по группам. Данные по беременностям получены только от 75 пациентов, к тому же не удалось собрать точные данные по состоянию здоровья партнерш (данные уточнялись путем устного опроса мужчин о состоянии репродуктивного здоровья их партнерш). Тем не менее полученные закономерности статистически высокозначимы, что позволяет считать, что наши данные могут быть экстраполированы на всю выборку мужчин из бесплодных пар, у которых варикоцеле является единственной выявленной причиной снижения фертильности.
Заключение. Вероятность восстановления фертильности после варикоцелэктомии имеет U-образную зависимость: максимальна при медиане ЧППСЭ 15 (1–44) млн и снижается при исходно низких и, наоборот, высоких значениях количества и подвижности сперматозоидов. Увеличение числа ЧППСЭ на 12,5 млн и больше – высокозначимый индикатор восстановления фертильности, вероятность наступления беременности при этом достигает 50%. Данный параметр может быть более наглядным индикатором фертильного статуса мужчины, чем ЧПСЭ. К значимым ко-факторам, влияющим на исход варикоцелэктомии, относятся возраст мужчины и исходные показатели подвижности сперматозоидов. Предложенную дискриминантную функцию можно использовать для прогнозирования исходов варикоцелэктомии после соответствующей валидации.



