Введение. В последнее время нарушение репродуктивной функции у мужчин приобрело особую медицинскую и социальную значимость. Причиной проблем с зачатием в супружеской паре являются нарушения как сперматогенеза, так и женской половой сферы, при этом мужской фактор проблем с зачатием в браке составляет 30–50% [1]. Поэтому целесообразнее инфертильную супружескую пару рассматривать как единое целое (условного пациента) [2].
Бесплодный брак является важной медико-социальной и демографической проблемой. В России на долю инфертильных пар приходится 20%, что существенно превышает критический порог ВОЗ в 15% [3].
Согласно статистическим данным, в последние десятилетия наблюдается неутешительная тенденция к снижению не только объема эякулята в целом, но и количества сперматозоидов [4]. Качественные и количественные изменения сперматогенной функции у мужчин могут быть связаны с воздействием множества как внешних, так и внутренних негативных факторов [5, 6].
Причины мужской инфертильности разнообразны. По одной из классификаций их подразделяют на претестикулярные, тестикулярные и посттестикулярные [7].
Диагноз идиопатической патоспермии (олиго-, астено-, и/или тератозооспермия без очевидных причин), или бесплодия неясного генеза (нормозооспермия), выставляется, если у мужчины не выявлены физические или эндокринные нарушения [8, 9].
Сегодня даже при идиопатической патоспермии патогенез снижения фертильности в ряде случаев может быть установлен. Изучаются генетические дефекты (мутации, полиморфизмы и изменение числа копий генов) и сложные эпигенетические нарушения, возможные патологические изменения молекулярных и метаболических механизмов паракринной регуляции сперматогенеза [10].
Согласно современным данным, одной из частых причин снижения мужской фертильности (от 25 до 40% случаев) является избыточный оксидативный стресс (ОС) – состояние, сопровождающееся образованием большого количества свободных радикалов [11].
Свободные радикалы, или активные формы кислорода (АФК), – это высокоактивные молекулы, имеющие неспаренный электрон на внешней орбите и обладающие высокой реактивной способностью, характеризующейся повреждением белковых молекул, а также липидов клеточных мембран. АФК участвуют в защитных механизмах иммунного ответа, синтезе биологически активных веществ, регуляции проницаемости клеточных мембран. В небольшом своем количестве АФК выполняют физиологическую роль и в процессе оплодотворения (необходимы для акросомной реакции, процесса гиперактивации) [12, 13].
Избыточный уровень АФК является основой многих патологических процессов в организме. В связи с тем что сперматозоиды имеют мало цитоплазмы (антиоксидантной защиты) и большое количество фосфолипидов в своей клеточной стенке, репродуктивная система является одной из наиболее чувствительных к факторам выраженного ОС. Его воздействие сопровождается повреждением мембран сперматозоидов, что уменьшает их подвижность и выживаемость, кроме того, возможно нарушение ультраструктуры в виде разрывов молекулы ДНК сперматозоидов [14, 15].
Негативное влияние ОС на репродуктивный результат имеет важное значение и при использовании вспомогательных репродуктивных технологий (ВРТ). Процессы подготовки сперматозоидов в программах ВРТ (повторное, длительное центрифугирование) не только способствуют образованию избыточного количества активных радикалов, но и более выраженному повреждению генетического материала мужских половых клеток. Поэтому при избытке ОС программы ВРТ не имеют явного преимущества перед естественным зачатием [11, 15].
Таким образом, при выявлении выраженного ОС применение антиоксидантных комплексов является весьма обоснованным у мужчин с нарушением фертильности как в рамках преконцепционной подготовки к естественному зачатию в супружеской паре, так и перед участием в программах ВРТ.
Доказанного преимущества жиро- или водорастворимых антиоксидантов нет, поэтому целесообразно их одновременное применение для улучшения основных процессов сперматогенеза [16].
L-карнитин – одна из наиболее известных молекул с антиоксидантным действием. Является одним из основных участников клеточного дыхания и синтеза клеточной энергии. Согласно современным исследованиям, большое его количество обнаруживается в придатках яичек, что свидетельствует о роли L-карнитина в механизмах созревания сперматозоидов прежде всего за счет поддержания должного уровня энергетических процессов. Ряд работ показал, что в эякуляте пациентов при эпидидимите наблюдается значительное снижение концентрации L-карнитина [17–19].
L-аргинин – условно незаменимая аминокислота. Однако главная роль аргинина в организме человека — быть субстратом для синтеза оксида азота (NO).
Согласно современным исследованиям, L-аргинин обладает положительным влиянием на состояние эндотелия сосудов, в том числе предстательной железы и яичек. Участвует в синтезе мужских половых гормонов, а также в образовании спермоплазмы (около 80% ее сухого остатка составляет L-аргинин). Кроме того, оказывает положительное влияние на сперматогенез, способствуя увеличению не только количества сперматозоидов, но и их активно-подвижных форм [20–22].
Коэнзим Q10 (убихинон) обладает выраженными антиоксидантными свойствами. Основная биологическая функция коэнзима Q10 главным образом заключается в предотвращении повреждения белковых структур и клеточных мембран за счет способности выполнять роль ловушки активных радикалов [23].
Синтез коэнзима Q10 в яичках происходит постоянно, уменьшение его концентрации в сперме негативно отражается не только на количестве и подвижности сперматозоидов, но и на их морфологии [24–26].
Витамин Е (токоферол) среди жирорастворимых антиоксидантов известен своими мембранопротективными свойствами и ингибирующим действием на избыток липидных радикалов. Согласно современным данным, максимальная его концентрация определяется непосредственно в сперматозоидах, в спермоплазме его количество незначительно. Доказано, что у мужчин со снижением количества сперматозоидов в эякуляте концентрация витамина Е также резко снижена, а при азооспермии обнаруживаются лишь следовые его концентрации [27–29].
Микроэлементы также играют важную роль в антиоксидантной защите. Концентрация цинка в семенной плазме значительно выше, чем в каких-либо других средах организма. Он необходим для синтеза тестостерона, адекватного функционирования сложного рецепторного аппарата половых гормонов [30].
Цинк влияет на ферментативное звено антиоксиданнтной системы путем активации глутатионпероксидазы, необходимой для нормального протекания процессов сперматогенеза, поддержания оптимальной вязкости эякулята [31].
Недостаток цинка приводит к структурным изменениям яичка: атрофии канальцев и торможению созревания сперматозоидов [32].
К модуляторам активности антиоксидантных ферментов, в частности глутатионпероксидазы, также может быть отнесен селен. Является важным элементов в процессах клеточного дыхания. Активно участвует в метаболизме мужских половых гормонов. Согласно современным данным, не только положительно влияет на показатели подвижности сперматозоидов, но и активно участвует в защите их генетического материала от повреждающего воздействия АФК. Отмечен синергизм в действии с витаминами А и Е, прежде всего за счет уменьшения избыточного их распада [27, 33].
Таким образом, с учетом значимой роли окислительного стресса в патогенезе мужской инфертильности весьма обоснованным становится широкое применение антиоксидантов у мужчин с нарушением фертильности для повышения качества эякулята.
Цель работы: оценить возможность использования антиоксидантного комплекса АндроДоз у мужчин с нарушением фертильности.
Материалы и методы. Проведен ретроспективный анализ медицинской документации 32 мужчин в возрасте от 21 года до 45 лет (средний возраст составил 27,8±6,7 года) с нарушением фертильности, обусловленным патоспермией. У 26 (81,2%) мужчин из 32 ранее никогда не было успешных попыток зачатия ребенка. Длительность отсутствия беременности в паре при регулярной половой жизни без применения средств контрацепции составляла в среднем 48,8±1,23 мес. Антиоксидантный комплекс АндроДоз применялся мужчинами по 2 капсулы 2 раза в день во время еды, согласно листку-вкладышу, до 3 мес.
Критерии включения: отсутствие беременности в браке более 1 года половой жизни без контрацепции; идиопатическая олиго-, астено- или тератозооспермия; отсутствие инфекций репродуктивного тракта, диагностированных методом полимеразной цепной реакции (ПЦР); отсутствие эякуляторной и эректильной дисфункций; отсутствие варикоцеле; нормальный гормональный фон.
Критерии исключения: доказанные генетические причины бесплодия; азооспермия; инфекции урогенитального тракта; наличие высокого уровня антиспермальных антител к сперматозоидам (MAR-тест >30%).
Оценку эякулята для микроскопического исследования проводили в соответствии с рекомендациями ВОЗ (2010).
Для оценки результатов применения антиоксидантного комплекса использовали спермограмму. Исследование спермы проводили в соответствии с требованиями руководства ВОЗ [5].
Фрагментацию ДНК определяли методом оценки дисперсии хроматина сперматозоидов (метод SCD), который включает последовательное выполнение нескольких стадий – приготовление образца спермы, оценка концентрации сперматозоидов, обработка ДНК-денатурирующим раствором, окрашивание и микроскопирование материала для оценки результатов.
Кроме исследования эякулята всем мужчинам проводили пальцевое ректальное исследование предстательной железы (ПЖ), трансректальное ультразвуковое исследование предстательной железы и УЗИ органов мошонки, а также микроскопическое исследование эякулята и секрета ПЖ, исследование микрофлоры урогенитального тракта мужчин в соскобе эпителиальных клеток методом ПЦР (Андрофлор) для исключения инфекций урогенитального тракта.
Всем мужчинам были определены концентрация цинка в спермоплазме, а также уровень общей антиокислительной активности спермы (ОАА), который определяли по обесцвечиванию радикал-катиона ABTS.
Результаты оценивали через 3 мес. от начала приема антиоксидантного комплекса «АндроДоз» и спустя 12 мес. от начала приема (период наблюдения).
Обработка полученных данных проводилась методом статистического анализа на основе проверки нормальности распределения количественных признаков с помощью непараметрического метода оценки критерия Пирсона χ2. Для оценки динамики изменения данных, выраженных количественными показателями, использовали методы статистического анализа: непарный t-критерий Стьюдента, непараметрические критерии Манна–Уитни.
Результаты. По данным проведенного исследования состояния предстательной железы методами трансректального ультразвукового исследования и пальцевого исследования патологических изменений не выявлено. В секрете предстательной железы методами его микроскопического исследования и анализа эякулята данных за воспалительный процесс не получено. Исследование микрофлоры урогенитального тракта в соскобе эпителиальных клеток методом ПЦР (Андрофлор) патогенных микроорганизмов не выявило ни у кого из мужчин.
Согласно анализу основных показателей спермограммы, отмечено статистически значимое увеличение концентрации (в 1 мл) сперматозоидов с 15,3±1,22 до 24,8±2,23 млн/мл через 3 мес. от начала приема антиоксидантного комплекса АндроДоз (р<0,05). Через 12 мес. наблюдения среднее значение концентрации сперматозоидов в эякуляте несколько снизилось, но осталось достоверно выше исходных показателей и составило 20,5±1,72 млн/мл (р<0,05) (табл. 1). Таким образом, общее число сперматозоидов выросло на 62,1% за время приема комплекса АндроДоз.
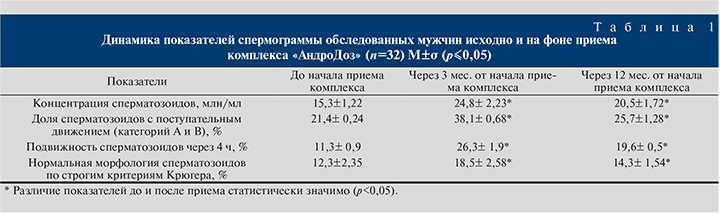
Через 3 мес. от начала применения антиоксидантов процент активно-подвижных сперматозоидов (категория А+В) достоверно изменился и составил 38,1±0,6. Доля активно-подвижных сперматозоидов в эякуляте через 12 мес. наблюдения составила 25,7±1,28 (р<0,05). Прирост показателя за 3 мес. на фоне приема комплекса АндроДоз составил 78,1%.
Положительная динамика после 3 мес. от начала использования АОК отмечена в отношении процента сперматозоидов с сохраненной подвижностью через 4 ч с 11,3±0,9 до 26,3±1,9 (р<0,05). Также статистически достоверно повысился процент нормальных форм сперматозоидов до 18,5±2,58%, что составило 50,4% от исходного уровня.
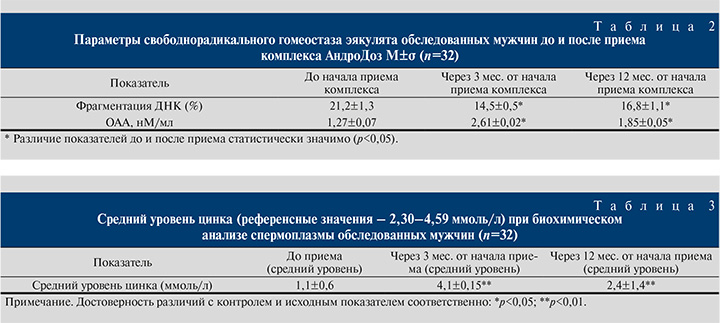
Параметры свободнорадикального гомеостаза эякулята обследованных мужчин до и после приема комплекса АндроДоз представлены в табл. 2. При этом отмечена высокая достоверность изменений в сторону снижения процента фрагментации ДНК и увеличения антиокислительной активности спермы (ОАА) на фоне приема комплекса (р<0,05).
Следует помнить, что большое содержание сперматозоидов с повреждениями ДНК не всегда коррелирует с обычными параметрами спермограммы. Поэтому так важно кроме использования рутинного метода анализа показателей эякулята (спермограммы) у мужчин со снижением фертильной способности выполнять оценку уровня фрагментации ДНК сперматозоидов.
Согласно полученным результатам, отмечено снижение процента уровня сперматозоидов с фрагментацией ДНК до уровня менее 15%.
Были отмечены статистически значимые различия на разных этапах применения антиоксидантного комплекса АндроДоз и наблюдения мужчин в показателях значений концентрации цинка (р<0.001) (табл. 3). С учетом выявленной ранее корреляционной зависимости между концентрацией цинка и уровнем общей антиоксидантной активности в эякуляте [34] определение концентрации цинка в спермоплазме и ее ОАА, особенно у молодых мужчин с нарушением фертильности, и назначение средств на его основе с целью коррекции дефицита цинка является оправданным.
Используемый антиоксидантный комплекс АндроДоз не вызывал аллергических реакций и других побочных явлений ни у одного из мужчин (n=32).
Основными результатами ретроспективного анализа медицинской документации мужчин с проблемами с зачатием в парах (n=32) явилось зарегистрированное наступление 6 беременностей на протяжении 12 мес. наблюдения, 5 из которых закончились срочными родами. По медицинским показаниям (материнский фактор) одна беременность была прервана.
Обсуждение. Изучению эффективности применения антиоксидантов при мужской инфертильности посвящено большое число исследований [2, 35]. Установлено, что антиоксиданты в целом положительно влияют на функции сперматозоидов, устраняют негативные нарушения, вызванные ОС, и улучшают показатели беременности [36, 37].
Использование антиоксидантов при идиопатическом мужском бесплодии включено в Клинические рекомендации [38].
Антиоксидантный комплекс АндроДоз зарекомендовал себя как комплекс, который может применяться у мужчин с нарушением фертильности, связанным с изменениями качественных и количественных параметров спермограммы, а также с повышенным уровнем фрагментации ДНК сперматозоидов и снижением ОАА спермоплазмы.
Сперма содержит большое разнообразие антиоксидантов со сходным механизмом действия, поэтому их изолированное определение не всегда соответствует актуальному состоянию антиокислительных систем. Поэтому в качестве дополнительного анализа в диагностике изменений качества спермы у мужчин для исключения состояния выраженного оксидативного стресса рационально определять общую антиокислительную активность [35, 39]. Анализ полученных нами данных показал более чем двукратное уменьшение этого параметра (1,27 нМ/мл), что свидетельствует об истощении антиокислительного потенциала эякулята у мужчин с нарушением фертильности. Использование комплекса АндроДоз оказывало положительное действие, которое заключалось в достоверном повышении величины ОАА в эякуляте. По результатам сравнительного анализа данных спермограмм выявлено, что прием комплекса АндроДоз не только оказывает положительное влияние на подвижность, но и приводит к снижению процента сперматозоидов с фрагментацией ДНК до уровня менее 15%, а также достоверно повышает величину ОАА эякулята.
Полученные результаты позволяют рекомендовать к использованию антиоксидантный комплекс АндроДоз у мужчин, имеющих проблемы с зачатием в паре.
В ходе применения комплекса АндроДоз ни в одном случае каких-либо нежелательных или побочных эффектов зарегистрировано не было.Таким образом, антиоксиданты, включая необходимые микронутриенты (цинк, селен), витамины, по нашему мнению, обеспечивают нормальный физиологический уровень протекания всех окислительно-восстановительных процессов в клетках репродуктивной системы, что позволяет эффективно управлять ключевыми звеньями негативного влияния на них окислительного стресса.
Выводы
1. Применение антиоксидантного комплекса АндроДоз у мужчин с нарушением фертильности улучшает качественные и количественные показатели спермограммы и морфологическое состояние мужской репродуктивной системы и восполняет недостаток витаминов в организме мужчины.
2. Применение комплекса АндроДоз сопровождается снижаем процента сперматозоидов с фрагментацией ДНК, способствует коррекции окислительного стресса эякулята.
3. Наиболее заметно действие комплекса АндроДоз проявляется через 3 мес. от начала применения.



