Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) и хронический простатит (ХП) считаются одной из наиболее частых причин развития симптомов нижних мочевыводящих путей (СНМП) у мужчин [1–5].
Несмотря на возрастные различия, встречаемость ДГПЖ довольно высока. Она варьируется от 42% у мужчин в возрасте от 51 до 60 лет до 90% у пациентов старше 81 года [6]. Более 30% мужчин старше 65 лет страдают от расстройств мочеиспускания различной степени тяжести, обусловленных ДГПЖ [7]. Около трети мужчин, доживающих до 80 лет, в течение жизни подвергаются оперативному лечению по поводу данного заболевания [8].
Хронический простатит – одно из наиболее распространенных урологических заболеваний, которое плохо поддается лечению и часто рецидивирует [1–5]. По данным Национального института здоровья США, более 25% мужчин с урологическими заболеваниями имеют симптомы простатита, что составляет около 9% мужской популяции [3].
Доброкачественная гиперплазия предстательной железы часто протекает на фоне воспалительных изменений в предстательной железе (ПЖ) [9–12]. По результатам морфологического исследования у 96,7% больных ДГПЖ имеются признаки хронического воспаления в железе различной степени активности [10]. По некоторым данным, 57% больных, обследованных по поводу ХП, имеют ДГПЖ, у 39% с ДГПЖ обнаруживают ХП [11, 12].
Оба заболевания могут существенно снижать качество жизни мужчин, а также приводить к развитию таких осложнений, как острая задержка мочи, поражение верхних мочевыводящих путей, нарушение половой функции и др. [13–16].
Среди возможных причин сочетания ДГПЖ и ХП можно выделить нарушения микроциркуляции, застойные процессы в простате, сдавление протоков ацинусов и венозный стаз. Очень часто они служат следствием анатомических особенностей простаты, пассивного и сидячего образа жизни, нерегулярной и/или бесконтрольной половой жизни, хронической интоксикации, уретрогенных инфекций и могут приводить к развитию хронического воспаления в ткани ПЖ [16–18].
Нередко сопутствующий ХП влияет и на клиническое течение ДГПЖ. Воспалительные изменения в тканях ухудшают как ирритативную, так и обструктивную симптоматику ДГПЖ. Таким образом, недооценка симптомов ХП, лабораторных данных (микроскопического, бактериологического исследований секрета простаты), инструментальных исследований (урофлоуметрия, трансректальное УЗИ (ТРУЗИ) ПЖ) может стать причиной низкой эффективности консервативного лечения ДГПЖ, а также приводить к увеличению числа ранних и поздних послеоперационных осложнений оперативного лечения (трансуретральная резекция ПЖ или чреспузырная аденомэктомия) [17, 18].
На сегодняшний день основными классами лекарственных средств для лечения больных ДГПЖ являются α-адреноблокаторы и ингибиторы 5α-редуктазы. Лечение больных ХП преимущественно проводится с применением антибактериальных и противовоспалительных препаратов. Кроме того, активно применяются фитопрепараты и физиотерапевтические методы лечения [19, 20]. Тем не менее сочетание ДГПЖ с ХП вызывает много вопросов при выборе правильной тактики лечения.
В 1970-е гг. разработана методика выделения из тканей животных веществ (биорегуляторов), названных цитомединами, которые представляют основные пептиды с молекулярной массой от 1 до 10 кД [21]. Уже в течение длительного времени биорегуляторы, выделенные из ПЖ крупного рогатого скота, применяются для лечения ХП [22–25].
Цель исследования: оценить эффективность применения биорегуляторных пептидов, в частности препарата Витапрост, в лечении мужчин с ДГПЖ и ХП.
Материалы и методы. В исследование включены 60 пациентов с ДГПЖ в сочетании с хроническим бактериальным простатитом категории II (NIH, 1995) в стадии обострения.
В ходе скрининга всем пациентам был проведен комплекс обследований для оценки критериев включения и невключения в исследование: сбор жалоб и анамнеза, заполнение шкалы IPSS и оценки качества жизни QoL, шкалы «Индекс симптомов хронического простатита» (NICH-CPSI), 5-балльной шкалы оценки боли, дневника мочеиспускания; определение уровня простатического специфического антигена (ПСА) крови, пальцевое ректальное исследование (ПРИ), урофлоуметрию, ТРУЗИ простаты, УЗИ почек и мочевого пузыря с определением объема остаточной мочи (Vом), общеклинические анализы крови и мочи.
Критерии включения в исследование: суммарный балл IPSS – 8–15, объем Vом от 50 до 100 мл, объем ПЖ (Vпж) более 30 см3, ПСА до 4 нг/мл, отсутствие сопутствующей медикаментозной терапии, подписанное информированное согласие на участие в исследовании.
Критерии невключения в исследования: конкременты мочевого пузыря и дистального отдела мочеточников, гематурия, подозрение на рак простаты, мочевого пузыря, отягощенный аллергический анамнез, оперативные пособия на органах малого таза, инфекции мочевыводящих путей, нейрогенная дисфункция мочевого пузыря, врожденные аномалии развития, онкологические и тяжелые сердечно-сосудистые заболевания, сахарный диабет, гипогонадизм.
На визите 1 оценивали исходное состояние пациентов, соответствие их критериям включения и невключения, после чего методом случайной выборки распределяли на две группы по 30 человек.
В группе сравнения (ГС) проводилась комплексная терапия препаратами группы α-адреноблокаторов (тамсулозин 0,4 мг 1 р/сут.) и фторхинолонов (левофлоксацин 500 мг 1 р/сут. 4 нед.). Пациенты основной группы (ОГ) получали аналогичную комплексную терапию в сочетании с кишечнорастворимыми таблетками Витапрост по 1 таблетке 2 раза в день в течение 30 дней.
Оценку эффективности лечения проводили через 2 (визит 2) и 4 нед. (визит 3). Оценивали средний балл по шкалам IPSS, QoL, NIH-CPSI, максимальную скорость потока мочи (Qmax), Vпж и Vом; проводили бактериоскопическое и бактериологическое исследования секрета ПЖ. Последующее наблюдение за пациентами осуществляли в течение 6 мес., в ходе которого оценивали отдаленные результаты проведенной терапии, в том числе случаи острой задержки мочи, лейкоцитурии, бактериурии, а также рецидивы простатита.
Статистическую обработку результатов проводили с помощью программы MSExel 11.0 из стандартного пакета MS Office, 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Cтьюдента) статистики. При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
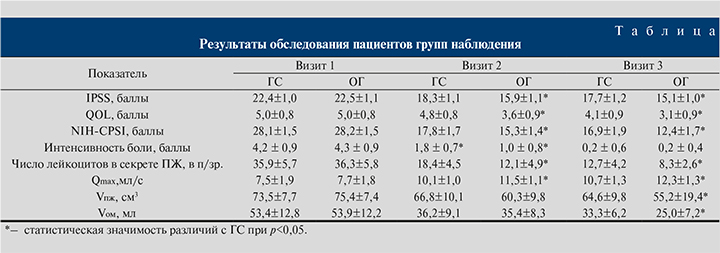
Результаты. Результаты клинико-лабораторных и инструментальных исследований, полученные в исследуемых группах в течение 4 нед. терапии, представлены в таблице.
При бактериологическом исследовании секрета предстательной железы на визите 1 в ГС наиболее часто выявлялась E. coli (16 [53,3%] человек). E. faecalis была обнаружена у 10 (33,3%) пациентов, S. epidermidis – у 3 (10%), S. aureus – у 1 (3,3%). В ОГ результаты были сопоставимыми: E. coli выявлена у 17 (56,7%) человек, E. faecalis – у 8 (26,7%), S. epidermidis – у 5 (16,7%) человек. Все возбудители в обеих группах были чувствительны к левофлоксацину.
На визите 2 в ГС бактерии были обнаружены в 11 (36,7%) посевах: E. coli – в 6 (20%), E. faecalis – в 3 (10%), S. epidermidis – в 1 (3,3%). В ОГ микроорганизмы были выделены в посевах 10 (33,3%) пациентов: E. coli обнаружена у 7 (23,3%) из них, E. faecalis – у 2 (6,7%), S. epidermidis – у 1 (3,3%). Статистически значимых различий между группами не выявлено (p>0,05). У всех выявленных микроорганизмов в обеих группах была чувствительность к левофлоксацину.
На визите 3 по результатам бактериологического исследования секрета простаты в обеих группах роста микроорганизмов выявлено не было.
В течение 6 мес. последующего наблюдения в ГС острая задержка мочи выявлена у 2 (6,6%) пациентов, лейкоцитурия – у 17 (56,7%), бактериурия – у 12 (40%), рецидивы простатита – у 10 (33,3%). В ОГ острая задержка мочи возникла в 1 (3,3%) случае, лейкоцитурия отмечена в 10 (33,3%) наблюдениях, бактериурия – в 8 (26,7%), рецидивы простатита – в 4 (13,3%).
Обсуждение. Биорегуляторные пептиды могут влиять на процессы дифференцировки в популяции клеток, из которых они были выделены, обладают противовоспалительными и иммуномодулирующими свойствами, а также усиливают синтез биологически активных веществ и улучшают микроциркуляцию в простате [21, 22].
Экстракт простаты обладает органотропным свойством в отношении ПЖ, оказывает противовоспалительное и репаративное действия. Как и все пептидные биорегуляторы, он также обладает антиагрегантными и антикоагулянтными свойствами, усиливает синтез антигистаминовых и антисеротониновых антител, улучшает микроциркуляцию в ПЖ. Этим обусловлена его способность уменьшать отек и снижать активность воспалительных процессов при заболеваниях ПЖ [23].
Полученные в ходе исследования результаты свидетельствуют: применение препарата Витапрост в дополнение к стандартной комплексной терапии мужчин с ДГПЖ и ХП позволяет эффективнее, чем в случае использования только комплексной терапии, уменьшать выраженность СНМП, а также проявления воспалительного процесса. Так, уже после 2 нед. терапии в ОГ средний балл по опросникам IPSS, QoL и NICH-CPSI был ниже на 2,4; 1,2 и 2,5 балла соответственно, количество лейкоцитов в секрете простаты было в среднем меньше в 1,5 раза, показатель Qmax был выше на 1,4 мл/с. Выявленные различия были статистически значимыми (p<0,05). Данная тенденция сохранялась и по прошествии 4 нед. терапии. Кроме того, к визиту 3 среднее значение Vпж в ОГ было статистически значимо (p<0,05) ниже, чем в ГС, что, на наш взгляд, также может быть связано с более выраженным уменьшением отека ПЖ на фоне приема Витапроста. Полученные результаты в целом соответствуют представленным в литературе данным [23–25].
Так, в исследовании В. Н. Ткачука и соавт. [24] показано, что у больных ХП ведущим симптомом является боль. По данным авторов, прием препарата Витапрост уменьшил боль, не оказывая общего влияния на организм больных, что позволило повысить качество жизни пациентов.
В нашем исследовании в ОГ средняя оценка по 5-балльной шкале оценки боли через 2 нед. терапии была на 0,8 балла ниже (p<0,05), чем в ГС. Однако к визиту 3 данный показатель в обеих группах имел одинаковые значения.
В исследовании коллектива авторов под руководством Н. А. Лопаткина [25] также отмечено снижение боли и уменьшение расстройств мочеиспускания на фоне терапии Витапростом [25]. По результатам исследования Витапрост в таблетках способствовал уменьшению вероятности развития обострений ХП более чем в 2 раза. При этом отмечено, что положительный эффект лечения сохранялся до 60 дней после окончания лечения.
Полученные в ходе настоящего исследования результаты также подтверждают возможность сохранения положительного эффекта от приема Витапроста после окончания терапии, о чем свидетельствует меньшая частота развития: лейкоцитурии – на 23%, бактериурии – на 13%, а также рецидивов простатита – на 20%. Однако период наблюдения в нашем исследовании составил 6 мес.
Заключение. Таким образом, применение биорегуляторных пептидов, в частности препарата Витапрост, в отношении пациентов с ДГПЖ и ХП способствует уменьшению выраженности СНМП и болевых ощущений в более короткие сроки, положительно влияет на динамику воспалительного процесса, что приводит к улучшению качества жизни пациентов. На наш взгляд, препарат Витапрост может эффективно использоваться в составе комплексной терапии мужчин с ДГПЖ и ХП.



