Введение. Хронический простатит/синдром хронической тазовой боли (ХП/СХТБ) определяют как хроническая боль или дискомфорт в области таза в течение как минимум 3 из последних 6 мес., часто сопровождающиеся симптомами нижних мочевыводящих путей, психосоциальными нарушениями и сексуальной дисфункцией [1–2].
ХП/СХТБ представлены гетерогенной группой симптомов, которые могут вызывать существенное ухудшение повседневного качества жизни пациентов. Диагностика ХП/СХТБ часто не однозначна; соответственно, лечение не всегда эффективно, поскольку заболевание патогенетически мозаично. Аутоиммунная агрессия, асептическое воспаление, миофасциальный синдром, нейровоспаление и психологические причины играют немалую роль в патогенезе и симптоматике ХП/СХТБ, поэтому простатит не следует рассматривать исключительно как болезнь предстательной железы [3].
Термин «хронический простатит» включает множество различных симптоматических моделей, многие его аспекты до сих пор остаются загадкой. Эпидемиологических исследований не проводили, в нашей стране в медицинских статистических сборниках графа «хронический простатит» также отсутствует. Мы имеем в виду классические эпидемиологические показатели (заболеваемость, болезненность, смертность), которые рассчитывают на 100 тыс. населения; ни в коем случае нельзя исчислять заболеваемость в процентах, как это встречается в некоторых статьях. Тем не менее указывают, что распространенность хронического простатита среди мужского населения составляет около 4,5–9%, при этом с возрастом частота рецидивов удваивается [4–7]. По данным нашего исследования [8], в структуре урологического приема муниципальной поликлиники доля больных хроническим простатитом составила 2,5%, причем наличие платных услуг увеличило эту пропорцию до 11,5–17,7%. Некоторые авторы считают, что частота симптомов, связанных с простатитом, составляет в среднем 8–8,2% [1].
Пациенты часто предъявляют множество жалоб, не ограничивающихся болью в промежности, но также проявляющихся симптомами нижних мочевыводящих путей. Могут отмечаться поллакиурия, дизурия, никтурия, подтекание мочи или ослабление струи мочи; не редки симптомы, связанные с аноректальной областью (запор, ощущение инородного тела в прямой кишке и ректальная боль во время и после дефекации); боль в мошонке или головке полового члена, преждевременная или затрудненная эякуляция, стертость оргазма [5, 9]. Возможна также боль в пояснично-крестцовой области, усиливающаяся в положении сидя. Эти симптомы могут появляться одновременно или постепенно, вызывая у пациентов усиливающееся ощущение дискомфорта и беспокойства, больные часто чувствуют себя не полностью понятыми лечащим врачом. Качество жизни больного ХП/СХТБ прогрессивно ухудшается [10–11].
Недавние исследования показывают, что многие состояния хронической боли, особенно фибромиалгия, синдром хронической усталости и синдром раздраженного кишечника, имеют общие демографические, клинические и психосоциальные аспекты, а также субъективные и объективные особенности, связанные с болью. Среди этих особенностей ведущее место занимает оксидативный стресс [3, 12].
Роль оксидативного стресса в патофизиологии многих заболеваний несомненна, это подчеркивается большим количеством исследований. По ключевым словам oxidative stress Pubmed выдал 317 855 ссылок; в e.library по аналогичному запросу найдено 13 983 публикации. Окислительный, или оксидативный, стресс как понятие в окислительно-восстановительной биологии и медицине было сформулировано в 1985 г. Сегодня после долгих дебатов оксидативный стресс определяют как «дисбаланс между оксидантами и антиоксидантами в пользу оксидантов, приводящий к нарушению окислительно-восстановительной передачи сигналов и контроля и/или молекулярному повреждению» [13].
Связь окислительного стресса с воспалением и воспалительными реакциями несомненна. Доказано, что воспалительные макрофаги выделяют глутатионилированный пероксиредоксин-2, который затем действует как «сигнал опасности», запуская выработку фактора некроза опухоли-альфа [14].
Подчеркивают, что повреждение ДНК, в основном из-за окислительного стресса, является основной причиной нарушения функции сперматозоидов. Однако есть и хорошие новости! Окислительный стресс вызывается различными модифицируемыми факторами, и использование простых мер, в частности прием комплекса антиоксидантов, может снижать его уровень [15].
Бета-каротин и витамины Е и С жизненно важны для правильной регуляции физиологических функций [16–17]. Фрукты и овощи богаты минералами, витаминами и пищевыми волокнами; их высокое содержание в рационе обратно пропорционально связано со смертностью и частотой заболеваний, вызванных ожирением, сердечно-сосудистых заболеваний, диабетом 2-го типа и раком [18]. В немалой степени защитная роль отводится витаминам-антиоксидантам, к которым, в частности, относятся β-каротин, витамин Е и витамин С [19]. Существенная роль витамина Е в поддержании окислительно-антиоксидантного баланса хорошо известна, причем одновременный прием витамина С антиоксидантную защиту усиливает [17]. Бета-каротин поддерживает иммунную систему и проявляет способность снижать окисление ЛПНП-холестерина посредством модуляции антиоксидантных ферментов [20].
Таким образом, включение в комплекс лечения больных инфекционными и воспалительными заболеваниями антиоксидантов патогенетически обусловлено. Мы поставили цель оценить возможности минерально-витаминного антиоксидантного комплекса в лечении больных хроническим абактериальным простатитом с признаками воспаления (синдром хронической тазовой боли категории IIIa по классификации Американского национального института здравоохранения (NIH USA) от 1995 г.)
Материалы и методы. В открытое проспективное рандомизированное сравнительное исследование вошли 47 пациентов с диагнозом «хронический абактериальный простатит с признаками воспаления» (СХТБ категория IIIa).
Критерии включения в исследование:
1. Мужчины в возраст от 20 до 55 лет.
2. 15 и более лейкоцитов в поле зрения при световой микроскопии секрета простаты, полученной путем изгоняющего массажа.
3. Отсутствие роста микрофлоры в секрете простаты методами посева и молекулярно-генетической диагностики набором Андрофлор.
4. Сумма баллов по шкале симптомов хронического простатита National Institutes of Health Chronic Prostatitis Symptom Index (NIH-CPSI) не менее 15.
5. Согласие на участие в исследовании.
Критерии невключения:
1. Обострение сопутствующих соматических или альтернативных хронических инфекционных заболеваний.
2. Обнаружение уропатогенов в секрете простаты.
3. Число лейкоцитов в секрете простаты при микроскопии нативного мазка менее 15 в поле зрения.
4. Сумма баллов по шкале симптомов ХП NIH-CPSI менее 15.
5. В течение по крайней мере 3 мес. до обращения пациент не принимал каких-либо лекарственных препаратов по поводу простатита или интеркуррентных заболеваний.
6. В первый визит проводили изучение анамнеза жизни и заболевания, физикальные исследования. Выполняли пальцевое ректальное исследование (ПРИ) с забором секрета простаты для лабораторных тестов. Помимо световой микроскопии секрет простаты подвергали микробиологическому исследованию методами посева и молекулярно-генетической диагностики набором Андрофлор.
Анализировали русскоязычную шкалу симптомов ХП NIH-CPSI, заполненную пациентами самостоятельно. Также проводили забор венозной крови для определения антиоксидантного статуса пациентов. Общий антиоксидантный статус сыворотки крови включал определение активности супероксиддисмутазы эритроцитов (нормальные значения: 1200–2000 ЕД/г Hb), активности глутатионпероксидазы (референсные величины: 50–100 ЕД/г Hb, активности глутатионредуктазы эритроцитов (уровень в норме: 2,5–6,0 ЕД/г Hb). По совокупности результатов вычисляли активность общего антиоксидантного статуса сыворотки, которая в отсутствие оксидативного стресса колебалась в пределах 1,50–2,75 ммоль/л. Все исследования повторяли через 2 мес.
Пациентов рандомизировали в две группы. В основную вошли 26 пациентов, в группу сравнения – 21 больной. Всем пациентам назначали унифицированную терапию, включавшую кетопрофен по 100 мг ежедневно в течение 7 дней, бенциклан по 100 мг дважды в день в течение 3 нед., эскузан по 15 капель трижды в сутки в течение 3 нед.; пациенты ОГ дополнительно в течение 2 мес. с первого дня получали ежедневно по 2 таблетки биологически активной добавки комплексного антиоксидантного действия Селцинк-плюс. Биологически активная добавка Селцинк-плюс представляет собой таблетки массой 672 мг, покрытые оболочкой; каждая содержит селена 0,05 мг, цинка 8 мг, бета-каротина 7,2 мг, витамина E 35 мг, аскорбиновой кислоты 180 мг. Результаты оценивали по завершении приема антиоксиданта.
Полученные в ходе исследования результаты были статистически обработаны с помощью пакета прикладных программ «Microsoft Office, 2007», Biostat, 2009. Различия между группами определяли с использованием метода доверительных интервалов, t-критерия Стьюдента, критерия χ2. Гипотеза об отсутствии статистически значимого влияния фактора отвергалась при р>0,05.
Результаты. На первом визите пациенты предъявляли по нескольку жалоб, их структура представлена на рисунке.
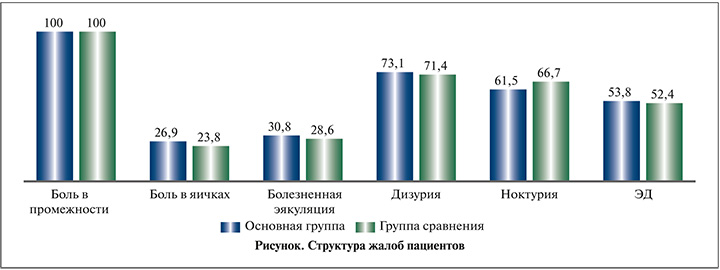
Как видно из рисунка, спектр жалоб пациентов обеих групп был идентичен и характерен для ХП/СХТБ. В настоящем исследовании мы не оценивали эректильную функцию и не анализировали детально нарушения мочеиспускания – упор был сделан на симптомах ХП и антиоксидантной системе.
Сумма баллов по шкале симптомов ХП в среднем в ОГ достигла 22,7±5,1, а в ГС – 21,9±4,7. В секрете простаты исходно обнаружили 41,8±10,7 лейкоцитов в поле зрения у пациентов ОГ и 42,0±11,3 лейкоцитов у пациентов ГС.
У пациентов обеих групп микробиологическое исследование секрета простаты микрофлоры не обнаружило. Таким образом, все пациенты соответствовали критериям включения.
На фоне комплексной терапии получено улучшение со стороны как симптоматики, так и лабораторных проявлений у всех пациентов обеих групп, однако степень положительной динамики различалась; результаты представлены в табл. 1.

Таким образом, стандартная терапия, включившая препараты, улучшающие кровоснабжение простаты, витамины, спазмолитики, альфа-адреноблокаторы, нестероидные противовоспалительные средства, оказала значимый эффект у пациентов обеих групп, который сохранялся на протяжении 2 мес. Однако дополнительное проведение антиоксидантной терапии этот эффект по шкале симптомов практически удвоило, хотя на число лейкоцитов в секрете простаты влияния не оказало.
Оценка антиоксидантной терапии показала результаты, представленные в табл. 2.
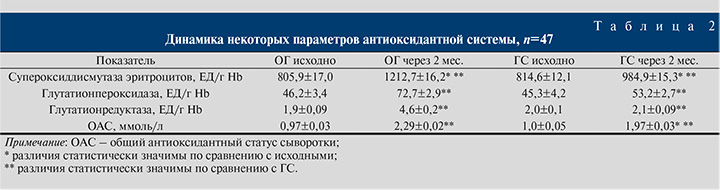
Как следует из табл. 2, в стадии обострения хронического простатита все пациенты обеих групп имели снижение антиоксидантной защиты. Двухмесячный прием Селцинк-плюс привел к нормализации общего антиоксидантного статуса. В ГС также отмечалась положительная динамика по состоянию антиоксидантного статуса, однако достоверные различия получены только по одному показателю – активности супероксиддисмутазы эритроцитов.
Обсуждение. До сих пор остается открытым вопрос: так ли абактериален абактериальный простатит? [21]. Существует так называемая парадигма «скрытого патогенеза». Инфекционно-воспалительный процесс в любых отделах урогенитального тракта может быть вызван кратковременным, но сильным воздействием на мочевыводящие пути патогена (как бактерий, так и вирусов, даже если сами по себе они не являются «уропатогенными» в классическом смысле) [22]. Микробно-вирусный фактор после этого может исчезнуть (например, уйти в персистенцию, перейти в дормантную форму) или даже может быть элиминирован при хорошем иммунитете – однако нанесенное им повреждение, запускающее патогенез, останется. Вирусные и бактериальные инфекции часто связаны с дефицитом микроэлементов, в том числе незаменимого микроэлемента селена, необходимого для адекватной работы окислительно-восстановительной группы селенопротеинов. При вирусных инфекциях в организме человека вырабатываются активные формы кислорода; их избыток может приводить к развитию окислительного стресса [17].
Показана роль окислительного стресса в аутофагии, которая представляет собой катаболический процесс, направленный на переработку клеточных компонентов и поврежденных органелл в ответ на различные стрессовые ситуации, такие как лишение питательных веществ, вирусная/бактериальная инфекция и генотоксический стресс [23].
К. Л. Локшин [24] проанализировал более 600 работ, опубликованных в базе данных Pubmed в период с 2014 по 2016 г., посвященных исследованию простатита и синдрома хронической тазовой боли у мужчин. Обнаружено, что единого подхода к терапии нет, поскольку ХП/СХТБ – это гетерогенный синдром и необходима индивидуальная терапия; подбор мультимодальной терапии приводит к наиболее значимому симптоматическому улучшению у 75–84% больных.
Другие авторы [25] также подчеркивают, что ХП/СХТБ – это мультифакторное заболевание, при котором необходим комплексный подход к подбору лекарственных препаратов и методов физического воздействия [26–32]. Нашли, что дополнительное проведение массажа простаты пациентам с ХП/СХТБ, получающим α1-адреноблокаторы и нестероидные противовоспалительные средства, повышает результаты лечения [33].
Роль антиоксидантов в комплексном лечении больных ХП/СХТБ оценивается преимущественно в свете сопутствующих репродуктивных нарушений. Оксидативный стресс рассматривают как одну из основных причин снижения фертильности и мужского бесплодия, показывают роль микроэлементов (цинк, селен) и антиоксидантов (витамины А, Е и С) в перспективах их коррекции [34, 35], в том числе при туберкулезе предстательной железы [36, 37]. Многое авторы антиоксидантную терапию считают патогенететически обоснованной и эффективной в отношении многих заболеваний, в том числе и ХП. Антиоксидантными свойствами обладают витамины А, Е и С; микроэлементы цинк, медь и селен; глутатион, карнитин, N-ацетилцистеин, коэнзим Q10, карнозин, L-аргинин, ликопин, ресвератрол, миоинозитол, фолиевая кислота, α-липоевая кислота, пентоксифиллин, кверцетин и другие вещества [38, 39]. Определяли возможности антиоксидантной терапии при хроническом абактериальном простатите без признаков воспаления (IIIb-категории); в качестве антиоксиданта выбрали α-липоевую кислоту. Авторы отметили уменьшение индекса оценки выраженности симптомов на 44,8% в группе, получавшей стандартную терапию, и на 66,4% в группе [40].
Роль микроэлемента селен (Se) в жизни человека трудно переоценить – при том что глобально почти у 1 млрд человек обнаружен дефицит Se [41]. Se играет важную роль в окислительно-восстановительном гомеостазе и антиоксидантной защите благодаря включению в жизненно важные селенопротеины [42, 43]. Статус селена может влиять на функцию клеток как адаптивного, так и врожденного иммунитета [44, 45]. Влияние Se на иммунную систему является многонаправленным, т. е. модулирующим активность нейтрофилов, макрофагов, естественных клеток-киллеров, Т- и В-лимфоцитов [46].
Обнаружили, что добавка Se у пациентов с респираторным дистресс-синдромом могут модулировать воспалительную реакцию, восстанавливая антиоксидантную способность легких за счет уровней интерлейкина (IL)-1β и IL-6 [41]. Пациенты с ко-инфекцией туберкулез +ВИЧ имели более низкий статус Se по сравнению со здоровыми людьми [45]. Недавние исследования показали, что пациенты с COVID-19 имели более низкие уровни циркулирующего железа (Fe), цинка (Zn) и Se [47]. Добавка Se больным COVID-19 предотвращала прогрессирование заболевания [48].
Недостаточное потребление Se с пищей может вызывать когнитивные дисфункции и сердечную недостаточность у пожилых людей [41].
Получение достаточного количества витамина Е с пищей может повышать фертильность, поскольку способствует уменьшению повреждения сперматозоидов свободными радикалами. Доказано, что витамин Е как сам по себе, так и в комбинации с витамином С способен снижать перекисное окисление липидов, улучшать фрагментацию ДНК и связывание сперматозоидов с прозрачной оболочкой. Мета-анализ 11 исследований, включиавший 832 пациента, продемонстрировал, что частота наступления беременности была значимо выше в группе мужчин, принимавших витамин E, по сравнению с контролем [49].
Микроэлемент цинк необходим для нормального функционирования мужской репродуктивной системы, поскольку он участвует в стероидогенезе, развитии тестикул, потреблении кислорода сперматозоидами, конденсации ядерного хроматина, реакции акросомы, активности акрозина, стабилизации хроматина сперматозоидов и в превращении тестостерона в 5a-дигидротестостерон [49].
Микроэлемент селен участвует в антиоксидантных реакциях и также необходим для нормального развития яичек, сперматогенеза и процесса конденсации сперматозоидов [50], он может улучшать количество сперматозоидов, их подвижность и морфологию [51]. Было получено подтверждение синергической активности селена в сочетании с витамином Е [52, 53].
Одним из универсальных патофизиологических механизмов многофакторного патогенеза ХП/СХТБ считают окислительный стресс [54, 57]. Источником активных форм кислорода (АФК) в секрете предстательной железы при ХП могут быть лейкоциты в значительном количестве, что характерно для ХП, патогенная микрофлора, способная синтезировать АФК в процессе своей жизнедеятельности, а также антиспермальные антитела, которые возникают в ответ на инвазию микроорганизмов, а после их эрадикации – вследствие сохраняющегося аутоимммунного воспаления простаты [58, 60]. М. М. Кутлуев в экспериментально-клиническом исследовании по оценке состояния процессов свободнорадикального окисления в ткани предстательной железы при простатите показал усиление генерации АФК в 3,6 раза и снижение общей антиоксидантной активности в 1,7 раза в ответ на формирование индуцированного воспаления предстательной железы [60].
Хроническое воспаление в ткани предстательной железы приводит к формированию, а затем усиливает проявление окислительного стресса. Повышенная нагрузка на антиоксидантную систему в условиях избытка АФК чревата ее декомпенсацией, что может замыкать «порочный патогенетический круг» ХП и существенно снижать эффективность лечения. С учетом роли окислительного стресса в патогенезе любых форм ХП патогенетически обоснованным является назначение антиоксидантов в комплексном лечении как бактериальных, так и абактериальных форм ХП/СХТБ [54, 61].
Было показано, что дополнительное назначение биологически активной добавки, содержащей ряд микроэлементов и витаминов, включая цинк, селен, витамин А и токоферол, в комплексе лечения больных воспалительными заболеваниями мужской репродуктивной системы, осложненной экскреторно-токсической формой бесплодия, привело к увеличению доли морфологически нормальных форм сперматозоидов в 1,5 раза, к повышению концентрации сперматозоидов и доли прогрессивно подвижных форм (А+В) сперматозоидов более чем в 2 раза. Ценным результатом комплексной терапии явилось наступление беременности у партнерш: 46,1% пациентов в течение года после завершения лечения [61].
У больных хроническим простатитом определяли в плазме крови и секрете предстательной железы интенсивность процессов перекисного окисления липидов по содержанию ацилгидроперекисей и малонового диальдегида. Кроме этого определяли активность каталазы, супероксиддисмутазы, общую антиокислительную активность, уровень стабильных метаболитов оксида азота. У всех пациентов в той или иной степени был выявлен дисбаланс антиоксидантной системы, однако курс лечения с применением комплекса антиоксидантов позволил ингибировать реакции свободнорадикального окисления [62].
Заключение. Проведенное исследование убедительно показало снижение активности антиоксидантной активности сыворотки крови у больных ХП/СХТБ. Стандартное лечение оказало нормализующий эффект на некоторые параметры антиоксидантной защиты (достоверное повышение активности супероксиддисмутазы эритроцитов); по остальным параметрам отмечена положительная динамика, но статистически значимые различия не обнаружены. Двухмесячный прием наряду со стандартной терапией витаминно-минеральным комплексом Селцинк-плюс привел к восстановлению антиоксидантной активности плазмы крови больных ХП/СХТБ.



