Введение. Автономная дисрефлексия (АвтД) – неотложное состояние, характеризующееся внезапной и избыточной активацией вегетативной нервной системы пациентов с травмой спинного мозга (ТСМ) на уровне или выше сегмента Th6, возникающее вследствие раздражающих стимулов ниже травмы. Частыми причинами АвтД являются нейрогенная детрузорная гиперактивность, переполнение мочевого пузыря (75–85% случаев), почечная колика, переполнение прямой кишки, тесная одежда, вросший ноготь, переломы [1, 2]. Клинически АвтД проявляется внезапно возникающей сильной пульсирующей головной болью. Возможны появление пилоэрекции, чувства бегающих мурашек, покраснение и потливость кожи выше уровня поражения спинного мозга наряду с затуманенным зрением и заложенностью носа [2].
Европейская ассоциация урологов определяет АвтД как состояние, характеризующееся повышением систолического артериального давления выше базового значения на 20 мм рт.ст. Средние показатели базового артериального давления у пациентов с высоким уровнем повреждения спинного мозга значительно ниже, чем в общей популяций [3]. Повышение артериального давления (АД) у рассматриваемой когорты пациентов может повлечь серьезные сердечно-сосудистые осложнения, такие как инфаркт миокарда, кровоизлияние в мозг, судороги, отек легких, отслоение сетчатки [4]. Также АвтД существенно ухудшает качество жизни и процесс реабилитации пациентов с ТСМ.
Распространенность автономной дисрефлексии и частота встречаемости ее эпизодов часто недооцениваются. В работе E. Lee и M. Joo у 26 (92,9%) из 28 пациентов с ТСМ выше уровня Th6 при суточном мониторировании АД отмечено от 1 до 10 эпизодов АвтД в день [5]. Несмотря на эталонный учет случаев АвтД в Соединенных Штатах Америки, показатели ее распространенности существенно варьируются и составляют 48–90% от всех лиц, получавших ТСМ выше сегмента T6. Пациенты с полным перерывом спинного мозга имеют гораздо более высокую частоту автономной дисрефлексии (91% с полной ТСМ против 27% с неполной ТСМ) [6].
В Российской Федерации отсутствуют крупные эпидемиологические исследования по автономной дисрефлексии, несмотря на то что увеличивается количество людей с ТСМ: за последние 70 лет количество таких больных возросло в 200 раз. Ежегодно в России ТСМ получают более 8000 человек [7].
На сегодняшний день методы лечения и профилактики автономной дисрефлексии ограниченны. В литературе можно найти данные об эффективности таких препаратов, как нифедипин [8], ингибиторов ангиотензинпревращающего фермента, баклофена [9], альфа-блокаторов [10], а также инъекций ботулинического нейропептида в детрузор [11]. Одним из перспективных направлений в профилактике автономной дисрефлексии является прием М-холинолитиков. M. Virseda-Chamorro и соавт. продемонстрировали опыт лечения АвтД препаратом фезотеродина [12]. В настоящее время заявлено о проведении 2-й фазы открытого нерандомизированного одноцентрового исследования, в котором оценивается влияние фезотеродина на частоту и тяжесть проявления автономной дисрефлексии у пациентов с ТСМ выше сегмента Th6 [13]. Молекулярная структура препарата препятствует его проникновению через гемато-энцефалический барьер, снижая опосредованные центральной нервной системой (ЦНС) побочные эффекты по сравнению с другими антимускариновыми препаратами, такими как дарифенацин, солифенацин, толтеродин, оксибутин [14].
Цель исследования – оценить эффективность фезотеродина в профилактике автономной дисрефлексии у пациентов с нейрогенной детрузорной гиперактивностью.
Материалы и методы. В исследование были включены 53 пациента с ТСМ выше сегмента T6 (7 женщин и 46 мужчин). Работа проведена на базе медицинского научно-образовательного центра МГУ им. М. В. Ломоносова и реабилитационного центра для инвалидов «Преодоление» в период с 2019 по 2022 г.
Дизайн исследования одобрен локальным независимым этическим комитетом Медицинского научно-образовательного центра Московского государственного университета им. М. В. Ломоносова (Протокол № 2/21 от 08.02.2021). Все пациенты или их законные представители перед началом исследования подписывали добровольное информированное согласие.
Исходное состояние всех 53 пациентов оценивалось на основании анкетирования (опросник ADFSCI – для предварительной оценки частоты и тяжести проявления автономной дисрефлексии), качества жизни в рамках опросника NBSS, определения базового АД, суточного мониторирования АД с заполнением дневника самонаблюдения, цистометрии наполнения с одновременным мониторингом АД и ЧСС. Уродинамическое исследование в объеме цистометрии наполнения с одновременным мониторингом АД и ЧСС рассматривали как одно из наиболее точных подтверждений связи автономной дисрефлексии с нейрогенной дисфункцией мочевого пузыря (НДМП) [2]. Затем пациенты были разделены на две, основную и контрольную, группы.
Контрольный опрос по анкетам ADFSCI и NBSS проводился каждые 4 нед. в течение 12 нед. наблюдения. Полное обследование в исходном объеме проводилось по окончанию 12 нед. Пациенты контрольной группы (n=20) не получали в течение 12 нед. какого-либо лечения, влияющего на функциональное состояние нижних мочевыводящих путей.
Исследование выполнено в соответствии положениями Хельсинкской декларации (пересмотренной в Форталезе, Бразилия, в октябре 2013 г.). Статистический анализ: сбор и последующий анализ данных осуществляли с использованием программного обеспечения MS Excel, 2016, JASP v.0.16.3 (University of Amsterdam, Amsterdam, Netherlands, 2022). Данные количественных переменных представляли в виде таблиц, в которых были указаны среднее значение, медиана, стандартное отклонение, минимум, максимум, Q1 и Q3. Для анализа количественных переменных в связанных группах использовали критерий Вилкоксона или критерий Фридмана, приводили точное значение вероятности ошибки первого рода (p-value). Также для теста Фридмана приводились результаты post-hoc-теста, скорректированные по Bonferroni и Holm. Статистически значимыми считались результаты при значении ошибки первого рода p<0,05. Визуализацию количественных переменных проводили с помощью графиков типа box plot и raincloud plot. Визуализация категориальных переменных была реализована с помощью столбчатых диаграмм.
Результаты. Основная и контрольная группы не имели гендерных различий (p=0,18; точный критерий Фишера). Средний возраст пациентов основной группы составил 35,2±8,8 года, контрольной – 42,3±10,7 года, различия по возрасту были статистически значимыми (p=0,019, U-критерий Манна–Уитни). В контрольной группе ТСМ была получена в среднем 10,5±6,8 года назад (минимум – 2 года, максимум – 26 лет), в основной – 8,6±6,1 года назад (минимум – 1 год, максимум – 21 год), различия статистически не значимы (p=0,33, U-критерий Манна–Уитни). Уровень травмы в группах визуализирован на рис. 1.
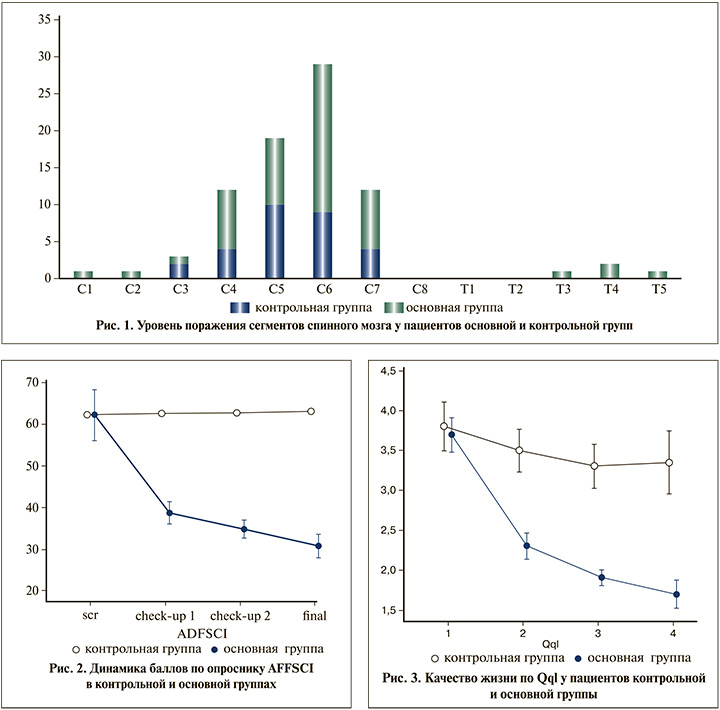
По способу отведения мочи пациенты основной и конт-рольной групп не имели значимых различий (p=0,053).
Пациенты, принимавшие фезотеродин, показали статистически значимое улучшение по опроснику ADFSCI после лечения (p<0,001), результаты представлены на рис. 2.
У контрольной группы динамика отсутствовала (p=0,24) (табл. 1).
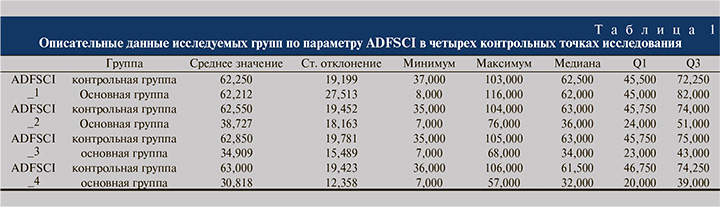
Качество жизни по опроснику NBSS также статистически значимо улучшалось в основной группе (p<0.001) и не изменялось в группе контроля (рис. 3).
По данным суточного мониторирования артериального давления (СМАД) и цистометрии с одновременным мониторингом АД, в основной группе статистически значимо снизилось количество регистрируемых эпизодов автономной дисрефлексии, максимальное суточное систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД), максимальное детрузорное давление, а также САД и ДАД при достижении цистометрической емкости. Наблюдалось статистически значимое увеличение максимальной емкости мочевого пузыря и комплаенса мочевого пузыря. Данные результаты демонстрируют положительный эффект приема препарата. Сравнительная характеристика параметров для основной и контрольной групп отражена в табл. 2.

Обсуждение. Представленное исследование является первым подобным исследованием, проведенным на российских пациентах, поэтому сравнить результаты нашего исследования с другими отечественными работами не представляется возможным. Наиболее близкой к нашему исследованию по дизайну можно отнести работу М. Walter и соавт., проведенную с 12 пациентами с повреждением спинного мозга на уровне или выше сегмента Th6 [13].
В нем отмечается увеличение максимальной детрузорной емкости и качества жизни по Qol у пациентов, получавших фезотеродин. Исследование, представленное нами, отличается рандомизацией и большим количеством пациентов, а также разнообразием инструментов оценки достигнутого результата.
В исследовании С. Konstantinidis и соавт. фезотеродин являлся эффективным средством для лечения нейрогенной гиперактивности детрузора у пациентов с травмой спинного мозга или рассеянным склерозом [15], что согласуется с результатами нашего исследования.
Т. Yonguc и соавт. сообщали о значительном уменьшении выраженности симптомов гиперактивного мочевого пузыря у пожилых пациентов с болезнью Паркинсона при продолжительном лечении фезотеродином в дозе 4 мг без влияния на когнитивные функции [16]. В другом исследовании C. DuBeau и соавт. показали, что фезотеродин (12-недельное лечение в дозе от 4 до 8 мг в день) не только приводил к значительному улучшению эпизодов ургентного недержания мочи в течение 24 ч и качества жизни у лиц пожилого возраста, но и не оказывал отрицательного влияния на когнитивные функции по сравнению с плацебо [17]. В нашем исследовании пациенты были моложе и их когнитивные функции не оценивались.
С учетом повышенного риска сердечно-сосудистых заболеваний у исследуемой когорты больных [18] наши результаты имеют решающее значение, поскольку внезапное повышение САД может приводить к опасным для жизни последствиям, ставя под угрозу благополучие и качество жизни людей с травмой спинного мозга. Представленное исследование имеет ограничения в виде отсутствия наблюдения после 3 мес. лечения, величины выборки пациентов, а также отсутствия данных о влиянии препарата на когнитивные функции.
Выводы. Полученные результаты указывают на эффективность фезотеродина в купировании автономной дисрефлексии у пациентов с нейрогенной детрузорной гиперактивностью на фоне травмы спинного мозга. Препарат подтвердил свою эффективность на основании купирования подъемов АД, снижения гиперактивности детрузора, увеличения цистометрической емкости мочевого пузыря при цистомерии наполнения, выполняемой с мониторингом АД. Установлено положительное влияние фезотеродина на качество жизни выбранной когорты пациентов, связанное со снижением тяжести и частоты эпизодов автономной дисрефлексии.



