Послеоперационная острая задержка мочи (ОЗМ), или ишурия, – распространенное патологическое состояние в послеоперационном периоде, обусловленное накоплением мочи в мочевом пузыре (МП) вследствие невозможности самостоятельного мочеиспускания. Согласно опубликованным данным, частота встречаемости послеоперационной ОЗМ составляет от 3 до 70% среди всех хирургических вмешательств [1]. Мужской пол и возраст пациентов старше 50 лет ассоциированы с высокой частотой развития ишурии. К другим факторам, влияющим на развитие ОЗМ в послеоперационном периоде, относятся вид хирургического вмешательства, продолжительность операции, коморбидный статус пациента (неврологические заболевания - инсульт, полиомиелит, церебральный паралич, рассеянный склероз, диабетическая/алкогольная нейропатия), периоперационная медикаментозная терапия (антихолинергические препараты, β-адреноблокаторы и симпатомиметики), большая инфузионная нагрузка и вид анестезиологического пособия [2]. В целях разрешения возникшей ОЗМ применяют катетеризацию мочевого пузыря, однако она увеличивает риск развития катетер-ассоциированной инфекции. Кроме того, в случаях, когда катетеризацию осуществляет специалист, не обладающий должными навыками установки уретрального катетера, возможно развитие осложнений, требующих дополнительных манипуляций и даже хирургических вмешательств. С учетом вышеописанных трудностей ведения таких пациентов особую важность имеет профилактическое использование лекарственных препаратов в периоперационном периоде. Препаратами выбора для профилактики ишурии являются α-адреноблокаторы. С учетом возможных системных побочных эффектов применения этих препаратов появляется все больше исследований, сосредоточенных на изучении фармакодинамики уроселективных α-адреноблокаторов. Наиболее исследованным и получившим широкое распространение в урологической практике является уроселективный α-адреноблокатор тамсулозин. В данном литературном обзоре рассмотрены актуальные причины и факторы риска развития ОЗМ в послеоперационном периоде, а также результаты применения тамсулозина у пациентов хирургического профиля.
Проведен обзор опубликованной научной литературы в базах PubMed и Scopus с января 2013 по июнь 2023 г. на предмет оценки частоты послеоперационной ОЗМ и эффективности назначения тамсулозина в качестве ее профилактики. Осуществлен расширенный поиск по следующим ключевым словам: «послеоперационная острая задержка мочи», «факторы/предикторы развития ОЗМ», «профилактика ОЗМ», «α-адреноблокаторы», «тамсулозин».
Нормальная физиология мочеиспускания
В норме емкость мочевого пузыря взрослого человека составляет от 400 до 600 мл. В акте мочеиспускания задействован комплекс анатомических структур, включающий сам мочевой пузырь, внутренний (шейка МП) и наружный сфинктеры, а также мочеиспускательный канал. В основе регуляции работы вышеописанных структур лежит взаимодействие вегетативного (симпатического и парасимпатического) и соматического отделов нервной системы. Начинаясь в промежуточных ядрах крестцовых сегментов, холинергические преганглионарные волокна проходят через тазовое сплетение и оканчиваются в стенке МП. Парасимпатические волокна вызывают сокращение детрузора и расслабление шейки мочевого пузыря, способствуя акту мочеиспускания. Медиаторами, регулирующими работу парасимпатического отдела указанных структур, являются ацетилхолин, воздействующий на М2/M3 (мускариновые) рецепторы, и АТФ, активирующий P2X (пуринергические) рецепторы. Расслабление гладкомышечных клеток (ГМК) мочеиспускательного канала осуществляется при помощи высвобождения оксида азота (NO). Симпатический отдел регуляции мочеиспускания начинается в спинномозговом центре Якобсона и ганглиях нижнего брыжеечного сплетения, откуда в составе подчревного нерва достигает стенки мочевого пузыря. Выделяя норадреналин, симпатические волокна активируют β-адренергические рецепторы, которые способствуют расслаблению детрузора, и α1A/α1D-адренергические рецепторы, вызывающие сокращение внутреннего сфинктера мочеиспускательного канала ГМК уретры. Эти системы управляются спинномозговыми рефлексами, которые регулируются двумя центрами в стволе головного мозга – мостовым центром удержания мочи (МЦУ) и мостовым центром мочеиспускания (МЦМ или ядром Баррингтона). Соматический компонент иннервации включает двигательные нейроны, проходящие в срамном нерве, которые иннервируют поперечнополосатую мускулатуру наружного сфинктера мочеиспускательного канала.
Во время мочеиспускания выделяют фазу накопления и фазу опорожнения. Первый позыв к опорожнению ощущается при объеме мочевого пузыря около 150 мл. Рецепторы напряжения в стенке мочевого пузыря активируются при объеме примерно 300 мл, создавая ощущение наполнения. Их активация распространяет сигналы по миелинизированным (Aδ) и немиелинизированным (C) волокнам, проходящим через тазовые чувствительные нервы, достигая спинного мозга, где происходит активация парасимпатических нейронов. Включение парасимпатического нейрона стимулирует эфферентные тазовые нервы, которые приводят к сокращению детрузорной мышцы. Когда внутрипузырное давление достигает порога, необходимого для его опорожнения, сокращения детрузора увеличиваются по интенсивности, частоте и продолжительности. Это создает адекватное и синхронное сокращение мочевого пузыря, способствующее его быстрому опорожнению.
В случае наполнения МП и отсутствия возможности мочеиспускания афферентные стимулы от рецепторов растяжения мочевого пузыря наряду с проприоцептивными афферентными волокнами мочеиспускательного канала, полового члена, влагалища, промежности прямой кишки и анальных сфинктеров активируют симпатическую систему и мотонейроны наружного сфинктера мочеиспускательного канала, при этом подавляя парасимпатический компонент. Конечный эффект заключается в удержании мочи за счет сокращения сфинктеров и расслабления детрузора. Изученный механизм эфферентного компонента нейрорегуляции мочеиспускания представлен ниже (см. рисунок) [3].
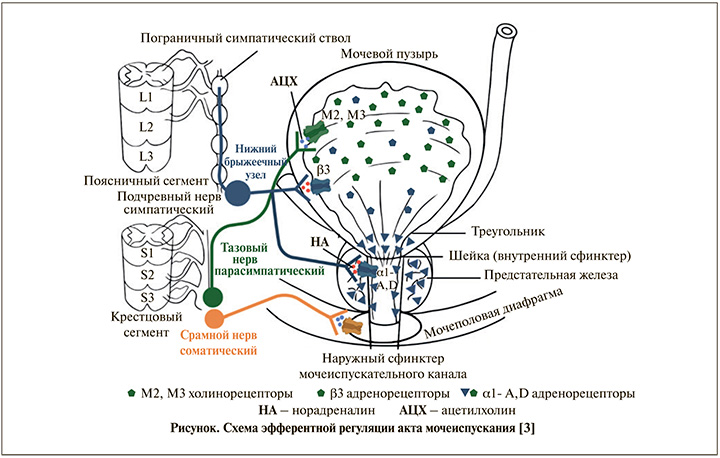
Механизм развития ОЗМ в послеоперационном периоде
Хирургическое вмешательство является стрессом для пациента, что приводит к стимуляции симпатической нервной системы и повышенной выработке катехоламинов. Развитие вышеописанных событий способствует активации α1A и α1D-адренергических рецепторов в области задней уретры и предстательной железы, вызывая острую задержку мочеиспускания. Другим патогенетическим механизмом выступает гипотония детрузора, которая может быть вызвана переполнением мочевого пузыря, применением холинолитических и наркотических препаратов. Последние способны снижать чувствительность рецепторов МП, что обусловливает увеличение абсолютного объема наполнения. Средства для общей, спинальной, эпидуральной анестезии вызывают атонию детрузора путем воздействия на вегетативную нервную систему. При блокировке афферентных и эфферентных нейронов исчезает восприятие позывов и ощущение наполнения МП вкупе с сокращениями детрузора, что в результате приводит к растяжению МП. Исследования на животных показали, что седативные и снотворные средства, а также ингаляционные анестетики подавляют мочеиспускательный рефлекс. Уродинамические эффекты, вызываемые этими агентами, обусловлены угнетением центра мочеиспускания в Варолиевом мосту и коре головного мозга [4–5]. Длительность оперативного и анестезиологического пособий ассоциированы с риском развития послеоперационной ОЗМ [6–10].
Внутривенное введение опиоидов ингибирует высвобождение ацетилхолина из синапсов крестцовых парасимпатических нейронов, контролирующих детрузор, что обусловливает возможное развитие послеоперационной ОЗМ [6, 11]. Объем инфузионной нагрузки во время операции влияет на развитие ишурии в послеоперационном периоде. У пациентов, перенесших оперативные вмешательства в аноректальной области, а также герниопластику при объеме внутривенной инфузии более 750 мл, риск развития ОЗМ увеличивался в 2,3 раза по сравнению с другими хирургическими методами лечения. Избыточное внутривенное введение различных растворов может приводить к растяжению мочевого пузыря [12]. По данным Keita и соавт. объем наполнения МП более 270 мл является фактором риска возникновения ОЗМ в послеоперационном периоде [13].
По данным мета-анализов и исследований можно выделить следующие факторы риска развития послеоперационной ОЗМ (табл. 1) [2, 14, 15]:

Вид оперативного вмешательства
Встречаемость послеоперационной ОЗМ среди всех пациентов хирургического профиля составляет в среднем 3,8% [16, 17]. В зависимости от вида оперативного пособия и зоны интереса хирурга можно выделить следующие данные о возникновении послеоперационной ОЗМ (табл. 2).

Осложнения, ассоциированные с ОЗМ в послеоперационном периоде
Среди пациентов с ОЗМ перерастяжение мочевого пузыря встречается у 44% пациентов. В исследованиях на животных обнаружили, что ишемия МП после его перерастяжения способствует стойким функциональным нарушениям. Katida и соавт. отметили, что при чрезмерном растяжении мочевого пузыря кроликов в промежутке от 4 до 24 ч концентрация мускариновых рецепторов снижалась, что приводило к снижению сократительной функции детрузора [33].
У пациентов с послеоперационной ОЗМ возможно развитие инфекции мочевыводящих путей ввиду гипотонии детрузора и отсутствия возможности опорожнения МП, а также после самой катетеризации. Присоединение нозокомиальной инфекции у пациентов после катетеризации ассоциировано с повышенными показателями смертности [34].
Болевой синдром, обусловленный чрезмерным растяжением МП, может вызывать брадикардию, повышение и снижение артериального давления (АД), нарушение сердечного ритма, а также асистолию [7].
Методы профилактики ОЗМ
При возникновении ОЗМ с целью предотвращения чрезмерного растяжения и повреждения детрузора, инфекции мочевыводящих путей и гидронефроза действия врача должны быть направлены на дренирование мочевыводящих путей, однако нельзя забывать о риске развития катетер-ассоциированной инфекции (КАИ). Инфекции мочевыводящих путей являются наиболее распространенной причиной развития внутрибольничного инфекционного заболевания и в 70–80% случаев ассоциированы с наличием уретрального катетера. По данным Niel-Weise и соавт., периодическая катетеризация может быть связана с меньшей частотой инфекции, но является более дорогостоящей [35]. Несмотря на то, что периодическая катетеризация является эффективным методом лечения задержки мочи, она приемлема не для всех пациентов. Для тех, кто не может самостоятельно проводить катетеризацию амбулаторно, это может оказаться неосуществимым.
Длительность катетеризации является важным предиктором КАИ, повышая риск развития на 4–7% каждый день при установленном уретральном катетере [36, 37]. Для снижения частоты КАИ рекомендуется раннее удаление уретрального катетера [38]. Вместе с тем раннее удаление катетера ассоциировано с большим риском развития ОЗМ и повторной катетеризации [39]. В связи с этим для медикаментозной профилактики развития ОЗМ используют α-адреноблокаторы. Альфа1-адренорецепторы в большом количестве представлены в предстательной железе, шейке МР и наружном сфинктере мочеиспускательного канала и в меньшем количестве – в теле МП [40]. Международная ассоциация фармакологов выделяет 3 подтипа α1-адренорецепторов: α1A, α1B и α1D [41]. Для снижения системного фармакологического эффекта от препаратов группы α-адреноблокаторов с 1980 г. в клиническую практику вошли селективные α1-адреноблокаторы. Выделяют уроселективные α1-адреноблокаторы, направленные на блокаду α1А и α1D-адренорецеторов, локализованных в гладкомышечных клетках урогенитального тракта [42, 43]. Неселективные α-адреноблокаторы ассоциированы с высокой частотой развития побочных эффектов со стороны сердечно-сосудистой системы по причине воздействия на расположенные в сосудах α1B-адренорецепторы.
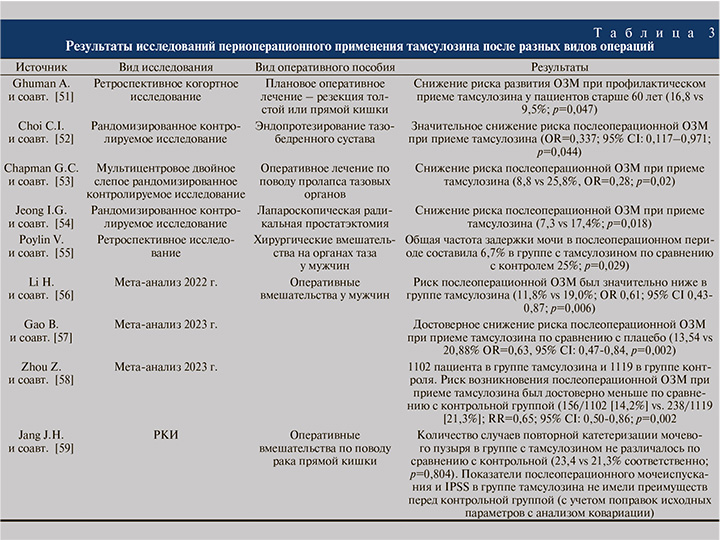
Уроселективный α1-адреноблокатор тамсулозин продемонстрировал свою клиническую эффективность у мужчин с симптомами нижних мочевыводящих путей на фоне доброкачественной гиперплазии предстательной железы (ДГПЖ) [44, 45]. С учетом высокой селективности тамсулозин считается безопасным препаратом с минимальным количеством побочных эффектов и осложнений в отношении сердечно-сосудистой системы. По данным мета-анализа, в котором оценивалась безопасность препаратов группы α-адреноблокаторов относительно развития осложнений со стороны сердечно-сосудистой системы, было показано, что отношение шансов в контексте развития побочных эффектов составляет 3,71 для теразозина, 3,32 для доксазозина, 1,66 для альфузозина и 1,42 для тамсулозина по сравнению с плацебо [46, 47]. Управление по контролю за продуктами и лекарствами в США (food and drug administration – FDA) одобрило применение тамсулозина у мужчин с симптомами нижних мочевыводящих путей (СНМП)/ДГПЖ, однако были также проведены исследования об использовании препарата у женщин с СНМП [48–50]. Несмотря на большое число исследований, свидетельствующих о положительной роли тамсулозина для профилактики ОЗМ в периоперационном периоде, встречаются и противоречивые результаты. В частности, Jang и соавт. сообщили об отсутствии преимущества применения тамсулозина в дозировке 0,2 мг в качестве профилактики развития послеоперационной ОЗМ [59]. В табл. 3 приведены данные о профилактическом использовании тамсулозина в периоперационном периоде.
Вопросы назначения оптимального α-адреноблокатора в периоперационном периоде не теряют своей актуальности. Не существует стандартизированных алгоритмов применения α-адреноблокаторов у разных категорий пациентов после различных видов операций. Неясно, следует ли назначать α-адреноблокатор до, после или и до, и после операции. С учетом способности тамсулозина увеличивать концентрацию активного вещества в плазме крови на 5-е сутки на 60–70% по сравнению с однократным приемом и другие фармакокинетические особенности в работе А. В. Мельникова предложена схема курса, подразумевающая назначение α1-адреноблокаторов за 5 дней до оперативного вмешательства вплоть до 3 суток в послеоперационном периоде [60]. Длительность приема после операции и срок дренирования мочевого пузыря уретральным катетером также остаются предметом дискуссии. Нет единого мнения, в какой момент операции и каким специалистом должен быть установлен уретральный катетер (в клинической практике часто это делает медицинская сестра). Врачи-анестезиологи по-разному смотрят на необходимость приема пациентом α-адреноблокатора утром в день проведения операции. Риски, связанные с установкой уретрального катетера, редко находят отражение в информированном согласии, которое пациент подписывает перед операцией. Имеются и иные нерешенные вопросы, связанные с обсуждаемой темой.
Отталкиваясь от конкретного применяемого α-адреноблокатора, следует учитывать режим, дозировку и длительность его приема. Будущие исследования должны быть направлены на создание клинических рекомендаций и алгоритмов по профилактике послеоперационной ОЗМ для клиницистов разного профиля. Согласно данным фармакоэкономического анализа, применение α1-адреноблокаторов является наиболее экономически целесообразным средством профилактики развития ишурии у пациентов хирургического профиля с расчетом в среднем на одного пациента [60].
Послеоперационная ОЗМ является распространенным осложнением у пациентов хирургического профиля. Несмотря на известные факторы риска развития вышеописанного осложнения, в клинической практике многих специалистов/лечебных учреждений отсутствует адекватная оценка риска развития ОЗМ и не используются стандартизированные предоперационные алгоритмы по ее профилактике. Скорректированный персонализированный подход к назначению селективных α-адреноблокаторов до и после разных видов операций позволяет минимизировать трудности ведения пациентов и улучшает их качество жизни/удовлетворенность лечением. Результаты проведенных исследований позволяют рекомендовать назначение α1-адреноблокаторов в периоперационном периоде различным группам больных. Назначение тамсулозина в качестве периоперационной профилактики ОЗМ достоверно снижает риск ее возникновения.



