Врожденные аномалии мочеиспускательного канала (уретры), такие как гипоспадия, и приобретенные дефекты уретры, такие как стриктуры уретры, представляют собой основные клинические проявления в урологической практике [1, 2]. Текущие методы лечения включают хирургические (реконструктивные) методы с ограниченной эффективностью и широкими вариациями между пациентами, но потенциально часто сопровождающимися значительными побочными эффектами (например, хроническим воспалением, риском рецидива стриктур или формированием свищей) [3]. Следовательно, необходимость решения вышеуказанных проблем очень актуально. Достижения в области регенеративной медицины и тканевой инженерии за последние два десятилетия могут предложить альтернативные подходы к реконструктивным операциям на уретре (уретропластике).
Регенеративная медицина – это развивающаяся область, которая сосредоточена на восстановлении, замене или регенерации тканей и органов. Она включает несколько дисциплин, посвященных различным аспектам процесса регенерации, в том числе клеточную биологию, материаловедение и биоинженерию [4]. Фундаментальное отличие регенеративной медицины от более традиционных терапевтических стратегий заключается в том, что целью является не только остановить текущий патологический процесс, но и восстановить или усилить функцию ткани или органа. Такие технологии включают использование децеллюлизированных (бесклеточных) биоматериалов, клеточного материала или того и другого вместе при уретропластике и могут применяться для лечения как врожденных, так и приобретенных заболеваний уретры [5, 6]. Кроме того, разработка стратегий тканевой инженерии, включающих использование стромально-васкулярной фракции (СВФ) или мезенхимальных стволовых клеток (МСК) аутологичной жировой ткани, имеет особые перспективы для преодоления недостатков, связанных с использованием клеток из других областей тела пациента, и поиска решений в терапии заболеваний уретры. Ряд экспериментальных проектов успешно использовали СВФ/МСК, и несколько пилотных исследований на людях указывают на потенциал терапии данным типом клеток [7, 8]. Данной работой мы хотели бы продемонстрировать последние достижения использования регенеративных технологий при реконструктивных операциях на уретре. Кроме того, мы более подробно остановимся на изучении возможностей использования клеточного компонента СВФ, учитывая его потенциал.
Биоматериалы
Как известно, функцией используемых биоматериалов в клинической медицине является контроль биологической микросреды, обеспечивая трехмерное (3D) пространство для регенерируемых тканей [9]. Функции биоматериалов, используемых в тканевой инженерии, зависят от свойств самих выбранных биоматериалов. В частности, в дополнение к роли средств доставки для транспортировки питательных веществ и утилизации отходов свойства выбранных биоматериалов должны также включать функции стимулирования пролиферации, дифференциации и адгезии (прикрепления) клеток [10]. Кроме того, идеальные биоматериалы должны обладать контролируемой скоростью биодеградации без токсичности. Для реконструкции уретры используются различные биоматериалы [11]. Они подразделяются на два основных типа, а именно синтетические и природные биоматериалы (рис. 1). Первый тип включает неразлагаемые биоматериалы (например, силикон и полиуретан) и биоразлагаемые полимеры, такие как полимолочная кислота (polylactic acid –PLA), полигликолевая кислота и полимолочно-гликолевая кислота (polylactic-glycolic acid – PLGA) [12].
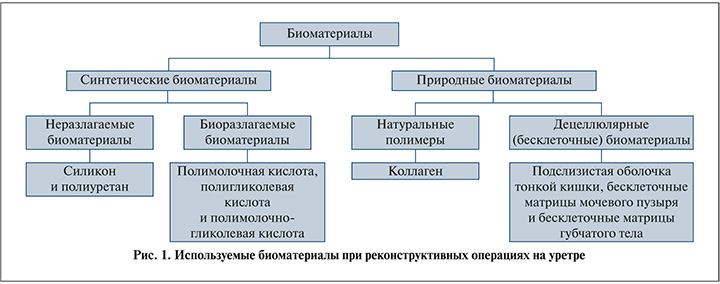
Известно, что неразлагаемые биоматериалы, используемые при реконструкции уретры, показали плохие результаты с возникновением различных осложнений, таких как кальцификация и свищи [13]. Поэтому приоритет дается биоразлагаемым биоматериалам, поскольку они также дают лучшие результаты. К природным биоматериалам относятся следующие две группы: 1) натуральные полимеры (преимущественно коллаген) и 2) бесклеточные матриксы, полученные из кадаверинах или органов животных ферментативным, физическим или химическим методами [14, 15]. Наиболее часто используемые бесклеточные тканевые матрицы (скаффолды) при реконструкции уретры представляют собой подслизистую оболочку тонкой кишки, бесклеточные матрицы мочевого пузыря и бесклеточные матрицы губчатого тела [15, 16]. Экспериментально оцениваются преимущества и недостатки биоматериалов при уретропластике. Синтетические биоматериалы более доступны, хорошо воспроизводимы и обладают отличными механическими свойствами, однако предполагают отсутствие цитокинов и белков внеклеточного матрикса (ВКМ), которые являются основным фактором регуляции клеточной пролиферации [17]. Некоторые синтетические полимеры могут вызывать воспалительные реакции in vivo и генерировать продукты окислительного стресса, которые способны нарушить рост клеток [18]. Природные биоматериалы сохраняют трехмерную структуру и биоактивные факторы исходной ткани и представляют собой биосовместимые и биоразлагаемые материалы, однако характеризуются отсутствием структурной прочности и трудноконтролируемых биохимических свойств, что связано с фиброзом и контрактурой при имплантации их в уретру [19].
Применение клеточных технологий
Большинство исследований показали, что использование децеллюлизированных биоматериалов может приводить к послеоперационному фиброзу [20–22]. В отношении обширных поражений уретры имеет место быть применение биоматериалов с посевом клеточного компонента для предотвращения образования рубцов и улучшения регенерации тканей. Потенциальный механизм включает содействие быстрому формированию так называемых уротелиальных барьеров биоматериалами, засеянными клетками, и это может также предотвращать раздражение стенки уретры мочой. Известно, что моча токсична для клеток-предшественниц или стволовых клеток, рекрутированных из нормальных соседних тканей [23]. Кроме того, моча также является основным фактором воспалительной инфильтрации, что приводит к более ускоренному образованию фиброзной ткани [24]. Источники клеток, используемые при реконструкции уретры, включают дифференцированные первичные клетки и стволовые клетки (рис. 2).
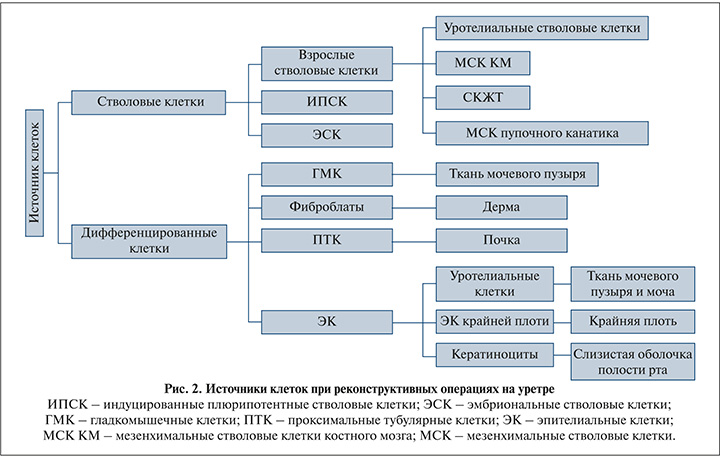
Аутологичная ткань/клетки, получаемые из мочевого пузыря, могут быть использованы при реконструктивных операциях уретры [25]. Биопсия мочевого пузыря является широко используемым методом сбора клеточного материала. Однако она является инвазивным методом и чревата осложнениями [25]. При этом ряд исследователей получили эпителиальные клетки мочевого пузыря из мочи [26]. Клетки, выделенные из мочи, обладают характеристиками нормальных клеток мочевого пузыря и потенциально могут быть использованы для реконструкции уретры. Эпидермальные клетки могут быть легко получены из крайней плоти [27]. Эти клетки можно легко инкубировать, и их количества достаточно при посеве на бесклеточный биоматериал. Эпителиальные клетки, полученные из полости рта, также могут быть адаптированы для замещения тканей уретры, поскольку их структура сходна [28, 29]. Хоть данный подход получения аутологичной эпителиальной ткани менее инвазивен по сравнению с биопсией мочевого пузыря, он также может сопровождаться осложнениями [28]. Гладкомышечные клетки (ГМК) могут быть также выделены из мочевого пузыря, где данный тип клеток может предотвращать спайки стенок и дальнейшее повреждение стенки уретры за счет быстрого формирования мышечного слоя [30]. Кроме того, трансформирующий фактор роста-b1 (transforming growth factor-b1 – TGF-b1), секретируемый ГМК, может способствовать ангиогенезу [30].
Стволовые клетки считаются недифференцированными клетками и могут дифференцироваться в широкий спектр клеток. Эмбриональные стволовые клетки (ЭСК) теоретически рассматриваются как идеальный источник засеваемых клеток из-за потенциала множественной дифференцировки [31]. Кроме того, ЭСК могут дифференцироваться в клетки уретры при обработке транс-ретиноевой кислотой in vitro [32]. Способность индуцировать ЭСК в уротелий in vitro имеет большое значение для реконструкции уретры. Однако применение ограничено серьезной проблемой, а именно происхождением их и вероятностью образования опухолей [33]. Индуцированные плюрипотентные стволовые клетки (ИПСК) являются альтернативой ЭСК и обладают важными характеристиками, сходными с ЭСК, такими как способность к пролиферации и клонированию. В частности, ИПСК могут быть получены из аутологичных соматических клеток взрослого человека с помощью вирусных векторов для экспрессии ключевых факторов SOX2, c-Myc, OCT4 и Klf4 [34, 35]. Один из ярких примеров был продемонстрирован в работе Osborn и соавт., где он и его команда разработали эффективный протокол для индукции ИПСК в уротелий in vitro, обеспечивая тем самым новый источник для регенеративной медицины при реконструктивных операциях на уретре [36].
Взрослые (постнатальные) стволовые клетки из тканей и органов взрослого человека, таких как костный мозг, кожа и жир, представляют собой резидентные стволовые клетки. Эти клетки поддерживают гомеостаз и регенерацию тканей после незначительного повреждения за счет способности к пролиферации и дифференцировке [37, 38]. Кроме того, взрослые стволовые клетки являются аутологичными и не вызывают явного иммунного отторжения [38]. Более того, использование этих клеток допустимо со стороны этических вопросов и относительно легко изолируется. Стволовые клетки, выделенные из мочеточника или мочевого пузыря, обладают свойством самообновления и могут дифференцироваться в уротелий [38, 39]. Стволовые клетки костного мозга имеют также перспективу для применения в реконструкциях уретры. Однако основной проблемой, связанной с применением данного типа клеток, является их небольшое количество в костном мозге, что влечет за собой значительное время для размножения in vitro и для получения «функциональных» клеток. Кроме того, процесс получения костного мозга довольно травматичен и требует более длительной реабилитации для донора [40].
Клеточная терапия никогда не перестает пользоваться популярностью в области медицинских наук, особенно в области регенеративной медицины. В последнее время жировая ткань стала объектом интереса многих исследователей и медицинских экспертов в связи с тем, что она представляет собой новый и потенциальный источник клеток для целей тканевой инженерии и регенеративной медицины. Например, СВФ, производная жировой ткани, дает оптимистичные результаты во многих сценариях. Ее биологический потенциал можно использовать и вводить в поврежденные ткани, особенно в области, в которых нарушена регенерация [41]. Это типичный признак стриктуры уретры – распространенного заболевания мочеиспускательного канала, вызванного патологическим рубцово-склеротическим процессом, характеризующимся стойким воспалением и деструкцией окружающих тканей [42]. Известно, что СВФ несет массу стволовых клеток и клеток-предшественниц, способных к самообновлению, дифференцировке и пролиферации [43]. Кроме того, они также секретируют несколько цитокинов и несколько факторов роста, эффективно поддерживая иммуномодулирующие эффекты и останавливая эскалацию провоспалительного статуса при стриктурах уретры in vivo [44, 45]. Несмотря на то что СВФ продемонстрировала эффективность, все же крайне желательны дополнительные доклинические и клинические исследования для дальнейшего выяснения ее потенциала в отношении использования в регенеративной медицине.
Можно предположить, что был достигнут многообещающий прогресс в регенеративных технологиях при реконструктивных операциях на уретре. Тем не менее эти многообещающие результаты представлены в основном только в исследованиях in vivo или in vitro и ряд вопросов остаются нерешенными для полноценного внедрения в клиническую практику, как, например, выбор источника клеток или типа биоматериалов. Кроме того, необходимо проводить дальнейшие многоцентровые исследования с большими выборками пациентов, чтобы подтвердить безопасность и осуществимость данных технологий в целях эффективной реконструкции уретры.



