1. СТРОМАЛЬНО-ВАСКУЛЯРНАЯ ФРАКЦИЯ (СВФ)
Известно, что жировая ткань является богатым источником клеток, перспективных для использования в тканевой инженерии и регенеративной медицине. СВФ, в частности, включает преадипоциты, МСК, перициты, T-регуляторные клетки, клетки-предшественники, эндотелиальные клетки (ЭК) и макрофаги [1]. Это способствует огромному потенциалу для терапевтического применения и исследуется по множеству клинических показаний, включая осложнения, связанные с диабетом, регенерацию периферических нервов, ожоговые раны, восстановление эректильной функции и при реконструктивных операциях уретры [2–6]. Регенеративная способность СВФ, вероятно, обусловлена гетерогенностью ее компонентов. Многочисленные исследования ранее продемонстрировали способность клеток, обнаруженных в СВФ, дифференцироваться в остеогенные, адипогенные и хондрогенные типы клеток [7].
Одним из наиболее распространенных типов клеток являются преадипоциты – предшественники зрелых адипоцитов. Недавние результаты исследований свидетельствуют о том, что этот тип клеток, также описываемый как нададвентициальная жировая стромальная клетка, или дедифференцированная жировая клетка, имеет многие из тех же фенотипических маркеров и характеристик, что и мезенхимальные стволовые клетки (МСК), что указывает на ее потенциальное участие в регенерации [8]. СВФ также содержит предшественники эндотелиальных клеток (ПЭК), которые обладают способностью индуцировать ангиогенез посредством высвобождения факторов роста, таких как фактор роста эндотелия сосудов (VEGF) и инсулиноподобный фактор роста-1 (IGF-1) [9]. Было показано, что макрофаги и моноциты, обнаруженные в клеточном компоненте СВФ, опосредуют иммунный ответ посредством экспрессии различных цитокинов, а некоторые демонстрируют пластическую адгезию и способность к многолинейной дифференцировке, наблюдаемую в линии МСК [10].
1. Особенности регенеративных свойств СВФ
Механизм действия клеточного компонента СВФ для устранения повреждений и дегенерации в некоторых отношениях все еще плохо изучен. Сначала предполагалось, что клетки должны приживаться и трансдифференцироваться, чтобы создавать новые клетки для осуществления репарации, однако на сегодняшний день, опираясь на множество результатов исследований, уже понятно, что это не всегда так. Например, стволовые клетки находятся в постоянной связи посредством биологической передачи сигналов с окружающей клеточной средой, а также посредством передачи сигналов обратной связи на своих собственных клеточных мембранах [1, 11]. Эта сигнальная система позволяет стволовым клеткам вызывать заживление и воздействовать на поврежденные клетки-мишени издалека без фактического приживления в каждом случае. Эта межклеточная связь может осуществляться посредством цитокинов или внеклеточных везикул (ВВ), которые могут содержать РНК, ДНК, мРНК, некодирующие РНК или пептиды. МСК в СВФ, как и все стволовые клетки, способны обнаруживать и интерпретировать сигнатуры биосигналов из поврежденной или дегенерированной ткани [12, 13].
1.1. Ангиогенез
Способность СВФ стимулировать ангиогенез/неоваскуляризацию имеет большое значение при заболеваниях, характеризующихся плохой васкуляризацией. Ангиогенные свойства СВФ, по-видимому, являются функцией его гетерогенного клеточного состава. Сюда входят несколько клеточных популяций, которые при объединении способствуют образованию новых кровеносных сосудов, включая МСК, ПЭП, макрофаги и фибробласты [14]. В связи с этим есть примеры того, что совместная имплантация МСК и ПЭК, выделенных из СВФ, приводит к большей неоваскуляризации, чем использование их по отдельности in vitro [15]. Процесс неоваскуляризации дополнительно стимулируется стромальными клетками посредством высвобождения факторов роста, таких как VEGF, фактор роста гепатоцитов (HGF) и трансформирующий фактор роста-β (TGF-β) [16, 17]. Также имеются доказательства того, что макрофаги, обнаруженные в СВФ, также важны для правильной структурной организации новых сосудов [18]. Перициты и ЭК, выделенные из СВФ, также непосредственно участвуют в формировании сосудов и ангиогенезе [19]. Кроме того, было продемонстрировано, что МСК секретируют VEGF, HGF и трансформирующий фактор роста бета-1 (TGF-β1), тем самым способствуя ангиогенезу за счет паракринного эффекта [20].
1.2 Иммуномодулирующий эффект
Результаты многих исследований демонстрируют снижение воспаления и иммунного ответа в месте инъекции СВФ [21]. Иммуномодулирующие свойства СВФ снова связаны с его разнообразными клеточными компонентами. Известно, что стволовые клетки и клетки-предшественники обладают противовоспалительными и антиапоптотическими свойствами, которые способствуют регенерации ткани реципиента [22]. Макрофаги в здоровой жировой ткани обычно имеют противовоспалительный фенотип М2, некоторые субпопуляции которого демонстрируют способность к дифференцировке [23]. СВФ также содержит Т-регуляторные клетки, которые экспрессируют высокие уровни иммуносупрессивных цитокинов. Эти Т-регуляторные клетки могут поддерживать фенотип M2 макрофагов в клеточной популяции СВФ, когда это необходимо [24]. Применение СВФ при различных моделях заболеваний in vivo практически всегда демонстрировало уменьшение секреции воспалительных цитокинов и факторов роста, таких как фактор некроза опухоли альфа (TNF-α) и интерлейкин-6 (IL-6) [25]. Таким образом, СВФ опосредует воспаление и иммунный ответ посредством экспрессии и подавления различных цитокинов. Это еще раз подтверждает представление о том, что СВФ способствует регенерации как непосредственно за счет высвобождения цитокинов, так и косвенно за счет паракринных эффектов на ткани хозяина.
1.3. Дифференциация и пролиферация
Известно, что использование стволовых клеток является эффективным способом регенерации поврежденных тканей из-за их естественной способности дифференцироваться в определенные линии клеток при помещении в соответствующую среду. Помимо этой мультипотентности СВФ может также индуцировать пролиферацию клеток-хозяев при введении в ту или иную поврежденную ткань. Потенциальный интерес клеточного компонента СВФ при реконструктивных операциях на уретре дополнительно подтверждается многими другими характеристиками этих клеток [26]. Во-первых, клетки СВФ содержат большое количество фибробластов, способных секретировать коллаген [27]. Более того, уже была отмечена способность клеток МСК секретировать и организовывать ВКМ с некоторой базовой стимуляцией [28]. Наконец, в отсутствие адипогенных факторов эти клетки не дифференцируются в адипоциты и обладают достаточно сильным потенциалом образования соединительной ткани [1]. С другой стороны, несколько исследований ясно показали, что МСК могут дифференцироваться в гладкомышечные или поперечнополосатые мышечные клетки [29]. Что касается гладкой мускулатуры, очень убедительное исследование Rodriguez и соавт. показало, что в дополнение к экспрессии классических маркеров ГМК (гладкомышечных клеток специфического альфа-актина, смутелина, кальпонина, кальдесмона, MHC и SM22) МСК способны продуцировать функциональные клетки, сокращающиеся при стимуляции карбахолом, с последующей релаксацией клеток примерно через 10 мин [30]. Этот пункт можно считать очень важным в том, что касается использования этих клеток в качестве регенеративных технологий для уретры. Кроме того, следует отметить, что ряд авторов указывают, что в экспериментальных процедурах выделения СВФ по крайней мере от 70 до 90% клеточной популяции являются положительными по миобластному маркеру CD56, а от 60 до 80% этих клеток являются CD34+ [31]. Эти проценты, вероятно, представляют собой важный аргумент, который может подчеркнуть потенциал этих клеток для восстановления уретры.
На сегодняшний день проведено мало исследований по использованию СВФ при заболеваниях уретры. Например, оригинальность первого исследования Rodriguez и соавт. основывается на том факте, что они использовали человеческие клетки (от липоаспирации) для повторной инъекции мышам и крысам. Более того, клетки, введенные в уретру, представляли собой смешанную популяцию клеток разных типов, которые культивировались в течение нескольких дней, но не отбирались заранее. Авторы показали, что клетки человека (помеченные флуоресцентным маркером) все еще присутствовали через 12 нед. после инъекции. Клетки имели морфологию и фенотип (актин-α), характерные для гладкой мускулатуры. Более того, недавние результаты той же группы показывают, что МСК, культивированные в среде, индуктивной для гладкой мускулатуры, и посеянные в среду из полимолочной кислоты, могут увеличивать массу гладкой мускулатуры и способны сокращаться [32]. На самом деле эти результаты очень обнадеживают для развития использования этих клеток, потому что теоретически они были бы способны восстанавливать гладкую мускулатуру, приводя к приобретению функции сокращения, что никогда не было продемонстрировано с помощью мезенхимальных клеток-предшественников (МКП).
1.4. Компоненты внеклеточного матрикса (ВКМ)
ВКМ действует как мощный каркас во многих типах тканей, ускоряя регенеративные функции близлежащих клеток. Он состоит из структурных белков, таких как коллаген, ламинин, фибронектин и эластин, которые обычно секретируются фибробластами [33]. Одним из отличительных признаков функции ВКМ является его способность динамически взаимодействовать с интегриновыми белками на адгезивных клетках [33]. Присоединение интегринов к рецепторам ВКМ запускает сигнальные пути и изменяет клеточную активность. ВКМ также способствует клеточному движению и миграции, поскольку клетка использует связи интегрин–цитоскелет, чтобы подтягиваться вперед [34]. Кроме того, ВКМ способствует росту сосудистых сетей, опосредуя скорость морфогенеза и миграции во время ангиогенеза [35]. Поскольку СВФ содержит секретирующие матрикс фибробласты и другие стромальные клетки, применение СВФ потенциально выгодно для типов тканей, для которых используются трехмерные (3D) биоматериалы. Имеется доказательство того, что наличие трехмерной структуры способствует пролиферации близлежащих адипоцитов [36]. Вполне вероятно, что секретирующие коллаген фибробласты из СВФ улучшают жизнеспособность жирового трансплантата во время липотрансплантации, обогащенной клетками, с помощью сходных механизмов.
1.5. Последовательность выживаемости клеточного компонента СВФ после имплантации
Существует несколько общепринятых теорий, касающихся последовательностей выживаемости клеточного компонента СВФ, происходящих во время липотрансфера. В теории “замены” макрофаги фагоцитируют липидные капли, изменяя свою форму от сферической клетки до более прочного плоского, веретенообразного, фибробластоподобного фенотипа, который более способен выживать в ишемической среде [37]. Этот процесс дедифференцировки является механизмом выживания для этих адипоцитов, которые затем могут повторно дифференцироваться, когда условия окружающей среды будут более благоприятными. Точно так же процесс аутофагии (фрагментации клетки) способствует выживанию клеток за счет рециркуляции пригодных для использования фрагментированных компонентов [38]. В любом случае этот процесс позволяет клеткам переживать начальный период гипоксии и повышенного воспаления и подготавливает среду ВКМ к регенерации, индуцируя васкуляризацию и иммунную модуляцию [39]. Как только воспаление остановлено и васкуляризация установлена, регенеративный процесс может происходить из экзогенных клеток, трансплантированных в область через трансплантат и/или из окружающей эндогенной ткани хозяина, на которую воздействовали компоненты СВФ [39, 40].
Теория выживания клеточной популяции СВФ утверждает, что клетки способны к самостоятельному выживанию в течение длительного времени после инъекции. Однако по результатам некоторых авторов было предположено, что выживаемость адипоцитов в трансплантате зависит от синергетических механизмов ангиогенеза, дифференцировки и иммуномодуляции [41, 42]. Выживание адипоцитов в значительной степени зависит от наличия близлежащей сосудистой сети. При этом факторы роста, секретируемые клетками СВФ, такие как VEGF и HGF, способствуют ангиогенезу. Отслеживание маркеров CD34 показало, что стромальные стволовые клетки из СВФ дифференцируются в зрелые адипоциты [31]. Более того, миграция из ткани хозяина и дедифференцировка также могут поставлять клетки-предшественники. Последующие перекрестные помехи между клетками-предшественниками и иммунными клетками помогают создавать микросреду для регенерации. Таким образом, регенерация представляет собой поэтапный процесс адаптации в поврежденной среде с последующим взаимодействием компонентов СВФ с раневым ложем и с клеточными компонентами ткани самого хозяина.
2. ОСНОВНЫЕ ПОДХОДЫ
Регенеративные технологии и тканевая инженерия при реконструктивных операциях на уретре в основном включают следующие два подхода: использование бесклеточных биоматериалов и биоматериалы с клеточным посевом. Бесклеточные матрицы считаются готовым биоматериалом из-за простоты производства. Кроме того, заболеваемость донора может быть снижена, поскольку для сбора клеток не требуется никаких хирургических процедур [43]. Бесклеточные матриксы восстанавливают уретру, направляя регенерацию уротелиальных клеток и соединительной ткани. Таким образом, использование бесклеточного биоматериал может быть осуществимо только тогда, когда стенка уретры здорова и хорошо васкуляризирована.
В табл. 1 перечислены подходы к использованию бесклеточных биоматериалов, применяемых в ряде экспериментальных исследований при реконструкциях уретры [44–50].
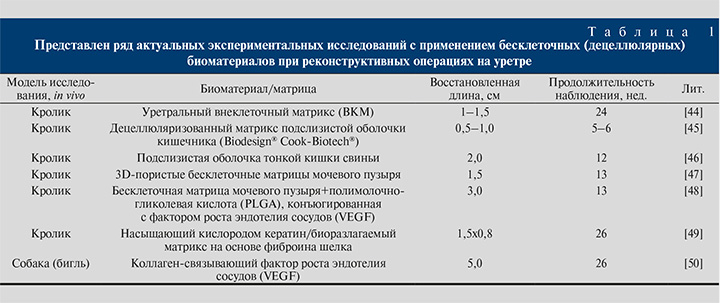
Некоторые параметры биоматериалов, такие как пористость, могут влиять на перенос питательных веществ и клеточных отходов. Соответствующий размер пор способствует пролиферации, инфильтрации и дифференцировке клеток [51]. Кроме того, результаты некоторых работ продемонстрировали, что биоматериалы, генерирующие кислород, способствуют регенерации дефектов мочевыводящих путей и снижению воспалительной реакции после имплантации [49]. При всем при том можно сказать, что применение бесклеточных биоматериалов при лечении стриктур уретры ограниченно, так как их использование возможно только при коротких стриктурах (до 2 см), когда существует здоровая и хорошо васкуляризированная часть стенки уретры [52]. Ограничения в использовании бесклеточных биоматериалов побудили исследователей к поиску других подходящих подходов. Для преодоления недостатков, наблюдаемых при использовании бесклеточных биоматериалов, были предложены материалы с посевом аутологичными клетками. В табл. 2 приведены результаты некоторых работ с использованием биоматериалов с посевом клеток для реконструкции уретры [51–60].
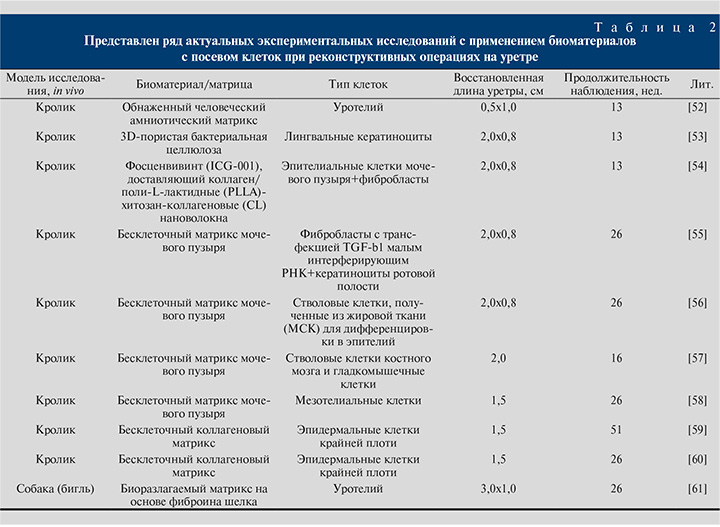
Хотя во всем мире сообщалось о большом количестве исследований, посвященных реконструкции мочевыводящих путей, результаты по клиническим исследованиям ограниченны. Кроме того, выбранная клетка в идеале должна легко выделяться и активно размножаться с образованием достаточного количества клеток in vitro, где стволовые клетки обладают потенциалом множественной дифференцировки. Таким образом, для рекрутирования и дифференцировки стволовых клеток должны быть созданы особые условия. Трансплантат (биоматериал) с засеянными клетками имеет такие недостатки, как необходимость периода культивирования клеток в лаборатории с чистым (стерильным) помещением, то есть в настоящее время он не подходит в качестве готового продукта. Есть также последствия стоимости и времени. Стоимость биоматериалов с посевом клеток в 6 раз выше стоимости трансплантата без посева клеток. Необходимо проводить дальнейшие исследования, чтобы повысить экономическую эффективность этого подхода.
3. ТЕКУЩИЕ ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ РАЗВИТИЯ
Таким образом, двумя основными компонентами стратегий регенеративной технологии при реконструктивных операциях на уретре являются клетки и биоматериалы. Введение клеток призвано стимулировать регенерацию, способствовать васкуляризации и/или дополнять выработку гормонов и факторов роста. Биоматериалы, которые включают как природные, так и синтетические матрицы (обычно называемые скаффолдами), являются важным инструментом регенеративной медицины. Помимо управления направлением роста новой ткани и обеспечения надлежащей пространственной среды для восстановления структуры и функции ткани биоматериалы могут вводить биологически активные факторы или привлекать клетки и факторы роста из организма после имплантации. Если биоматериал имплантируется без клеток, цель состоит в том, чтобы стимулировать естественную способность организма к самовосстановлению. Известно, что имеются большие достижения и успехи в традиционных хирургических методах реконструкции стриктур уретры. Тем не менее остается возможность для улучшения как стандартных подходов, так и подходов технологий регенеративной медицины. Регенеративные технологии при уретропластике должна показать либо клинически значимую превосходную эффективность, либо сомнительную эффективность с улучшенной экономической эффективностью и простотой использования и/или снижением заболеваемости. Чтобы любой из этих сценариев был оправдан, необходимы дополнительные исследования. Исследования, проведенные на сегодняшний день in vivo, показывают, что будущие подходы к регенеративным технологиям при уретропластике, вероятно, будут включать биоразлагаемый матрикс. Хотя клеточная терапия на сегодняшний день в основном использует аутологичные клеточные источники, дополнительные исследования могут предложить потенциальный источник аллогенных тканей, что позволит использовать их в готовом виде. Однако, несмотря на то что были идентифицированы источники природных или индуцированных плюрипотентных, или мультипотентных стволовых клеток, остается проблемой направить дифференцировку стволовых клеток на формирование функциональных тканей. Тем не менее введение СВФ может вызывать активную неоваскуляризацию и увеличивать количество клеток как гладкой, так и поперечно-полосатой мускулатуры уретры, увеличение секреции коллагена и эластина в периферических тканях и, возможно, улучшение неврологической иннервации. Более того, как и в случае с другими клетками-предшественниками, клеточный компонент СВФ является источником многих факторов роста, которые могут значительно улучшать функцию уретры. Кроме того, несколько других элементов могут выступать в пользу использования СВФ при лечении стриктур уретры. Во-первых, СВФ очень легко получить с помощью липосакции, что не представляет особого риска для пациента, поскольку липосакция, вероятно, является одной из самых безопасных доступных хирургических процедур. К тому же СВФ можно вводить сразу после выделения/изоляции. Действительно, это позволяет избегать культивирования клеток и последовательных пассажей, что значительно снижает риск заражения и мутаций, а также стоимость метода. Использование СВФ особенно приемлемо, о чем свидетельствует количество клеток, которые можно выделить из жировой ткани, относительно велико.
4. ЗАКЛЮЧЕНИЕ
Мы считаем, что подход к использованию СВФ может стать потенциально безопасным и эффективным методом терапии, связанным с ускорением процессов регенерации, и приносить огромную пользу пациентам с заболеваниями уретры в будущем.



