Введение. Мочеточниковые стенты с успехом широко используются в урологии с момента их первого применения в 1967 г. B. Zimskind [1]. Установка стента – неотъемлемая часть множества урологических операций, как реконструктивно-пластических вмешательств на мочеточнике, так и выполняемых при хирургическом лечении мочекаменной болезни [2–5]. Преимущества стентирования очевидны: малая травматичность дренирования, отсутствие рутинного применения рентгенологического и ультразвукового контроля, отсутствие наружного дренажа – все это в целом значительно снижает риск инфекционных осложнений, повышает качество жизни пациентов [6].
Тем не менее известно, что этот метод не лишен недостатков, главные из которых – это инкрустация стента и его инфицирование. Отложение солей на поверхности стента и образование биопленок между его поверхностью и слизистой мочеточника служат основной причиной развития осложнений [7, 8]. Эти два феномена взаимообусловливают и взаимоотягощяют друг друга. К доказанным факторам риска инкрустации относятся продолжительность стентирования, персистенция инфекции, хроническая почечная недостаточность, а также метаболические или врожденные аномалии. Несмотря на использование разнообразных материалов с различными физическими характеристиками, ни один из них не устойчив к осаждению кристаллов и возможной инкрустации [9, 10].
Адгезия солей магния и аммония приводит к обструкции стента в 50–74% случаев [7]. Колонизация полиуретановых стентов вне корреляционной зависимости от факта выявления урокультуры до стентирования происходит в первые часы–сутки после установки [11, 12]. В большинстве случаев со стента выделяют микст-инфекцию, обладающую высокой способностью к образованию биопленок. Биоценоз в биопленке приводит к седиментации мочевых солей на белковой матрице. Таким образом, формируется порочный круг [13].
Попытки нивелировать эти негативные эффекты привели к поиску новых материалов для изготовления стента, нанесению различных по составу нанопокрытий на его поверхность, а также к созданию биодеградируемых стентов [14, 15].
Цель исследования: изучить влияние поверхности стента на формирование солевой инкрустации и биопленок.
Материалы и методы. Работа выполнена на базе кафедры хирургических болезней и урологии ДПО ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России и научно-образовательного ресурсного центра «Нанотехнологии» ФГБОУ ВО «Омский государственный технический университет» Минобрнауки России.
В исследовании использовали рентгенконтрастные полиуретановые стенты типа «double pigtail» 6CH двух производителей (по 5 единиц каждого), далее именуемых как образец № 1 и образец № 2: новые стерильные маркировали буквой «Н», бывшие в употреблении (3-недельное нахождение в мочеточнике) – «БУ». Поводом к установке стали операции по поводу гидронефроза, выполненные в плановом порядке пациентам без признаков мочевой инфекции и мочекаменной болезни. Для исследования осуществлен забор участка стента из средней трети протяженностью 1 см.

Методика исследования
Поверхность стентов исследовали методами растровой электронной микроскопии (РЭМ) на микроскопе JEOLJCM-5700 и сканирующей зондовой микроскопии (СЗМ) на зондовой нанолаборатории NTEGRA Prima фирмы «NT-MDT» (Россия).
При РЭМ изображение формируется при сканировании пучка подобно растру электронно-лучевой трубки с последующей передачей сигнала от детектора электронов на экран. Топография образца исследуется с использованием вторичных электронов (SEI).
Так как исследуемые образцы выполнены из диэлектрического материала, что является не типичным для исследования методом РЭМ, возбуждение электронов образца проведен пучком электронов малой энергии (порядка 5 кэВ) в режиме высокого вакуума (порядка 10-5 Па).

Электронная микроскопия позволяет лишь визуально оценить характер образования биопленок и отложения кристаллов солей [14, 16]. Ограничением метода служит формирование плоскостного изображения, не позволяющего оценить толщину наложений, а также выраженность строения рельефа. В связи с этим нами использован дополнительный метод исследования – СЗМ, в основе которого лежит взаимодействие исследуемого образца с зондом – кантилевером. Применяли полуконтактную (прерывисто-контактную) методику. Ее суть заключается в регистрации сил межатомного взаимодействия между исследуемой поверхностью и колеблющимся на резонансной частоте зондовым датчиком, представляющим собой механическую иглу, закрепленную на конце кантилевера.
При подводе зонда к исследуемой поверхности действие сил межатомного взаимодействия приводит к изменению условий резонансных колебаний кантилевера, а также к изменению амплитуды и фазы колебаний. Система обратной связи позволяет поддерживать постоянным среднее расстояние между образцом и зондом, чтобы не изменялась амплитуда колебаний. В полуконтактном режиме зонд входит в физический контакт с поверхностью только в нижней части своей траектории, постукивая поверхность. В процессе сканирования образца электронная подсистема СЗМ регистрирует вертикальные перемещения кантилевера и реконструирует рельеф поверхности. Одновременно с изображением рельефа поверхности могут быть получены изображение отклонения амплитуды колебаний кантилевера от заданной рабочей величины и изображение сдвига фазы колебаний. Эти изображения позволяют более отчетливо выявлять особенности рельефа поверхности, а также неоднородности ее физико-химических свойств.
Вследствие очень сильной зависимости сил межатомного взаимодействия от расстояния между зондом и поверхностью полуконтактная атомно-силовая спектроскопия оказывается весьма чувствительной методикой и позволяет измерять рельеф поверхности с субнанометровым вертикальным разрешением. Горизонтальное разрешение методики существенно уступает вертикальному и определяется радиусом закругления острия зонда, который составляет порядка 10 нм.
К преимуществам метода относят высокое пространственное разрешение, получение информации о размерах элементов поверхности образца как по горизонтали, так и по вертикали.
При обработке данных использованы методы непараметрической статистики. Данные представлены в виде M±m, где M – среднее значение, m – стандартная ошибка среднего.
Результаты
Исследование методом РЭМ
При изучении поверхности стентов образцов № 1Н и № 2Н методом РЭМ выявлены особенности строения рельефа (рис. 1).
При одинаковом увеличении отчетливо видно, что неровности поверхности образца № 1Н формируют упорядоченные ряды (см. рис. 1, а). У образца № 2Н дефекты рельефа расположены хаотично, по высоте визуально они больше, чем у образца № 1Н (см. рис. 1, б).
На поверхности образца № 1БУ произошло отложение кристаллов солей, однако их структура рыхлая, не образующая цельного пласта (рис. 2, а). На образце № 2БУ отложение солевых осадков произошло интенсивнее, приведя к образованию плотной монолитной структуры с биопленкой, покрывающей поверхность однородным слоем (рис. 2, б).

Исследование методом СЗМ
На поверхности образца № 1Н обнаружено множество неровностей в форме пирамид высотой 0,15±0,02 мкм, имеющих тенденцию к повторению через равные промежутки, с плотностью расположения 2,67 на 10 мкм² (рис. 3, а).
Отложение солей на поверхности образца № 1БУ происходило в соответствии с той же закономерностью, с которой располагались дефекты строения образца № 1Н. Выявленные ранее пирамиды увеличились по высоте до 0,29±0,03 мкм (рис. 3, б), прирост пирамид по высоте составил 194% (p<0,001).
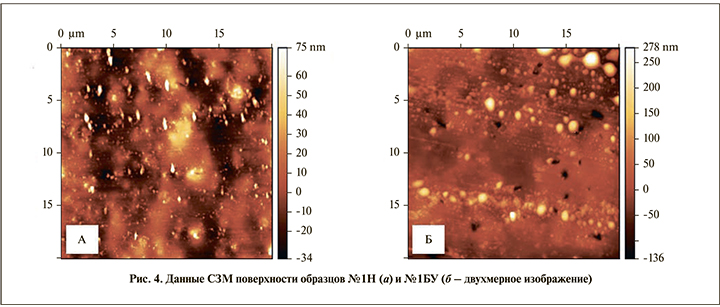
На двухмерном изображении вершины пирамид на поверхности стента образца № 1Н имели неправильную форму, их ширина составила в среднем 0,36±0,04, длина – 0,71±0,07 мкм (рис. 4, а). У образца № 1БУ отмечено увеличение ширины до 0,66±0,08 мкм (прирост до 183,3%, р<0,001), в то время как длина изменилась на незначительную, но статистически значимую величину – до 0,79±0,08 мкм (р<0,004; рис. 4, б). Таким образом, констатировано значительное увеличение размеров пирамид преимущественно за счет ширины вследствие отложений.
Поверхность образца № 2Н оказалась более шероховатой, чем у образца № 1Н, пирамиды имели большую высоту – 0,39±0,03 против 0,15±0,02 мкм (р<0,0001) без явно выраженной закономерности повторения с большей плотностью расположения – 3,31 на 10 мкм² (рис. 3, а; 5, а).
Отложение солей на поверхности образца № 2БУ произошло интенсивнее (рис. 5, б). Высота пирамид после использования достигла 0,51±0,04 мкм (р<0,0001). Прирост по высоте составил 129,5%, что несколько меньше, чем на образце № 1БУ. Однако в данном случае дефекты исходно были выше и визуально приобрели вид сливающихся больших конгломератов.
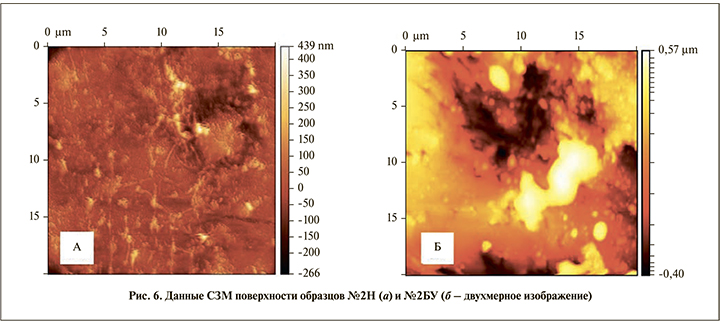
На двухмерном изображении видно, что пирамиды на поверхности образца № 2Н соединены перемычками, формируя отчетливо выраженную сетчатую структуру. Средние размеры пирамид составили: ширина – 0,97±0,08 мкм, длина – 0,94±0,08 мкм (рис. 6, а), что больше, чем у образца № 1Н (р<0,0001). На образце № 2БУ отмечено образование единого полигонального конгломерата площадью 27,7 мкм² (рис. 6, б).
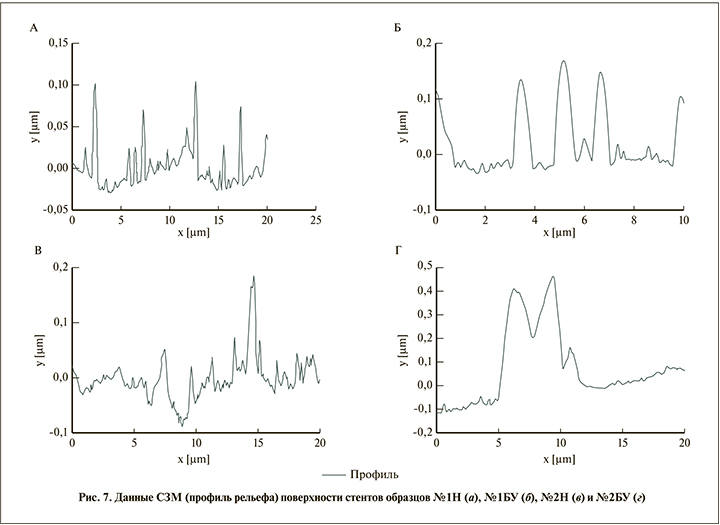
Особый интерес представляет профилометрия рельефа поверхности стентов (рис. 7). У образца № 1Н площадь поперечного сечения неровностей в направлении перемещения зонда составила 1,015 мкм² (рис. 7, а), у образца № 1БУ – 1,271 мкм² (рис. 7, б), прирост площади – 25,2%.
У образца № 2Н та же величина составила 1,158 мкм², т.е. его поверхность более шероховатая, чем у образца № 1Н (рис. 7, в), у образца № 2БУ – 2,29 мкм² (рис. 7, г), прирост площади составил 97,8%, что значительно превышает показатели образца № 1БУ.
Обсуждение. К сожалению, в доступной литературе и при поиске в открытых базах данных мы не сталкивались с работами, изучающими взаимосвязь рельефа поверхности стента с процессами инкрустации и образования биопленок. В нашем исследовании изучены поверхности полиуретановых мочеточниковых стентов двух производителей. Изделия были использованы в одинаковых клинических ситуациях: у пациентов, оперированных по поводу гидронефроза в отсутствие клинико-лабораторных признаков инфекции мочевыводящих путей и мочекаменной болезни при одинаковой продолжительности нахождения в мочеточнике 21 сут. Как показали исследования, неиспользованные стенты имели характерные специфические различия. Так, образец № 1 имел небольшие дефекты рельефа в виде пирамид, расположенных рядами. Напротив, на поверхности образца № 2 выявлены практически в 2 раза более крупные элементы, расположенные хаотично, соединенные перемычками, формирующие сетевидную структуру. Такая более шероховатая поверхность образцов № 2 безусловно не могла не привести к нарушению ламинарного характера течения мочи по поверхности стента. Выступающие дефекты рельефа стали центром отложения солей, тем большими, чем большими были их размеры. Высота пирамид образцов № 1 и 2 составила 0,15 и 0,29 мкм соответственно (р<0,0001). Логично предположить, что следствием этого и стал гораздо больший, в 4,4 раза, объем наложений на поверхности. Дельта изменения площади поперечного сечения неровностей составила для образцов № 1 и 2 0,256 и 1,132 мкм² соответственно. На образце № 1БУ пирамиды хоть и увеличились в размерах (более за счет ширины и высоты) практически в 2 раза, все же поддавались подсчету. На поверхности же образца № 2БУ сформировались значительных размеров полигональные конгломераты солей, размеры которых в десятки раз превышали таковые первичных элементов.
Такое различие в объеме наложения солей нашло свое отражение и в характере формирования биопленок. Последние на образце № 2БУ имели вид четко оформленных массивных пластов, в то время как на образце № 1БУ – разрозненных «рыхлых» образований.
Заключение. Характер поверхности мочеточникового стента оказывает прямое самостоятельное влияние на степень инкрустации и образование биопленок.



