Эректильная дисфункция (ЭД) – важная проблема мужского здоровья, обусловливающая значительное снижение качества жизни и расстройство отношений с партнершей [1]. Определено, что 20% мужчин старше 40 лет страдают ЭД, при этом с возрастом распространенность данной патологии увеличивается. Так, мужчины в возрасте 61–70 лет в 2 раза чаще страдают ЭД по сравнению с мужчинами в возрасте 51–60 лет [2]. В РФ, по данным эпидемиологического исследования, проведенного профессором Д. Ю. Пушкарем путем анкетирования 1225 мужчин, признаки ЭД отсутствовали только у 10,1% опрошенных, симптомы ЭД присутствовали у 1101 респондента [3].
В лечении ЭД используют три линии терапии: ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5), вакуумную терапию, интракавернозные инъекции ПГE1 и протезирование полового члена [4]. Среди данных методов лечения самым распространенным и успешно применяемым остается прием ингибиторов ФДЭ-5. Это объясняется удобным способом введения (пероральный путь) и высокой эффективностью. Однако существуют ограничения для данного метода. Во-первых, ингибиторы ФДЭ-5 нельзя назначать пациентам, принимающим нитраты. Во-вторых, некоторые пациенты отказываются принимать ингибиторы в связи с непереносимостью побочных эффектов, связанных с их приемом. И в-третьих, есть категория мужчин, на которых данные препараты не действуют [5]. Кроме того, терапия ингибиторами ФДЭ-5 симптоматическая и не предполагает устранения причины. В связи с вышеизложенным представляется оправданным рост интереса к разработке патогенетических способов лечения ЭД. Одним из таких многообещающих и перспективных способов лечения является клеточная терапия стволовыми клетками (СК).
Стволовые клетки
Стволовые клетки – это недифференцированные клетки, способные к делению, самоподдержанию и продукции большого числа дифференцированных и функциональных клеток для обновления и восстановления тканей [6].
Дифференцировка (специализация) клетки начинается с первой стадии эмбрионального развития. В течение первых делений зиготы (2–3 деления у млекопитающих) ее клетки-потомки (бластомеры) одинаковы по своим свойствам. Однако в ходе последующих делений зиготы клетки начинают отличаться друг от друга. Под действием комбинации внешних и внутренних сигналов в клетке происходят изменения, которые приводят к формированию групп, различающихся по возможностям дифференцировки. Так, клетка, становящаяся плацентой, уже не способна участвовать в формировании тканей эмбриона, и, наоборот, ткани эмбриона не образуют плаценту. В течение эмбрионального развития дифференцировка функциональной специализации происходит многократно. Процесс дифференцировки необратим и знаменуется прекращением клеточных делений. Например, образование скелетных мышц сопровождается слиянием отдельных клеток – миобластов в миофибриллы и формированием единого сократительного аппарата. При этом деление миобластов прекращается. Такой процесс называется терминальной дифференцировкой. Он необходим для приобретения клеткой специфических функций и характерен для специализированных тканей (кость, хрящ, кожа, периферическая кровь, мышечная и нервная ткань и др.).
Типы стволовых клеток
В зависимости от возможностей дифференцировки СК разделяют на тотипотентные, плюрипотентные, мультипотентные и унипотентные [7]. Зигота дает начало всему организму, отчего получила название тотипотентной (от лат. totus – весь, целый и potentia – сила, возможность) [8].
В процессе дальнейшего формирования организма происходит сужение выбора возможных направлений специализации СК. Бластоциста представляет собой полый шар, состоящий из 150–200 клеток. Внутри бластоцисты находится небольшая группа клеток – клетки внутренней массы, из которых впоследствии формируются все ткани и органы. Эти клетки называются плюрипотентными (от лат. pluralis – множественный), или эмбриональными, СК [9]. В развивающемся эмбрионе на клетки внутренней массы действует множество факторов, стимулирующих их специализацию в том или ином направлении, поэтому их плюрипотентность быстро утрачивается. Считается, что плюрипотентные СК сохраняются в эмбрионе только на стадии гаструлы (следующей стадии развития после бластоцисты). В уже сформированном организме спектр возможностей дифференцировки СК ограничен, как правило, типами клеток, присущими данной ткани. Данное направление специализации тканеспецифичных СК уже предопределено, поэтому их называют мультипотентными [8].
Мультипотентные СК обнаружены в тканях, нуждающихся в постоянном восполнении клеточного состава (кровь, кожа, выстилка кишечника и др.). В тканях они располагаются в так называемых нишах – специальном микроокружении, которое состоит из клеток и внеклеточного матрикса [10]. Как правило, ниши со СК анатомически локализуются в глубоких участках ткани. Например, в эпителии кишечника они находятся в глубине крипт. При этом СК находятся в тесной связи с клетками ниши и внеклеточным матриксом. В отсутствие сигнала активации клетки, формирующие нишу, оказывают паракринные эффекты, поддерживая СК в состоянии покоя. Компоненты внеклеточного матрикса образуют трехмерную структуру, создающую градиент факторов, регулирующих запуск миграции, пролиферации и дифференцировки. Стволовые клетки имеют систему рецепторов, которые в норме удерживают их в состоянии покоя, а под действием внешнего сигнала способны быстро активизировать их миграцию в зону повреждения и последующее деление [11].
Процесс активации представляет собой цепь последовательных событий, в которых участвуют факторы роста, клетки ниши и компоненты внеклеточного матрикса. Деление СК в нише находится под контролем факторов роста и цитокинов. В результате асимметрического деления дифференцирующейся клетки образуется две клетки. Одна из них – стволовая, которая остается связанной со своим микроокружением в нише, а в другой запускается программа дифференцировки в функциональную специализированную клетку. Это еще одно главное свойство СК – способность к самообновлению.
Таким образом, у взрослого организма возможен забор и получение мультипотентных СК для трансплантации в другой участок организма с целью регенерации. Одним из доступных типов источников для получения мультипотентных СК являются мезенхимальные СК [12]. Мезенхимальные СК – ключевой участник ответа на повреждение. Это особый тип СК, которые были обнаружены во многих тканях. Они располагаются в стенке кровеносных сосудов и являются источником факторов роста, стимулирующих обновление ткани [13]. Комбинация провоспалительных факторов и цитокинов, появляющихся на первых этапах заживления, активирует миграцию мезенхимальных СК в зону повреждения. Здесь они экспрессируют факторы, обусловливающие тропизм и дифференцировку мультипотентных СК.
В свою очередь мезенхимальные СК формируют внеклеточный матрикс, образуют контакты с дифференцированными клетками, реализуют трофическую и антиапоптотическую функцию, а также стимулируют образование новых сосудов и нервов. Именно эти эффекты используются при разработке технологий клеточной терапии.
Клеточная терапия ЭД
Клеточная терапия предполагает трансплантацию живых клеток в организм человека с целью регенерации. В отличие от трансплантации органов при клеточной терапии переносят отдельные клетки, которые в некоторых случаях для повышения жизнеспособности помещают на подложку, гранулы или в гель из биологически совместимых полимеров [14]. Одновременно с трансплантацией клеток при клеточной терапии в поврежденную ткань попадает комплекс факторов, которые синтезируют СК. При этом продуцируемые в зоне повреждения факторы роста стимулируют собственные репаративные процессы и формируется сложная система взаимодействия между клетками донора и реципиента.
В настоящее время изучаются возможности применения как мультипотентных, так и эмбриональных СК в качестве источника различных типов клеток.
Самыми перспективными и широко используемыми являются СК из жировой ткани. Это связано с доступностью и простотой забора жировой ткани. Выделяют два типа популяции СК, происходящих из жировой ткани: стромально-васкулярную фракцию (СВФ), получаемую после центрифугирования гомогенизированной фракции жировой ткани, и СК, получаемые из СВФ при культивировании и размножении на питательных средах [15]. Установлено, что 1 г жировой ткани содержит около 250 тыс. клеток СВФ и только около 2% составляют СК [16]. Для получения СВФ разработаны автоматизированные технологии, позволяющие без культивирования клеток применять СВФ в клинической практике, что делает данный способ безопасным и доступным.
В исследованиях in vitro и in vivo было доказано, что применение СВФ способствует улучшению ангиогенеза. Данный эффект был обусловлен механизмом дифференцировки в эндотелиальные клетки и паракринным действием факторов роста [17, 18]. Результаты этих работ послужили поводом для изучения эффективности и безопасности СВФ в лечении ЭД.
Первый опыт лечения ЭД был представлен в 2004 г. С тех пор до 2015 г. было проведено 40 доклинических исследований, 1 клиническое исследование и зарегистрировано 6 клинических исследований в национальной базе здравоохранения США (clinicaltrial.gov; см. таблицу). В период с 2004 по 2011 г. было опубликовано 15 статей, в то время как в последующие 4 года выполнено 25 доклинических и 6 клинических исследований. В данных работах были смоделированы все причины ЭД – сахарный диабет, повреждение кавернозного нерва, гиперлипидемия, болезнь Пейрони. Использовали несколько типов СК: культивированные СК из костного мозга, жировой ткани, скелетно-мышечные клетки, пуповины, эндотелиальные прогениторные клетки и СВФ, полученную из жировой ткани (см. таблицу). При этом наиболее удобными и эффективными оказались СК из жировой ткани ввиду доступности и простоты забора жировой ткани [19].
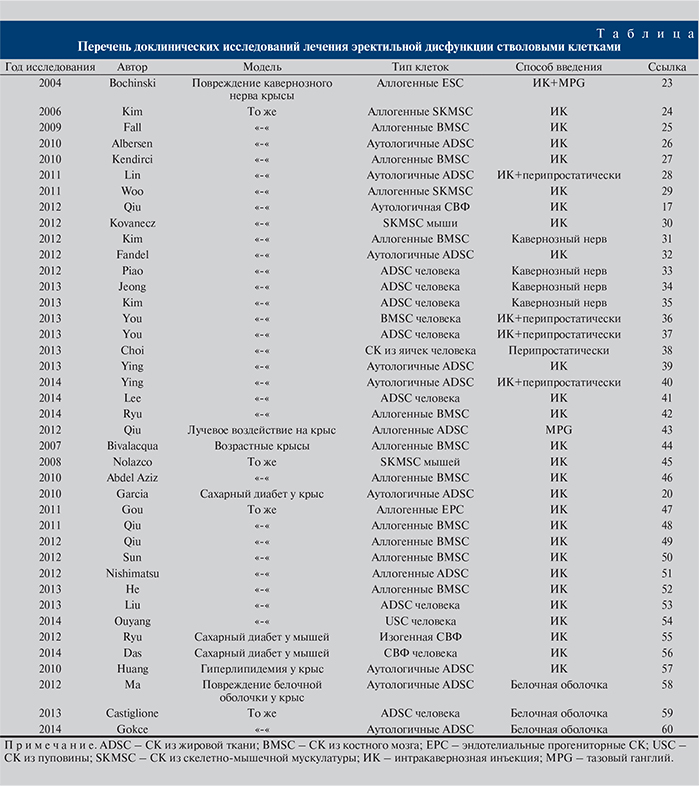
M. Garcia и соавт. изучали способность СК из жировой ткани восстанавливать эректильную функцию при нарушениях, вызванных сахарным диабетом [20]. Моделями служили 22 крысы (ZDF), которых разделили на две группы: контрольную и экспериментальную, в которой крысам интракавернозно вводили 1 млн СК. Эффективность оценивали по результатам электростимуляции кавернозного нерва и данным иммуногистохимического исследования срезов кавернозных тел через 3 нед. после инъекции. Для подтверждения присутствия вводимых СК их помечали 5-бром-2-дезоксиуридином. Спустя 3 нед. в экспериментальной группе было отмечено значительное увеличение интракавернозного давления в ответ на электростимуляцию кавернозного нерва, по данным иммуногистохимического исследования срезов кавернозных тел возросло количество нейрональной синтазы оксида азота (nNOS) в дорсальном нерве и эндотелиальных клеток в кавернозных телах.
После подтверждения эффективности культивируемых СК из жировой ткани X. Qiu и соавт. решили оценить способность некультивируемых СК влиять на эректильную функцию, а также сравнивать результаты немедленного и отсроченного введения [17]. Для работы было отобрано 89 крыс (Sprague Dawley), которых разделили на 4 группы. Моделью ЭД стало повреждение кавернозного нерва – аналог радикальной простатэктомии у мужчин. В 1-й группе (n=23) сразу после повреждения кавернозного нерва интракавернозно вводили физиологический раствор, во 2-й (n=17) группе СВФ вводили немедленно после повреждения кавернозного нерва, в 3-й (n=23) – через 4 нед. после повреждения, а 4-я группа (n=26) была контрольной. Оценка эффективности проводилась на основании результатов электрической стимуляции кавернозного нерва и изучения иммуногистохимических срезов кавернозных тел. В группах с немедленным и отсроченным введением СВФ (2-я и 3-я) констатировали существенное улучшение показателей эректильной функции. Подтверждением являлось повышение интракавернозного давления в ответ на электрическую стимуляцию кавернозного нерва, увеличение экспрессии nNOS, количества нейрофиламентов в дорсальном половом нерве и восстановление соотношения гладкой мускулатуры и коллагена. Таким образом, улучшение эректильной функции было обусловлено стимуляцией нервной регенерации и предотвращением фиброза кавернозных тел.
В 2015 г. D. You и соавт. [21] опубликовали работу, в которой сравнили эффективность культивируемых СК и СВФ в лечении ЭД после повреждения кавернозного нерва. Сорок крыс были разделены на 4 группы. Первая группа служила контролем, второй группе интракавернозно вводили 0,9%-ный физиологический раствор, третьей – СВФ, четвертой – культивируемые СК. Эффективность оценивали через 4 нед. так же, как и в работе [17]. Результаты показали, что СВФ и культивируемые клетки равно эффективны в восстановлении эректильной функции. На поперечных срезах кавернозных тел определялось восстановление соотношения гладкой мускулатуры и коллагена, увеличение количества нейрональных синтетаз оксида азота позитивных нейрофиламентов и экспрессии фактора фон Виллебранда.
К настоящему вермени опубликована только 1 клиническая работа, в которой для лечения ЭД использовали СК. J. Bahk и соавт. [22] интракавернозно вводили СК, полученные из пуповинной крови, пациентам с ЭД, основной причиной которой стал сахарный диабет 2 типа. В исследовании участвовали 7 мужчин, средний возраст которых составил 69,5 (57–87) года. Ни один из пациентов не ответил ни на один из видов фармакотерапии. Результатом лечения стало появление утренних эрекций у 3 пациентов в течение 1 мес. и еще у 3 пациентов к концу 3-го месяца. Утренние эрекции сохранялись на протяжении более 6 мес. При монотерапии СК не удалось достичь достаточной для пенетрации ригидности полового члена, однако прием ингибитора ФДЭ-5 позволил достичь пенетрации 2 пациентам и поддерживать такое состояние на протяжении более 6 мес. Все мужчины, за исключением 1 пациента, отметили увеличение полового влечения в течение 11-месячного наблюдения. Двум пациентам выполнено протезирование полового члена, 4 пациента вернулись к исходному состоянию, у 1 пациента наблюдалась достаточно адекватная эректильная функция.
В мире продолжается поиск новых подходов с применением клеточной терапии. Так, во Франции проводится исследование, в котором интракавернозно вводят мезенхимальные СК, полученные из костного мозга, пациентам с ЭД после простатэктомии (Identifier: NCT01089387, clinicaltrials.gov); в США для лечения пациентов с ЭД васкулогенной и нейрогенной природой используют СВФ из жировой ткани (Identifier: NCT01601353, clinicaltrials.gov).
В России также начато клиническое исследование (Identifier: NCT02472431, clinicaltrials.gov) в НИИ уронефрологии и репродуктивного здоровья человека Первого МГМУ им. И. М. Сеченова по оценке эффективности и безопасности интракавернозного введения аутологичных регенеративных клеток жировой ткани для лечения ЭД органического генеза.
Таким образом, результаты как доклинических (преимущественно), так и клинических исследований по применению СК из жировой ткани дают основание надеяться, что изучаемый метод может стать эффективным способом лечения ЭД.
Разработка и внедрение новых методов лечения ЭД с применением СК из жировой ткани и СВФ являются перспективными направлениями регенеративной медицины.



