Введение. Малотравматичный и высокоэффективный эндоскопический метод коррекции пузырно-мочеточникового рефлюкса (ПМР), предложенный в 1981 г. Е. Matoushek [1], широко используется в детской практике. По общему мнению, возможность рецидива не ставит под сомнение целесообразность использования эндоскопической пластики в качестве первичного вмешательства
при рефлюксах всех степеней. Однако стойкие обструктивные осложнения, впервые описанные
P. Puri [2], встреченные нами [3] и часто упоминающиеся в литературе, заставляют усомниться
в абсолютной безопасности этого метода при его использовании во всех случаях ПМР. По разным
данным, стойкая обструкция терминального отдела мочеточника после ликвидации ПМР возникает
в 0,5–6,6% случаев и встречается при использовании различных имплантируемых материалов
[4–11]. Лишь в единичных работах предпринимаются попытки объяснить ухудшение уродинамики дисплазией мочеточника или введением избыточного количества объемообразующего средства.
В остальных публикациях авторы ограничиваются констатацией факта без объяснения патогенеза
обструктивных осложнений.
Недостаток информации о причинах и механизмах прогрессирующего нарушения уродинамики
верхних мочевыводящих путей после эндоскопического устранения ПМР привел к необходимости
собственного исследования.
Целью исследования стало определение контингента пациентов, которым эндоскопическое лечение ПМР абсолютно противопоказано в связи с высоким риском формирования стойкого обструктивного гидроуретеронефроза (ГУН).
Материалы и методы. С июня 1991 по декабрь 2011 г. в отделении урологии ФГБУ РДКБ эндоскопическое лечение ПМР всех степеней проведено более чем 4000 детей в возрасте от 4 мес до
17 лет. В качестве объемообразующего средства использовали тефлоновую пасту, ДАМ+, уродекс
и вантрис.
Проанализированы истории болезни 134 больных (32 мальчика и 102 девочки в возрасте от 6
мес до 15 лет) с известными исходами лечения в период “сплошного” использования эндоскопического метода, когда в качестве объемообразующего средства использовалась тефлоновая паста. С учетом наблюдений двусторонних патологических изменений и удвоения мочеточников в выборку вошло 200 ПМР, из них 7 – I степени, 35 – II, 100 – III, 58 – IV и V степеней.
Для оценки ближайших результатов лечения 56 больным с 77 рефлюксами всех форм и степеней
в раннем послеоперационном периоде выполнены цистография и ультразвуковое исследование (УЗИ). Отдаленные результаты оценивали через 6 мес после эндоскопической пластики на основании данных цистографии, УЗИ и экскреторной урографии.
Результаты и обсуждение. В ближайшем послеоперационном периоде отсутствие ПМР зарегистрировано в 71 из 77 случаев. Из них в 9 (12,7%) отмечена обструкция мочеточника.
Через 6 мес после вмешательства отсутствие ПРМ констатировано в 192 случаях. При этом значимое
нарушение эвакуаторной функции мочеточника вследствие обструкции уретеровезикального сегмента (УВС) зафиксировано в 5 (2,6%) наблюдениях: в 4 (2,1%) – I степени (ахалазия), в 1 (0,5%) – III степени (ГУН).
С учетом значительно большего количество обструктивных состояний, зафиксированных в ближайшем послеоперационном периоде, можно сделать вывод: большинство из них носит транзиторный характер, купируется после исчезновения отека периуретеральных тканей и рассасывания жидкой части имплантата. Ни у одного из пятерых детей с обструктивными осложнениями не было хронического цистита, нейрогенной дисфункции мочевого пузыря или инфравезикальной обструкции, поэтому при ретроспективной оценке исходного состояния мочевыводящих путей основное внимание мы сосредоточили на степени ПМР, эвакуаторной функции мочеточника и эндоскопических характеристиках УВС. Обструктивных осложнений при ПМР I–III степеней не отмечено, в связи с чем при статистическом анализе материала исследовали динамику эвакуаторной функции мочеточника при 56 рефлюксах IV и V степеней.
Исходное компенсированное нарушение эвакуаторной функции мочеточника I степени (ахалазия)
выявлено лишь у 1 ребенка с ПМР IV степени. И именно у этого больного после купирования
ПМР возникло стойкое декомпенсированное нарушение уродинамики (1,8%). Если же нарушения
уродинамики до эндопластики отмечено не было, то после вмешательства эвакуаторная функция
мочеточника оставалась нормальной (51 [91,1%] мочеточник) или регистрировалась компенсированная ретенция (4 [7,1%] мочеточника).
Для иллюстрации приводим два клинических наблюдения. Примером компенсированного
нарушения эвакуаторной функции мочеточника после устранения ПМР служит история болезни
Артема Ш.
Б о л ь н о й Ш. 4 лет поступил в наше отделение 27.09.92. Из анамнеза: с годовалого возраста наблюдался нефрологом по поводу хронического пиелонефрита. В 3-летнем возрасте по месту жительства выполнены цистография и экскреторная урография. Диагностирован двусторонний
ПМР (слева V, справа IV степени) (рис. 1, а). При экскреторной урографии существенного нарушения эвакуаторной функции мочеточников не отмечено (рис. 1, б). Направлен в РДКБ для лечения. При цистоскопии выявлены незначительная латерализация и зияние устьев мочеточников.
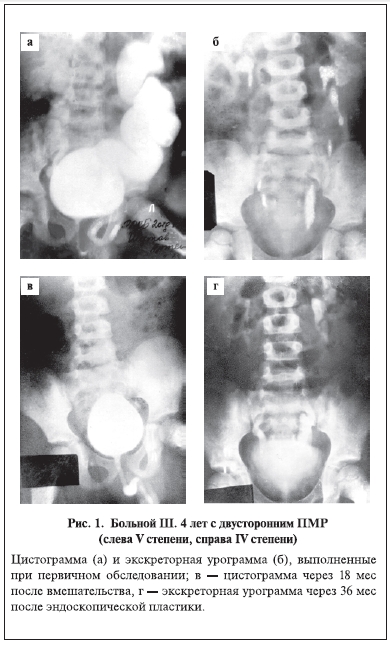
Протяженность подслизистых отделов превышала 0,5 см. 04.10.92 произведена эндоскопическая подслизистая имплантация тефлоновой пасты (ЭПИТ) под устья мочеточников. В ближайшем послеоперационном периоде зафиксирована умеренная уретеропиелоэктазия, которая купировалась самопроизвольно через 2 нед после вмешательства. Через 6 и 18 мес ПМР не обнаружены (рис.
1, в). По данным экскреторной урографии, проведенной через 18 и 36 мес после ЭПИТ, отмечено нарушение эвакуаторной функции левого мочеточника I степени (рис. 1, г).
В качестве примера возникновения обструктивного ГУН после эндоскопического устранения
ПМР IV степени приводим следующее клиническое наблюдение.
Больной М. 2 лет впервые госпитализирован в отделение урологии РДКБ 21.03.95. Из анамнеза: впервые лейкоцитурия выявлена в 6-месячном возрасте. По месту жительства выполнены цистография и экскреторная урография, после чего больной направлен в наше отделение. На представленных цистограммах отмечен ПМР IV степени слева (рис. 2, а), на урограммах — нарушение эвакуаторной функции левого мочеточника I степени (рис. 2, б).
Рисунок 2. Больной М. 2 лет с ПМР IV степени слева.
При цистоскопии выявлена умеренная латерализация устья левого мочеточника. 01.04.95 выполнена ЭПИТ под устье левого мочеточника. Через 3 мес после вмешательства на фоне уроантисептической терапии зарегистрировано обострение пиелонефрита. При контрольном обследовании в октябре 1995 г. диагностирован обструктивный ГУН слева (рис. 2, в), в связи с чем 20.10.95 произведена уретероцистонеоимплантация по Коэну слева.
Для подтверждения закономерностей, выявленных при статистическом исследовании, проведен
клинико-морфологический анализ всех случаев обструктивного ГУН, возникших у наших пациентов после эндоскопического устранения ПМР (5 мочеточников у 5 больных).
В каждом наблюдении проанализированы состояние мочевыводящих путей до и после эндопластики устья мочеточника, особенности эндоскопической процедуры и гистоструктура терминального
отдела мочеточника, резецированного в ходе итогового оперативного вмешательства.
Все больные страдали односторонними рефлюксами IV степени. Примечательно, что при экскреторной урографии, проведенной до эндоскопической пластики, у всех 5 детей отмечено нарушение
эвакуаторной функции мочеточника I (4) и II (1) степеней. Одному мальчику диагностировали
гипорефлекторную дисфункцию мочевого пузыря. Инфравезикальной обструкции не было ни у одного больного.
В четырех наблюдениях уретерогидронефроз возник после первичного вмешательства, в одном –
после повторного. При цистоскопии признаков цистита не выявлено ни у одного больного. У всех
отмечались признаки дисплазии подслизистых отделов мочеточников: истончение стенок, гипотония, отсутствие перистальтики, зияние устьев различной выраженности, но без существенного
расширения. У ребенка, ранее перенесшего эндопластику, устье располагалось на латеральном
основании имплантата и смыкание стенок подслизистого отдела мочеточника было неплотным. Во
всех случаях длина внутрипузырного отдела мочеточника превышала 0,5 см.
Особенностей эндоскопического вмешательства не отмечено. По данным УЗИ, проведенного в ближайшие дни после эндоскопической пластики, уретеропиелоэктазия зафиксирована у всех пациентов.
При обследовании через 6 мес ПМР не выявлены. На основании данных УЗИ и экскреторной
урографии во всех пяти наблюдениях диагностирован ГУН. При цистоскопии внешний вид УВС не
имел отличительных особенностей по сравнению с неосложненными наблюдениями: терминальные
отделы мочеточников располагались на вершинах хорошо выраженных подслизистых имплантатов,
были плотно сомкнуты в поперечном направлении на всем протяжении и свободно пропускали моче-
точниковый катетер 5 Ch.
Один больной, который перенес обострение пиелонефрита через 3 мес после выписки, был оперирован сразу по выявлении осложнения (через 6 мес после эндоскопической пластики). Остальные
оперированы в сроки от 12 до 48 мес после безуспешного консервативного лечения, включившего
противовоспалительную, мембраностабилизирующую терапию и накожную электростимуляцию на
область проекции мочеточников. На фоне консервативной терапии двое из них перенесли обострения пиелонефрита через 12 и 24 мес после эндоскопического устранения рефлюкса.
В четырех наблюдениях выполнена операция Коэна. В ходе вмешательства единым блоком выделялись интрамуральные и юкставезикальные отделы мочеточников вместе с инкапсулированными имплантатами для последующего гистологического исследования. Отмечено интимное сращение плотной капсулы импланта с окружающими тканями, что несколько затрудняло выделение мочеточника. Для больной, перенесшей двукратную эндоскопическую пластику, распространенность склеротического процесса была значительной, что заставило провести уретероцистонеоимплантацию по Политано–Ледбеттеру, оставив имплантат в толще мягких тканей мочевого пузыря во избежание излишней травматизации.
Во всех случаях интрамуральный отдел резецированной части мочеточника был значительно уже
юкставезикального, но свободно проходим для катетера 5 Сh. Имплантат был окружен плотной,
тонкой капсулой, имел плотноэластическую консистенцию и был спаян с нижней стенкой мочеточника.
Перед гистологическим исследованием биоптаты фиксировали в 10%-ном формалине и заливали в парафин по общепринятой методике. Срезы окрашивали гематоксилином и эозином, а также пикрофуксином по Ван Гизону. Исследовали гистологическую структуру имплантатов, юкставезикальных и подслизистых отделов мочеточников, определяли точную локализацию имплантатов по отношению к подслизистому отделу мочеточника.

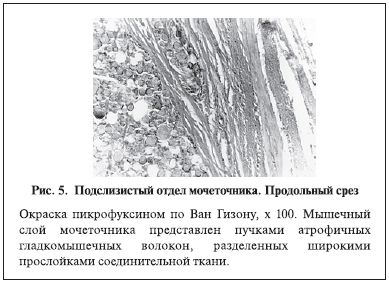
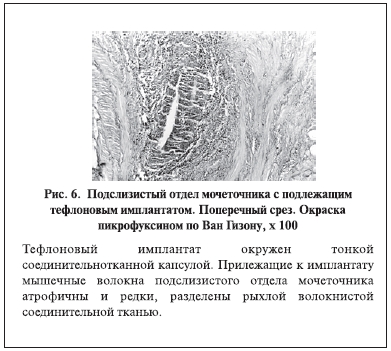
При изучении гистологической структуры юкставезикальных отделов мочеточников у всех больных выявлены сходные морфологические признаки фиброзномышечной дисплазии (рис. 3). В подслизистых отделах также во всех наблюдениях обнаружены тяжелые врожденные диспластические изменения (рис. 4). Имплантаты имели одинаковую гистологическую структуру, представив собой инкапсулированную гранулему вокруг частиц тефлона (рис. 5). У всех пациентов гистологически подтверждено правильное положение имплантов – они находились под нижней стенкой подслизистого отдела мочеточника (рис. 6), что исключало дефект техники вмешательства.

Заключение. Проведенное исследование показало, что обструктивные осложнения, выявленные
в раннем послеоперационном периоде, в большинстве случаев носят транзиторный характер и
купируются самопроизвольно после исчезновения травматического отека и рассасывания жидкой
части имплантата. Стойкое декомпенсированное нарушение уродинамики верхних мочевыводящих
путей возникает после эндоскопического устранения ПМР больших степеней при исходной субкомпенсированной обструкции интрамурального отдела мочеточника. В этих случаях сократительная активность дисплазированного мочеточника нарушена настолько, что даже минимальное повышение профиля давления на уровне УВС, что всегда происходит при эндоскопическом устранении ПМР, приводит к необратимой декомпенсации уродинамики. Другие причины обструктивных осложнений были исключены по результатам клинико-морфологического исследования. Следовательно, детям с рефлюксами больших степеней при рентгенологических признаках обструкции терминального отдела мочеточника эндоскопическое лечение абсолютно противопоказано.



