Введение. Онкологические результаты органосохраняющего лечения при раке почки не уступают таковым после выполнения радикальной нефрэктомии. В то же время резекция почки сопровождается существенно лучшими функциональными результатами [1, 2]. В течение последних лет лапароскопические резекции почки приобретают все большую популярность за счет значительного превосходства над открытыми операциями с точки зрения периода и полноты восстановления физической активности пациентов, послеоперационных болей и косметического эффекта [1–5]. Пережатие почечных сосудов во многих случаях оказывается необходимым для уменьшения кровопотери, достижения надежного гемостаза и восстановления коллекторной системы. Однако это сопровождается тепловой ишемией, неизбежно приводящей к более или менее выраженному повреждению функции почки [6]. Традиционно зажим накладывают на почечную артерию или пережимают почечную ножку ad mass. Временное пережатие сосуда клеммой (клеммирование) отдельных ветвей почечной артерии может существенно сократить ишемическое повреждение за счет сохранения кровотока в большей части органа. В то же время прекращение кровотока в пораженном сегменте органа позволяет избегать значительной кровопотери, способствует хорошей визуализации операционного поля, надежному гемостазу и восстановлению целостности чашечно-лоханочной системы при ее вскрытии [7]. В ряде случаев можно выполнить дальнейшую субсегментарную диссекцию почечной артерии до ветвей 2–4-го порядка и таким образом обойтись суперселективной локальной (фокальной) ишемией, тем самым снизив риск повреждения функции органа [8].
 Целью исследования было сравнить функциональные результаты лапароскопических резекций почки, выполненных с пережатием почечной артерии и в условиях локальной ишемии.
Целью исследования было сравнить функциональные результаты лапароскопических резекций почки, выполненных с пережатием почечной артерии и в условиях локальной ишемии.
Материалы и методы. С января 2009 по июнь 2012 г. в клинике выполнено 60 лапароскопических резекций почки, из них 28 – трансперитонеально и 32 – ретроперитонеально. Тридцати четырем пациентам (1-я группа, с января 2009 по декабрь 2010 г.) резекции выполнялись с временным клеммированием почечной артерии и 26 (2-я группа, с января 2011 по июнь 2012 г.) – с временным клеммированием сегментарных ветвей почечной артерии, а также ветвей 2-го и 3-го порядка. У 15 пациентов была нормально функционирующая контралатеральная почка, у 6 пациентов проведена резекция единственной функционирующей почки. У 6 пациентов диагностировано билатеральное опухолевое поражение. У 33 пациентов контралатеральная почка была компрометирована сопутствующим заболеванием (нефролитиаз, стриктура лоханочно-мочеточникового сегмента, гипоплазия, стеноз почечной артерии, наличие кист). Распределение пациентов по полу, возрасту, индексу массы тела, размерам опухоли приведено в табл. 1. Почечную функцию 6 пациентам с единственной почкой оценивали по скорости клубочковой фильтрации (СКФ) до операции и через 3 мес после нее, рассчитанный по формуле Кокрофта–Голта, дифференцированный методом радиоизотопной (ДТПА – 99mTc) сцинтиграфии, выполняемой всем остальным пациентам с двумя почками, до и через 3 мес после операции. Используемый метод позволяет оценивать показатель СКФ – как суммарный, так и раздельно для каждой из почек.
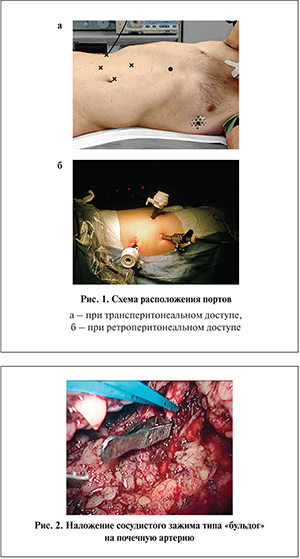
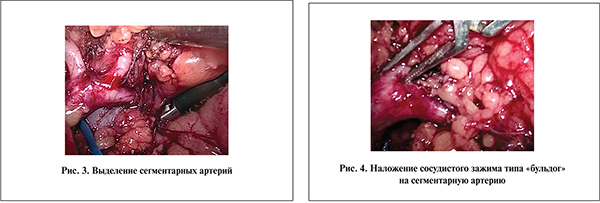
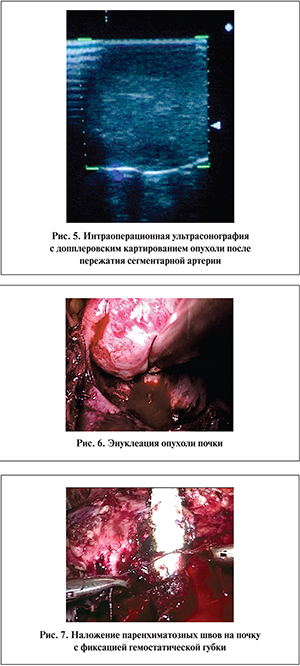
Операцию выполняли под общей анестезией в положении на боку. Как правило, использовали 4 порта (2 по 12 мм, 2 по 5 мм). Схема расположения портов при транси ретроперитонеальных операциях приведены на рис. 1. При ретроперитонеальном доступе изначально выделяли почечную артерию, подводили под нее турникет. При трансперитонеальном доступе вначале мобилизовали почечную вену. У пациентов 1-й группы резекцию почки выполняли в условиях ее общей тепловой ишемии. Тогда непосредственно перед резекцией на почечную артерию накладывали зажим типа «бульдог» (рис. 2). Во 2-й группе резекцию выполняли в условиях локальной ишемии. При этом проводили диссекцию почечной артерии до ее деления на сегментарные ветви (рис. 3). Почку мобилизовали в объеме, достаточном для выполнения резекции. На соответствующую сегментарную ветвь кратковременно накладывали зажим «бульдог» (рис. 4). С помощью лапароскопического датчика выполняли ультрасонографию с допплерокартированием, убедившись, что зона предполагаемой резекции целиком входит в область кровоснабжения пережатой артерии (рис. 5). Если кровоснабжение опухоли не прекращалось, «бульдог» перекладывали на другую ветвь. В случаях, когда зона кровоснабжения пережатой артерии не захватывала всю область планируемой резекции, дополнительный зажим накладывали на соседнюю браншу. Затем «бульдог» снимали и продолжали диссекцию «заинтересованной» артерии до вхождения в паренхиму обычно до деления на ветви 2–4-го порядка. Последовательно накладывая зажим на выделенные ветви и выполняя допплерографию, определяли бранши, ответственные за кровоснабжение опухоли и зоны резекции. Далее на соответствующую артериальную ветвь (ветви) вновь накладывался «бульдог» и выполняли энуклеацию опухоли или резекцию соответствующей зоны паренхимы почки (рис. 6). В некоторых случаях удавалось выделить ветвь, кровоснабжающую непосредственно опухоль. Тогда эту артерию просто клиппировали.
При визуализации в поле резекции относительно крупных пересеченных венозных или артериальных сосудов, а также дефектов чашечно-лоханочной системы их прошивали (PDS или монокрил 4/0). «Бульдог» снимали. Гемостаз мелких сосудов паренхимы достигали в основном биполярной коагуляцией. При образовании глубоких дефектов паренхимы последние заполняли гемостатическим материалом (Surgecell) с наложением паренхиматозных швов (рис. 7). Удаленную опухоль помещали в пластиковый контейнер и извлекали, как правило, через слегка расширенный разрез после удаления одного из 12-миллиметровых портов. Дренаж проводили в месте латерального 5-миллиметрового порта и удаляли обычно на 2–4-й день после операции. Во всех наблюдениях регистрировали период общей или локальной тепловой ишемии, величину кровопотери, интраи послеоперационные осложнения, уровень СКФ оперируемой почки до и через 3 мес после операции. Соответственно, приведенные значения СКФ для пораженной почки – результат, производный от величины клиренса креатинина и изотопа 99mTc (ДТПА).

Результаты и обсуждение. Ни в одном наблюдении не потребовалось выполнения нефрэктомии или перехода к открытой операции. Двум пациентам, которым начинали выполнять резекцию с локальной ишемией, потребовалось временное пережатие почечной артерии для достижения гемостаза во избежание значимой кровопотери. Эти пациенты были исключены из сравнения. Во 2-й группе отмечено увеличение средней продолжительности операции, а также времени тепловой ишемии по сравнению с 1-й. Средняя продолжительность операции во 2-й группе была несколько выше – 186±29 мин против 137±42 – в 1-й группе. Время тепловой ишемии было более продолжительным во второй группе (31±5,9 мин) по сравнению с первой (26±5,2 мин). Однако следует отметить, что в 1-й группе это была тотальная тепловая ишемия, во 2-й – локальная.
У 1 пациента 2-й группы отмечено повреждение почечной вены, которое было устранено лапароскопически. Объем кровопотери составил в среднем 232±157 и 325±185 мл в 1-й и 2-й группе соответственно. Не отмечено существенных различий по количеству выполненных во время операции гемотрансфузий (5 пациентам 1-й группы и 4 – 2-й). Исходно показатели СКФ у пациентов обеих групп достоверно не различались, однако через 3 мес после операции снижение функции ипсилатеральной почки у пациентов 2-й группы было менее выраженным (табл. 2). Не удалось выявить достоверных различий (из-за недостаточного числа наблюдений) в функции почек, резецированных с пережатием сегментарной, а также одной и более субсегментарных артерий.
 Опухоли были классифицированы как Т1а у 47 пациентов (26 в 1-й группе и 21 во 2-й), Т1b у 12 пациентов (7 и 5 соответственно), Т2а у 1 пациента 1-й группы. Края резекции во всех случаях были негативными. Случаев повреждений внутренних органов отмечено не было. Эпизоды макрогематурии, купированные консервативно, имели место у 5 пациентов 1-й группы и 4 – 2-й. Выделение мочи по дренажу наблюдалось у 2 пациентов 1-й группы. Все свищи были устранены с помощью внутреннего стентирования и дренирования уретральным катетером в течение 3–18 дней. Продолжительность госпитализации составила 8,2±3,5 и 9,1±4,1 дня в 1-й и 2-й группах соответственно. В течение последующих 3–36 мес ни в одном наблюдении не было выявлено локальных рецидивов заболевания.
Опухоли были классифицированы как Т1а у 47 пациентов (26 в 1-й группе и 21 во 2-й), Т1b у 12 пациентов (7 и 5 соответственно), Т2а у 1 пациента 1-й группы. Края резекции во всех случаях были негативными. Случаев повреждений внутренних органов отмечено не было. Эпизоды макрогематурии, купированные консервативно, имели место у 5 пациентов 1-й группы и 4 – 2-й. Выделение мочи по дренажу наблюдалось у 2 пациентов 1-й группы. Все свищи были устранены с помощью внутреннего стентирования и дренирования уретральным катетером в течение 3–18 дней. Продолжительность госпитализации составила 8,2±3,5 и 9,1±4,1 дня в 1-й и 2-й группах соответственно. В течение последующих 3–36 мес ни в одном наблюдении не было выявлено локальных рецидивов заболевания.
Постепенное накопление доказательств об увеличении риска развития хронической почечной недостаточности среди пациентов после радикальной нефрэктомии способствовало укреплению положения, будто резекция почки сегодня уже является методом выбора при лечении почечно-клеточного рака в стадии Т1. Однако время тепловой ишемии при эндоскопических операциях все еще остается более продолжительным, чем при открытых, а многие исследования показали, что продолжительность тепловой ишемии прямо влияет на риск снижения функции почки [9–13]. Существует несколько общепринятых методов снижения ишемических и реперфузионных повреждений органа. При открытой резекции почки довольно часто используют локальную гипотермию, но применение этого метода при лапароскопических операциях не получило широкого распространения ввиду технической сложности ее выполнения. Идеальным с точки зрения предотвращения повреждений функции почки является выполнение операции ее резекции без прекращения кровотока, однако таким образом, как правило, можно удалить лишь небольшие опухоли, преимущественно с экзофитным ростом [7]. При резекции почки в условиях сохраненного кровотока не всегда удается хорошо визуализировать край опухоли и, следовательно, выше риск получения положительного хирургического края. Кроме того, возможна существенно большая кровопотеря [14]. Это особенно опасно при центральных и внутриорганных опухолях. Опираясь на опыт снижения кровопотери при выполнении простатэктомий и цистэктомий, C. Ng и соавт. [8] использовали управляемую артериальную гипотонию при резекциях внутриорганных и центрально расположенных опухолей. В то же время системное снижение артериального давления приводит к уменьшению почечного кровотока и ишемии, в том числе контралатеральной почки, и даже может стать причиной острой почечной недостаточности. Хорошей альтернативой традиционным методам противоишемической защиты служит селективное выключение кровотока в опухолевом узле или в содержащем его сегменте почки. Эффективность такого подхода при лапароскопических операциях была продемонстрирована в эксперименте на животных [15]. В течение последнего года появились первые весьма обнадеживающие сообщения об использовании локальной ишемии при лапароскопической резекции почки в клинике [7]. Мы сравнили влияние на выделительную функцию почки тотальной и селективной тепловой ишемии при резекции почки, выполняемой лапароскопическим или ретроперитонеоскопическим доступом. Ключевым моментом нового метода является выделение ветвей почечной артерии и выявление сосуда или сосудов, осуществляющих кровоснабжение зоны опухоли с помощью повторного допплеровского картирования лапароскопическим ультразвуковым датчиком. При окклюзии этой ветви (ветвей) ишемии подвергается лишь ограниченная часть органа, в то время как в большей части сохраняется нормальная перфузия. В некоторых случаях удавалось даже выявить и клиппировать ветвь, кровоснабжающую непосредственно опухоль, тем самым полностью исключив ишемическое повреждение органа. С учетом значительной вариабельности сегментарного кровоснабжения почки и непредсказуемости питания опухоли использование интраоперационного допплерокартирования является необходимым компонентом метода, позволяющим четко определить зоны питания выделяемых ветвей [16]. Пятерым из 26 пациентов нам потребовалось пережать две сегментарные (субсегментарные) артерии в связи с тем, что наложения клеммы на одну ветвь оказалось недостаточно для прекращения кровотока во всей опухоли. Последние наблюдения, тем не менее, свидетельствуют о том, что даже в случаях больших (более 6 см) и центрально расположенных опухолей лапароскопическая резекция может быть проведена с ограниченной (локальной) ишемией. При этом всегда остается возможность пережатия общей почечной артерии. Несмотря на большую продолжительность операции и времени прекращения кровотока, мы отметили достоверно меньшее снижение функции пораженной почки через 3 мес у пациентов после резекций, выполненных с применением фокальной ишемии, по сравнению с пациентами, которым проводились вмешательства с пережатием общей почечной артерии. Эффективность клеммирования отдельных артериальных браншей подтверждается также отсутствием достоверных различий по объему кровопотери между пациентами двух групп. Большая продолжительность операций при использовании локальной ишемии связана с дополнительным временем, необходимым для диссекции артериальных ветвей 2–4-го порядка. В то же время использование ретроперитонеоскопического доступа упрощает выделение почечной артерии и ее ветвей, так как отсутствует необходимость выделения и тракции почечной вены. Однако в случаях больших и расположенных спереди опухолей предпочтительнее лапароскопический, чем ретроперитонеальный, подход, обеспечивающий большее рабочее пространство и оптимальные углы для расположения инструментов. Тем не менее выделение ветвей почечной артерии оказывается, как правило, возможным и при использовании лапароскопического доступа, несмотря на расположенную спереди почечную вену. С целью ее мобилизации мы обычно пересекали надпочечниковую, гонадную и иногда поясничную вены слева, гонадную и поясничную вены справа. Все операции были выполнены лапароскопически или ретроперитонеоскопически без конверсии в открытые вмешательства. Ни в одном наблюдении не отмечено серьезных послеоперационных осложнений, потребовавших повторных операций.

Заключение. Лапароскопическая (ретроперитонеоскопическая) резекция почки с применением локальной ишемии является безопасным методом, позволяющим заметно снизить, а в некоторых случаях полностью исключить ишемическое повреждение функции почки по сравнению с тотальным прекращением артериального кровотока. Использование метода может существенно расширить показания к выполнению лапароскопических и ретроперитонеоскопических органосохраняющих операций при почечно-клеточном раке.



