Введение. В связи с постоянно растущим числом больных, нуждающихся в трансплантации почки, а также увеличением числа выполняемых трансплантаций, проблема улучшения результатов лечения этой категории больных стоит очень остро.
Характер начальной функции почечного трансплантата отражает тяжесть перенесенного ишемического и реперфузионного повреждения. При этом первичная функция трансплантата может служить предиктором длительного нормального функционирования и хорошей долгосрочной выживаемости [1–3].
Для снижения тяжести ишемического и реперфузионного повреждения в настоящее время предложено множество методик: от фармакопротекции донорского органа на этапах кондиционирования донора [4, 5] и консервации [6–8] до различных вариантов аппаратной перфузии во время консервации [9, 10]. При этом плазмаферез, проведенный уже после трансплантации, обладает высоким потенциалом коррекции нарушений гомеостаза, которые возникают в трансплантированной почке в результате ишемии и реперфузии.
За последние годы из всех методов диагностики расстройств функции почечных аллотрансплантатов предпочтение отдается дуплексной сонографии. Ежедневный динамический контроль за внутриорганным кровообращением пересаженной почки является высокоинформативным методом диагностики посттрансплантационных осложнений [11, 12] и прогнозирования функции трансплантата в долгосрочной перспективе [13, 14].
Целью настоящего исследования было изучение внутриорганного кровотока почечного трансплантата и оценка влияния плазмафереза на его начальную функцию в раннем послеоперационном периоде.

Материалы и методы. Обследованы 80 больных, которым выполнена стандартная трансплантация трупной донорской почки. Во всех случаях использовали гипотермическую консервацию трансплантата с применением раствора «Кустодиол» в течение 17,1±5,6 (12–28) ч. Время вторичной тепловой ишемии не превышало 45 мин.
Пациенты были разделены на две сопоставимые группы по 40 человек (табл. 1). В 1-ю группу вошли реципиенты, которым выполнен сеанс плазмафереза не позднее 3 ч после начала реперфузии трансплантата; во 2-ю – больные, которым плазмаферез не проводился. Все пациенты получали иммуносупрессивную терапию, которая включала ингибитор кальциневрина (циклоспорин А или такролимус), микофенолаты и преднизолон.
Сеанс плазмафереза проводили на аппарате фирмы «Haemonetics PCS-Ultralite» в течение 1,5–5,0 ч. За сеанс удаляли 1150–3250 мл плазмы (30–40 мл на 1 кг массы тела больного) со скоростью 600–1200 мл/ч.
Удаляемый объем плазмы рассчитывали в соответствии с должным ОЦП с учетом показателя гематокрита, который на момент начала процедуры колебался в пределах 25–35%. Заместительная терапия составляла 70–150% от объема удаленной плазмы с инфузией от 1,2 до 3,3 (2,64±0,62) л различных растворов, объем и состав которых зависели от состояния гемодинамики, величины диуреза, характера и темпа отделяемого по дренажу: использованы раствор Рингера, дисоль, физиологический раствор, 10%-ный раствор альбумина и свежезамороженная плазма.
Для оценки функции почечного трансплантата в послеоперационном периоде ежедневно определяли скорость клубочковой фильтрации (СКФ; по клиренсу эндогенного креатинина). Степень ишемического повреждения трансплантата оценивали по СКФ в 1-е сутки после операции. Также проводили сравнительную оценку групп пациентов по срокам нормализации азотовыделительной функции трансплантированной почки, по количеству сеансов гемодиализа, потребовавшихся до восстановления функции трансплантата, и количеству утраченных трансплантатов по причине отсутствия функции.
В послеоперационном периоде всем больным начиная с 1-х суток осуществлен динамический контроль внутриорганного кровообращения с помощью дуплексной сонографии на аппарате Logic 700. Для исключения экстраренальных осложнений, контроля размеров и эхоструктуры трансплантата всем больным проведено ультразвуковое сканирование в В-режиме. Исследован артериальный и венозный кровоток в трансплантатах. Артериальный кровоток изучали в основной артерии и ее ветвях до дуговых артерий. Определяли систолическую скорость кровотока (Vs), диастолическую скорость кровотока (Vd), реверсивный кровоток (Vr); в автоматическом режиме рассчитывали индекс сопротивления Ri по формуле Ri=Vs–Vd/Vs.

Результаты и обсуждение. Выявлено, что даже трансплантаты с первичной функцией имели ишемические повреждения той или иной степени выраженности, однако спектральная допплерография выявила существенные различия в показателях индекса сопротивления в трансплантатах у пациентов 1-й и 2-й групп (табл. 2).
Цветное допплеровское картирование всех трансплантатов с немедленной функцией выявило существенные различия между ними в зависимости от того, проведен реципиентам плазмаферез или нет: в 1-й группе трансплантаты характеризовались более четким и равномерным окрашиванием междолевых и дуговых артерий, а также богатым сосудистым рисунком и отсутствием мозаичности в различных сегментах трансплантата (см. рисунок).
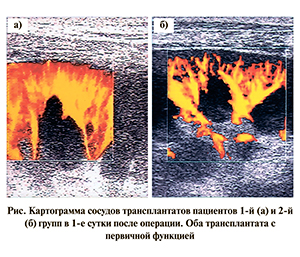 Установлена прямая взаимосвязь между величиной клубочковой фильтрации и линейной скоростью кровотока в междолевых артериях в 1-е сутки послеоперационного периода (r=0,54; p=0,02) и обратная зависимость между выделительной функцией трансплантата и величиной индекса сопротивления (r=0,49; p=0,01).
Установлена прямая взаимосвязь между величиной клубочковой фильтрации и линейной скоростью кровотока в междолевых артериях в 1-е сутки послеоперационного периода (r=0,54; p=0,02) и обратная зависимость между выделительной функцией трансплантата и величиной индекса сопротивления (r=0,49; p=0,01).
Только 4 пациента 1-й группы нуждались в проведении гемодиализа после трансплантации, тогда как во 2-й таких был 21 пациент.
В 1-й группе не было пациентов с первично нефункционирующим трансплантатом, тогда как во 2-й 3 трансплантата были удалены в связи с полным отсутствием функции в течение 2 мес после операции.
Все трансплантаты в 1-е сутки после операции характеризовались сниженной клубочковой фильтрацией (табл. 3).
Реципиентам, у которых СКФ трансплантата превышала 20 мл/мин, гемодиализ не проводили, тогда как ее снижение менее 6 мл/мин требовало проведения гемодиализа. Помимо этого у пациентов 1-й группы количество сеансов гемодиализа было значительно меньше по сравнению с таковым у пациентами 2-й группы: 5 (4–9) и 12 (9–14) соответственно. Четырем реципиентам 2-й группы с СКФ 6–20 мл/мин также потребовалось проведение нескольких сеансов гемодиализа в послеоперационном периоде.
Количество проведенных сеансов гемодиализа зависело от степени ишемического и реперфузионного повреждения трансплантата и величины клубочковой фильтрации в 1-е сутки после операции. ПА оказывал существенное положительное воздействие на начальную функцию трансплантата и сроки нормализации их азотовыделительной функции.
У больных 1-й группы с первичной функцией трансплантата в 1-е сутки после операции диастолический кровоток значительно (в 1,6 раза) превышал таковой у больных 2-й группы, а индекс сопротивления в 1-й группе был существенно ниже, чем во 2-й. Таким образом, в 1-й группе реципиентов гемодинамические показатели трансплантатов были лучше, что, по нашему мнению, обусловлено положительным влиянием плазмафереза.
На 3-и сутки после операции у больных 1-й группы с первичной функцией трансплантата диастолический кровоток и индекс сопротивления оставались практически неизменными, тогда как во 2-й группе на фоне неизменных значений индекса отмечено некоторое нарастание скорости диастолического кровотока.
Наше исследование не выявило статистически значимых различий в первые сутки между реципиентами 1-й и 2-й групп с отсроченной функцией трансплантата по диастолической скорости кровотока и резистивному индексу. На 3-и сутки после операции между реципиентами 1-й и 2-й групп с отсроченной функцией трансплантата установлены статистически достоверные различия между группами по резистивному индексу. При этом скорость диастолического кровотока также была значительно ниже у больных 2-й группы.
Эти показатели достоверно отражали состояние внутриорганного кровотока и степень ишемического повреждения трансплантата, которая влияла на сроки нормализации азотовыделительной функции.
В нашем исследовании при цветном допплеровском картировании на фоне легкой степени повреждения в каждом сегменте трансплантата визуализировалось несколько междолевых и дуговых артерий с хорошо выраженным диастолическим кровотоком.

Тяжелая степень ишемического повреждения трансплантата наблюдалась у пациентов с отсроченной функцией. В этих случаях при цветном допплеровском картировании визуализировались единичные междолевые артерии и практически не определялись дуговые артерии. Перфузия почки была неравномерной. По данным спектральной допплерографии отмечено снижение, а в некоторых наблюдениях – и полное отсутствие диастолического кровотока. Восстановительный период у таких пациентов носил затяжной характер, и до восстановления азотовыделительной функции почек требовалось проведение гемодиализа. Спектральная допплерография выявила достоверные различия между реципиентами 1-й и 2-й групп по индексу сопротивления.
Таким образом, СКФ в 1-е сутки после операции, характер начальной функции и срок восстановления адекватной функции трансплантата напрямую связаны с состоянием внутрипочечной гемодинамики.
Так, СКФ менее 6 мл/мин в 1-е сутки после операции указывала на пролонгированное течение острого канальцевого некроза, а скорость ее восстановления – на тяжесть ишемического и реперфузионного повреждения трансплантата.
При выраженном остром канальцевом некрозе диастолический кровоток в междолевых артериях в 1-е сутки послеоперационного периода бывает сильно снижен – вплоть до полного его отсутствия. Степень снижения диастолического кровотока косвенно отражает выраженность повреждения трансплантата. Именно поэтому до восстановления функции трансплантата с полным отсутствием диастолического кровотока требуется более длительное применение поддерживающих сеансов гемодиализа, нежели для трансплантата с частично сниженным кровотоком.
Высокий индекс сопротивления (Ri>0,9) при низкой скорости кровотоков в междолевых артериях в 1-е сутки после операции является информативным критерием диагностики острого канальцевого некроза и указывает на неадекватное кровоснабжение почки. Низкая СКФ (менее 6 мл/мин) в 1-е сутки после операции всегда была сопряжена с высоким индексом сопротивления. Проведенные исследования позволили констатировать, что исходная величина СКФ с учетом начальной фазы мочевыделения может быть использована для экспресс-диагностики ишемического повреждения и прогнозирования функции трансплантата.
Длительная ишемия трансплантата всегда сопровождается сужением внутриорганных сосудов разной степени выраженности. Несомненно, важнейшее место в развитии вазоконстрикции занимают постишемические и реперфузионные расстройства, в основе которых лежит накопление ионов кальция в клетке после восстановления кровотока, что в основном и приводит к переполнению саркоплазматического ретикулума кальцием и нарушению функции митохондрий, а иногда и к разрыву клетки.
Процедура плазмафереза, проведенная не позднее 3–5 ч после операции, снижая тяжесть метаболических нарушений, улучшает внутриорганный кровоток, что позволяет значительно улучшать функциональное состояние аллотрансплантированной почки.
Заключение. Результаты настоящего исследования могут служить прямым доказательством выраженного позитивного воздействия плазмафереза в раннем послеоперационном периоде на состояние внутриорганного кровотока, что позволяет значительно улучшать функцию трансплантированной почки и сокращать сроки нормализации азотовыделительной функции.
Динамический контроль за внутриорганным кровообращением почечного трансплантата с помощью дуплексной сонографии является высокоинформативным методом диагностики посттрансплантационных осложнений.



