Введение. Пересадка почки, обеспечивающая высокое качество жизни пациентам с терминальной хронической почечной недостаточностью (тХПН) во всем мире, признана одним из главных достижений современной медицины. То, что 50 лет назад было экспериментальным, рискованным методом ограниченного применения, стало рутинной клинической практикой более чем в 80 странах мира [1–3].
Во всем мире отмечается неуклонный рост количества больных хронической болезнью почек (ХБП). С одной стороны, это связано с ростом числа пациентов с заболеваниями почек, с другой – с распространенностью заболеваний, которые приводят к формированию ХБП, таких как сахарный диабет, артериальная гипертензия, хронический пиелонефрит, системные заболевания и др. Независимо от этиологии и патогенетических механизмов повреждения почек эти заболевания приводят к прогрессирующему, устойчивому к терапии, необратимому склерозу почечной паренхимы [4–7].
К основным проблемам современной трансплантологии можно отнести дефицит донорских органов, развитие послеоперационных осложнений, а также дисфункцию трансплантата. Так, однолетняя выживаемость почечных трансплантатов варьируется от 93% (от трупных доноров) до 97% (от живых доноров), пятилетняя выживаемость составляет в среднем 95%. Улучшение данных показателей достигается оптимизацией протоколов иммуносупрессии. Частота послеоперационных осложнений (урологических, сосудистых, геморрагических) достигает 17%. Динамическая ультразвуковая допплерография (УЗДГ) зачастую позволяет своевременно выявлять дисфункцию почечного трансплантата и купировать неблагоприятное течение послеоперационного периода [8–14].
Цель исследования: определение особенностей кровотока почечного трансплантата в раннем посттрансплантационном периоде.
Материал и методы. Проанализированы результаты хирургического лечения 110 пациентов, которым была выполнена ортотопическая трансплантация почек в хирургическом отделении Федерального Сибирского научно-клинического центра ФМБА России. Мужчин было 51 (46%), женщин – 59 (54%). Средний возраст прооперированных составил 47 [36; 53] лет, индекс массы тела – 23,7 [21,8; 26,4] кг/м2. Средняя длительность нахождения больных в стационаре составила 17 [14; 24] сут. Пересадка почки от трупного донора проведена 106 (96%) пациентам, от живого родственного донора – 4 (4%).
Показанием к трансплантации была хроническая болезнь почек 5-й стадии в исходе основного заболевания: хронического гломерулонефрита – у 70 (64%), аутосомно-доминантного поликистоза почек – у 22 (20%), диабетической нефропатии – у 10 (9%), хронического пиелонефрита – у 8 (7%) пациентов.
Удаление трансплантата было выполнено 6 пациентам, что составило 5%. У 5 пациентов причиной стала острая дисфункция нефротрансплантата вследствие клеточного и гуморального отторжения, у 1 – кортикальный некроз, разрыв верхнего полюса трансплантата на 4-е сутки после операции.
Также были выявлены следующие осложнения послеоперационного периода, которые разделили на ранние и поздние. К ранним осложнениям относились гематома нефротрансплантата – 9 (8%) и несостоятельность уретероцистонеоанастомоза – 8 (7%). Среди поздних осложнений диагностировали острый пиелонефрит нефротрансплантата – 12 (11%) наблюдений, стриктуру мочеточника – 8 (7%), пострансплантационный глюкостероидиндуцированный сахарный диабет – 8 (7%) наблюдений, С-образный изгиб почечной артерии нефротрансплантата – 4 (4%), критический стеноз почечной артерии нефротрансплантата – 4 (4%).
По результатам оценки методом Каплана–Мейера пятилетняя выживаемость почечного трансплантата составила 88%, пятилетняя выживаемость реципиентов составила 94%.
Всем пациентам было выполнено ультразвуковое исследование почечного трансплантата в режиме цветного допплеровского картирования как основной инструментальный метод диагностики дисфункции почечного трансплантата в динамике с первых суток и до выписки. Показателями контроля служили показатели кровотока контралатеральной почки.
Статистическая обработка данных проводилась при помощи статистической программы STATISTICA 7.0, Stat Soft. Качественные показатели представлены в виде абсолютных и относительных (%) значений, количественные – в виде медианы и нижнего и верхнего квартилей (Me [Q1; Q3]). Для оценки статистической значимости различий между группами применяли точный критерий Фишера. Статистически значимыми считали различия при уровне значимости меньше 0,05.
Результаты и обсуждение. В таблице отражены ультразвуковые и допплеровские показатели почечного трансплантата и его кровотока в послеоперационном периоде в динамике. Согласно данным, полученным при ультразвуковом исследовании (УЗИ), увеличенный в 1-е сутки объем трансплантата к моменту выписки уменьшался и достигал средних значений контроля. Это обусловлено уменьшением отека трансплантата в раннем послеоперационном периоде и подтверждается уменьшением объема почечного трансплантата на момент выписки (р=0,161). Толщина паренхимы в средней трети (ср/3) значимо уменьшилась на момент выписки (р=0,056), а также толщина коркового слоя, в то время как толщина паренхимы в нижней трети (н/3) и верхней трети (в/3) оставалась практически без изменений.
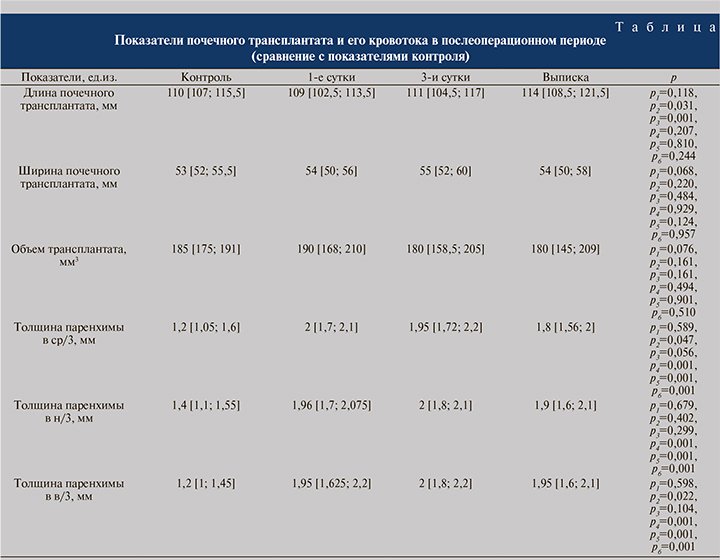
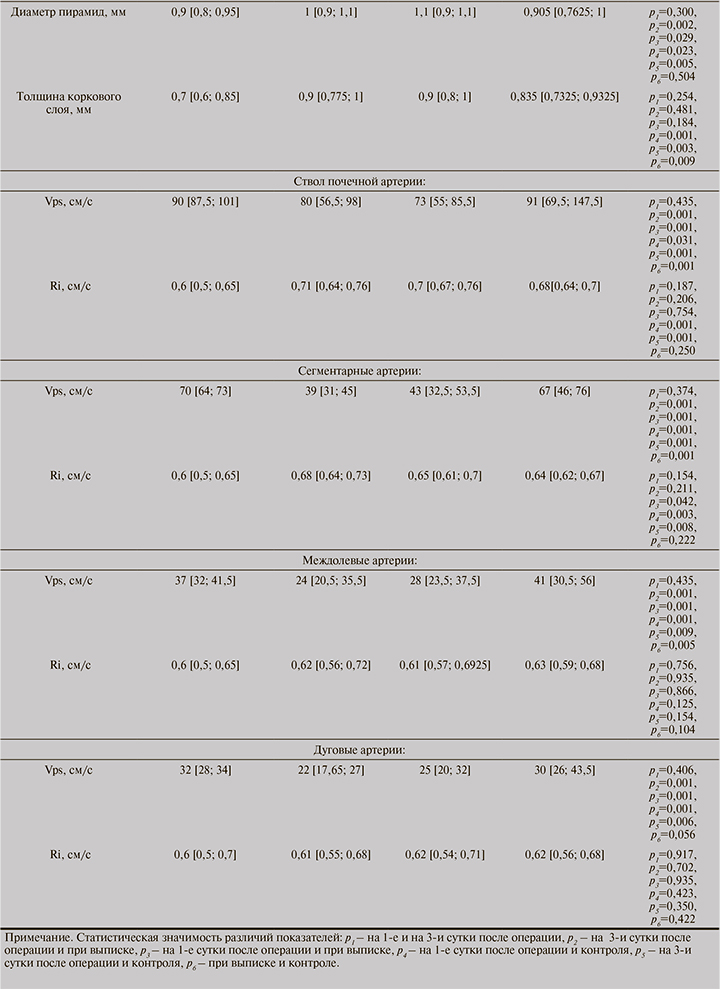
Скорость кровотока к выписке достоверно увеличивалась, в частности в стволе почечной артерии, в сегментарных артериях, в междолевых артериях и в дуговых артериях (р=0,001). В то время как индексы резистентности прак-тически не изменялись в динамике, известно, что увеличение RI может происходить при различных состояниях, таких как тромбоз почечных вен, инфекции трансплантата, обструктивная уропатия.
Согласно полученным данным, показатели УЗИ почечного трансплантата к моменту выписки достигают средних показателей контроля. Были определены статистически значимые показатели оценки почечного трансплантата и его кровотока в послеоперационном периоде. Так, статически значимыми являются показатели толщины паренхимы в ср/3 (p4 – 0,001, p5 – 0,001, p6 – 0,001), толщины паренхимы в н/3 (p4 – 0,001, p5 – 0,001, p6 – 0,001) и толщины паренхимы в в/3 (p4 – 0,001, p5 – 0,001, p6 – 0,001).
При анализе скорости кровотока в почечном трансплантате в динамике статистически значимая связь обнаружена у следующих показателей: скорость кровотока в стволе почечной артерии (p4 – 0,031, p5 – 0,001, p6 – 0,001), медиана скорости кровотока в сегментарных артериях (p4 – 0,001, p5 – 0,001, p6 – 0,001) и медиана скорости кровотока в междолевых артериях (p4 – 0,001, p5 – 0,009, p6 – 0,005).
При анализе показателей УЗИ почечного трансплантата на 1-е, 3-и сутки после операции и при выписке была проведена сравнительная характеристика в динамике и с показателями контроля. За счет уменьшения толщины паренхимы в средней трети, диаметра пирамид и объема почечного трансплантата в целом отмечалось увеличение кровотока в сосудах почечного трансплантата. Кровоток по стволу почечной артерии, сегментарным артериям, междолевым артериям и дуговым артериям почечного трансплантата восстанавливается на момент выписки. Индексы резистентности достигали значений контроля уже в 1-е сутки. По всем артериям почечного трансплантата скорость кровотока сначала уменьшалась, затем восстанавливалась до референтных значений на момент выписки, в то время как индексы резистентности были в границах нормы после операции. В ходе проведенных исследований оценки почечного трансплантата с помощью цветной и спектральной допплерографии было определено ограниченное ее диагностическое значение для дифференциации дисфункции почечного трансплантата. В почечном аллотрансплантате силовая допплерография определяет кортикальную перфузию, которая зависит от целостности мелких сосудов, которые обычно рано поражаются при дисфункциях почечного трансплантата, особенно при остром отторжении и нефротоксичности. Высокий RI наблюдается при любой форме дисфункции трансплантата и является предиктором клинического исхода у пациентов после трансплантации [11].
Заключение. Практически во всех наблюдениях после пересадки почечного трансплантата в послеоперационном периоде сохранялись нарушения кровотока за счет отека в раннем послеоперационном периоде. При выписке отмечалась нормализация показателей скорости кровотока почечного трансплантата в сравнении со средними величинами контроля. Это позволяет предположить удовлетворительное функциональное состояние почечного трансплантата. Применение ультразвукового исследования и допплерографии для оценки состояния трансплантата является диагностически ценным неинвазивным методом.



