Актуальность. Терминальная хроническая почечная недостаточность является актуальной проблемой в медицинской и социальной сферах жизни общества. Наилучший результат лечения больных терминальной стадией хронической болезни почек (ХБП) достигается трансплантацией почки. Ежегодно наблюдается рост числа пересадок почек, повышается их эффективность, организационная работа службы трансплантаций; накапливается опыт и улучшаются навыки хирургов [1]. Трансплантация почки повышает выживаемость пациентов по сравнению с другими видами заместительной почечной терапии (ЗПТ) [2].
Встречаемость урологических осложнений (УО) после трансплантации почки (ТП) составляет 3,4–11,2% [3]. Несмотря на рост качества операций, УО приводят к длительной госпитализации и серьезным негативным последствиям для пациента, а ранние и поздние УО могут служить причиной как потери трансплантата, так и гибели больного [1, 4].
При изучении общедоступного материала и научных статей медицинских специалистов урологического профиля из разных стран нами были выделены некоторые общие положения по урологическим осложнениям, имеющие наиболее широкую доказательную базу. Наиболее часто встречающимися осложнениями урологического характера являются камни почки и мочеточника, обструктивная уропатия, пузырно-мочеточниковый рефлюкс (ПМР) и кисты трансплантированной почки.
Причиной обструктивной уропатии (ОУ) пересаженной почки, как правило, является формирование стриктуры трансплантированного мочеточника. Частота встречаемости ОУ среди прочих послеоперационных осложнений урологического профиля составляет от 1 до 6,5%. Стриктура может образовываться на всем протяжении мочеточника, но чаще формируется в дистальной его части, включая уретеронеоцистоанастомоз [3]. Вероятной причиной развития этого вида осложнения является недостаточное кровоснабжение, приводящее к ишемии и последующему фиброзу стенки мочеточника [5].
Достаточно эффективными методами коррекции при непротяженных стриктурах (менее 1 см) являются малоинвазивные эндоскопические вмешательства, такие как баллонная дилатация, бужирование и временное длительное стентирование мочеточника, имеющие эффективность от 49 до 100%, и при этом результат вмешательства напрямую связан со временем после трансплантации, протяженностью и локализацией обструкции [6]. При стриктурах не более 2 см хорошие клинические результаты достигаются баллонной дилатацией и лазерной уретеротомией, однако не рекомендуется использование этих методов при рецидивном формировании стриктуры [7]. Наилучшие результаты показывают реконструктивные методы коррекции (до 81%) [8].
Протяженная облитерация или стриктура мочеточника более 2 см требуют однозначного выполнения оперативного реконструктивного вмешательства. Наиболее оптимальным в такой ситуации является формирование пиелоцистоанастомоза, но при этом возрастают риски развития пузырно-мочеточникового рефлюкса, оказывающего негативное влияние на функцию трансплантата [9]. Возможностью оперативного лечения данного патологического состояния является выполнение уретеропиелоанастомоза, который является одним из наиболее эффективных хирургических способов решения данной проблемы и более выигрышным по сравнению с пиелоцистоанастомозом, так как не вызывает осложнений, связанных с пузырно-мочеточниковым рефлюксом (ПМР). Чаще всего этот вид оперативного вмешательства выполняется открытым способом [10].
Мочекаменная болезнь является довольно редким (менее 1%), но не менее проблематичным осложнением трансплантированной почки [3]. Она может приводить к обструкции мочевыводящих путей с развитием гидронефроза, анурии, мочевой инфекции и дисфункции трансплантата [11]. Вероятность развития нефролитиаза может быть связана с имеющимся конкрементом в почке до трансплантации, также имеют значение наличие компенсированной обструктивной уропатии, качество шва и шовного материала, присутствие инфекции и нарушений метаболизма [12]. Тем не менее часть медицинского общества считает, что возможно динамическое наблюдение при конкрементах не более 5 мм без нарушения уродинамики [13]. Последствия камней в трансплантате протекают гораздо тяжелее, чем у пациентов с собственными почками [14]. На текущий момент в лечении камней трансплантатов чаще всего используются дистанционная ударно-волновая литотрипсия (ДЛТ) и чрескожная перкутанная нефролитотрипсия (ЧПНЛ), значительно реже трансуретральная уретеролитотрипсия, литоэкстракция и открытые операции [11].
Серьезным урологическим осложнением является посттрансплантационная инфекция мочевыводящих путей (ИМП) в сочетании с ПМР, в большинстве случаев приводящим к нарушению функции почки и возврату на ЗПТ [15]. Сравнение исключительно консервативного лечения рефлюкса с консервативно-оперативным методом лечения в ряде исследований не показали преимуществ хирургического вмешательства [16]. Однако в исследовании Ayhan Dinckan утверждается, что хирургическое вмешательство показывает наилучшие результаты [17].
В последнюю группу осложнений отнесены кисты почечного трансплантата. Современная тенденция к росту количества кист почек в популяции и дефицит донорских органов потребовали расширения критериев их отбора, вследствие чего все чаще используются почки, которые имеют простые кисты [18]. Большинство кист протекают бессимптомно, но увеличение размеров кисты и могут влиять на функцию трансплантата, что в последующем может потребовать выполнения хирургического вмешательства [19]. Также наличие простых кист в донорской почке может влиять на раннюю и долгосрочную функции аллотрансплантата [20]. Кроме этого возможно инфицирование кист, что может требовать выполнения пункционного дренирования, в связи с чем при обнаружении кисты на поверхности почки на этапе обработки донорского органа выполняется иссечение кист донорских почек [21, 22].
Цель исследования: оценить спектр и характер урологических осложнений после аллотрансплантации трупной почки и методы их коррекции.
Материалы и методы. Проведен анализ результатов 209 трансплантаций почки от посмертного донора за период с 2014 по 2021 г., выполненных в отделениях трансплантации Красноярской краевой клинической больницы (102 трансплантации) и Сибирского научно-клинического центра Федерального медико-биологического агентства (СНКЦ ФМБА) (107 трансплантаций). Выделена группа из 27 пациентов с урологическими осложнениями, которым выполнена трансплантация почки в разных центрах трансплантации (22 в городе Красноярск, 5 – за пределами Красноярского края).
Результаты. Основным заболеванием среди пациентов, которым была выполнена трансплантация почки, являлся хронический гломерулонефрит 68,42% (n=143), в меньшем количестве поликистоз – 7,18% (n–15), хронический пиелонефрит – 4,78% (n=10), 9 (4,31%) пациентов с диабетической нефропатией, 9 (4.31%) – с хроническим тубулоинтерстециальным нефритом, 6 (2,87%) с гипертонической нефропатией, по 3 (1,44%) пациента с синдромом Альпорта и ПМР. По 1 (по 0,48%) пациенту диагностированы ангиодисплазия почек, нефропатия смешанного генеза, ишемическая болезнь почек, геморрагический васкулит, стриктура уретры, IgA-нефропатия, хронический нефротический синдром неуточненной этиологии, нефросклероз, врожденный гидронефроз. Среднее количество несовпадений по HLA (Human Leukocyte Antigens, человеческий лейкоцитарный антиген) составило 4,5 ±0,9. Группу реципиентов составили 113 мужчин и 95 женщин. Первичная функция трансплантированной почки зафиксирована у 75,1% (n=157), вторичная – у 24,9% (n=52). Годовая выживаемость трансплантатов составила 90,08%, 5-летняя – 83,54%.
Осложненное течение позднего посттрансплантационного периода зарегистрировано у 32,54% (n=68) пациентов. Наиболее значимую группу составили урологические осложнения 37,7% (n=29), немного реже встречались инфекционные – 27,2% (n=21), иммунологические – 24,7% (n=19), онкологические – 5,2% (n=4) и сосудистые – 5,2% (n=4). Подавляющее количество осложнений имели обратимый характер, были корригированы консервативным или оперативным путем. Стоит отметить, что после достижения кривой обучаемости количество осложнений стало соответствовать общемировым литературным данным [23].
Потери трансплантата за 7-летний период зафиксированы у 13,4% пациентов (n=28). Основной причиной потери трансплантированной почки в раннем послеоперационном периоде стали иммунологические осложнения, в позднем – связанные с урологическими осложнениями инфекционно-воспалительные заболевания.
Камни трансплантированной почки и мочеточника
Камни трансплантированной почки зафиксированы у двух пациентов, которым выполнена чрескожная нефролитолапаксия. Одному пациенту нефролитолапаксия выполнена через 12 лет после трансплантации – удалены 3 конкремента до 1 см в диаметре. Второму пациенту операция проведена через 5 лет после трансплантации по поводу камня до 1,5 см в лоханке трансплантированной почки.
Пункция полостной системы выполнялась под ультразвуковым наведением в положении пациента на спине, с учетом расположения трансплантированного органа доступ осуществлялся в подвздошной области в безопасной зоне, принимая во внимание данные МСКТ.
Камни мочеточника трансплантированной почки диагностированы у 3 пациентов на различных сроках – от 1 до 10 мес. Одному пациенту в связи с развитием анурии предварительно потребовалось дренирование трансплантата путем пункционной нефростомии и последующим выполнением антеградной гибкой уретеролитотрипсии.
Развитие уретерогидронефроза после удаления стента мочеточника в посттрансплантационном периоде и диагностирование камня мочеточника до 10 мм зафиксированы у двух пациентов, до развития дисфункции трансплантата пациентам проведена ретроградная контактная литотрипсия (рис. 1).
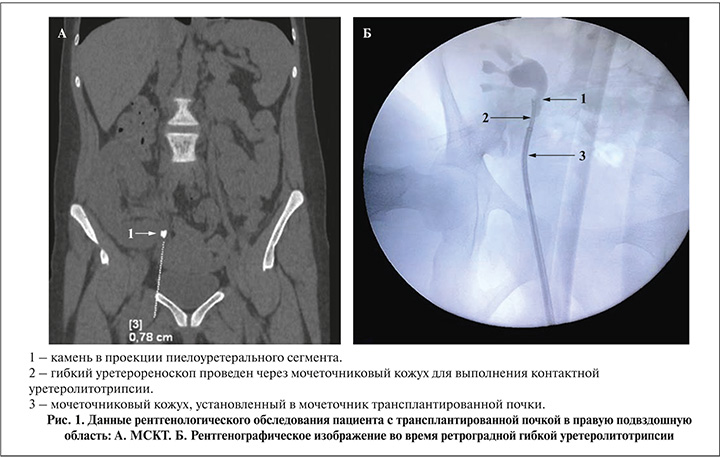
Оперативные вмешательства как при антеградном, так и при ретроградном доступе завершались стентированием мочеточника трансплантированной почки, при этом период дренирования составил от 2 до 4 нед. После удаления стента нарушения уродинамики отмечено не было.
Устье мочеточника трансплантированной почки нередко располагается на боковой или переднебоковой стенке мочевого пузыря. Ход мочеточника, а также ригидность парауретеральных тканей существенно ограничивают использование ригидного уретероскопа. В связи с этим внедрение в практику гибкой уретеропиелоскопии расширяет возможности ретроградного доступа в трансплантированный мочеточник и почку, что может определить использование этой технологии как операцию выбора при камнях трансплантированной почки и мочеточника.
Киста трансплантированной почки
Кисты трансплантированной почки зафиксированы у щести пациентов. Размер кист варьировался от 1 до 6 см, двум пациентам потребовалось оперативное вмешательство. Необходимость вмешательства определялась наличием клинических проявлений в виде формирования нарушения уродинамики, связанного с расположением кисты в проекции почечного синуса. Обоим пациентам выполнено чрескожное дренирование кисты, у одного через 2 года диагностировано рецидивное течение (рис. 2).
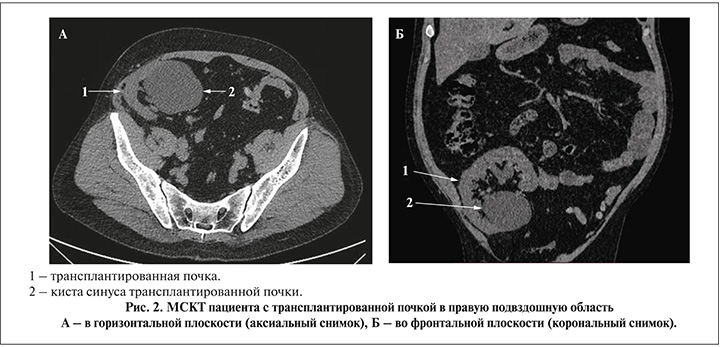
Наличие рецидивного кистозного образования трансплантированной почки с нарастанием дисфункции органа стало определяющим для выполнения лапароскопического иссечения кисты. Интраоперационно с целью минимизации операционной травмы при диссекции тканей был использован лапароскопический ультразвуковой датчик.
Послеоперационный период протекал без осложнений, отмечено улучшение функции трансплантата в виде снижения креатинина с 164 до 137 мкмоль/л. Признаков рецидива кисты за период наблюдения 6 мес. нет. Морфологическое заключение удаленного образования расценено как простая киста почки.
Обструктивные осложнения трансплантированной почки
Обструкция трансплантированного мочеточника диагностирована у 10 пациентов. Выбор тактики лечения определялся с учетом протяженности обструкции. Предварительно всем пациентам потребовалось проведение чрескожной пункционной нефростомии с целью компенсации явлений дисфункции трансплантата сроком от 3 до 6 нед. После этого проводилась антеградная пиелография с определением протяженности стриктуры трансплантированного мочеточника. Стриктура уретероцистоанастомоза протяженностью менее 1 см зафиксирована у 5 пациентов: у 3 пациентов диагностирована обструкция до 4 см, у 2 – отмечена облитерация мочеточника на всем протяжении.
Пациентам с обструкцией уретероцистоанастомоза протяженностью менее 1 см выполнялась антеградная гибкая уретероскопия с дополнительным визуальным цистоскопическим контролем (рис. 3).
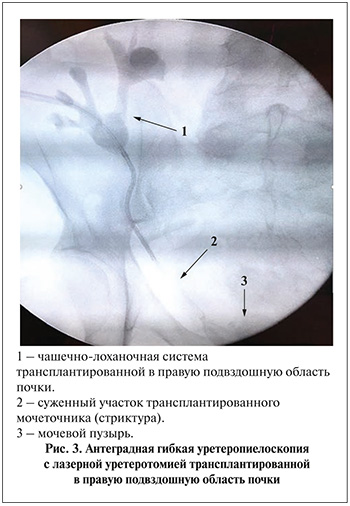
Двойной (антеградно гибким видеопиелоскопом и ретроградно цистоскопом) визуальный контроль позволял определять наиболее безопасное место для выполнения уретеротомии с использованием в трех случаях гольмиевого и тулиевого лазеров (в режиме использования 10 Гц, 10 Вт). После выполнения лазерной уретеротомии всем пациентам проводилось стентирование мочеточника стентом № 5 или 6 № Ch длиной не более 12 см сроком на 12–14 нед.
Результат оперативного вмешательства оценивался ультразвуковым исследованием после удаления мочеточникового стента. Отсутствие нарушения уродинамики и нарастания азотемических показателей отмечено у четырех пациентов. Срок наблюдения составил от 12 до 61 месяца.
После удаления мочеточникового стента у одного пациента зафиксировано развитие гидронефроза трансплантата, что потребовало дополнительного периода дренирования мочеточника еще на 3 мес., после чего стент был удален, но отмечено нарастание гидронефроза. В связи с этим пациенту повторно проведена пункционная нефростомия.
В последующем пациенту проведена реконструктивная операция – уретероцистонеоанастомоз.
Принимая во внимание дефицит тканей мочеточника трансплантированной почки при выполнении уретероцистоанастомоза, наиболее оптимальным вмешательством является операция Боари, которая проведена 5 пациентам (4 операции выполнены открытым доступом, 1 – лапароскопическим).
Операция проводилась на мочеточниковом стенте, период стентирования составил от 5 до 9 нед., уретральный катетер удалялся на 9-е сутки. Послеоперационных осложнений более 2-й категории по Clavien–Dindo у пациентов зафиксировано не было. После удаления мочеточникового стента проведен ультразвуковой динамический контроль, у всех пациентов отмечено восстановление уродинамики и сохранение функции трансплантированной почки (период наблюдения от 12 мес. до 7 лет).
Пузырно-мочеточниковый рефлюкс
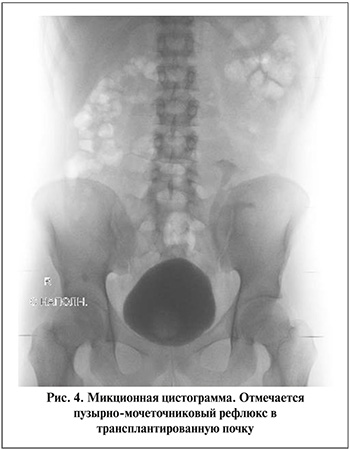
По данным ранее проведенных исследований доказана важная роль инфравезикальной обструкции и дисфункции мочевого пузыря по типу гипертонии или гиперактивного мочевого пузыря (ГАМП) в развитии пузырно-мочеточникового рефлюкса в трансплантированную почку [24] (рис. 4). Инфравезикальная обструкция была исключена у всех пациентов. Диагностированный ПМР отмечен у 10 пациентов, всем было проведено комплексное уродинамическое исследование. Признаки ГАМП выявлены у семи пациентов, четырем на фоне консервативной терапии М-холинолитиками отмечен положительный эффект и в последующем обострений пиелонефрита отмечено не было. Тем не менее в шести случаях потребовалась коррекция в связи с прогрессирующей дисфункцией трансплантированной почки и сохраняющимися обострениями пиелонефрита, при этом всем пациентам с ГАМП продолжена терапия М-холинолитиками. Четырем пациентам из шести при трансплантации был выполнен прямой уретероцистоанастомоз, двум – с антирефлюксным компонентом в модификации по Лич Грегуару.
Определяющим фактором для коррекции ПМР в трансплантированную почку является наличие рецидивирующих атак пиелонефрита с прогрессивным развитием дисфункции трансплантата. Четырем пациентам проведена эндовезикальная пластика устья мочеточника с использованием объемообразующих субстанций, в нашем случае использовался Vantris в зависимости от размеров устья. Так, при смыкающемся устье пластика проводилась по методике STING, количество вводимого раствора составляло 1–2 мл, при зияющем устье, но не более 5 мм объем составлял 3–4 мл, коррекция проводилась по комбинированной методике HIT+STING. Операция выполнялась под внутривенным наркозом с предварительным стентированием мочеточника на 2–3 нед. После удаления мочеточникового стента уродинамика оценивалась ультразвуковым исследованием. Отсутствие рефлюкса и рецидивирующего пиелонефрита отмечено у четырех пациентов, у двух пациентов клинический эффект не достигнут.
Отсутствие эффекта от эндовезикальной коррекции устья трансплантированного мочеточника, а также размер устья более 5 мм и развитие уретерогидронефроза определили необходимость выполнения реконструктивной операции.
Использование собственного мочеточника при протяженной облитерации трансплантированного мочеточника и при неэффективности эндовезикальной коррекции ПМР
Решение проблемы протяженной стриктуры мочеточника трансплантированной почки более 4 см является непростой клинической задачей. Наличие нефункционирующих почек у подавляющего числа пациентов с трансплантацией является определяющим для решения. Использование собственного мочеточника на ипсилатеральной стороне от трансплантата, по нашему мнению, является наиболее оптимальной тактикой. Двум пациентам с облитерацией всего трансплантированного мочеточника и трем пациентам с ПМР проведена хирургическая коррекция патологии с использованием нативного (собственного) мочеточника. Внедрение лапароскопического доступа в хирургическую практику существенно расширяет возможности этого оперативного вмешательства в связи с минимизацией хирургической травмы.
Для формирования анастомоза между собственным (нативным) мочеточником и лоханкой трансплантированной почки требуется предварительный этап в виде выполнения ипсилатеральной лапароскопической нефрэктомии, после чего нативный мочеточник выделяется по возможности до нижней трети.
Формирование перитрансплантатной инфильтрации, сложность анатомического ориентирования делают этап диссекции и выделения лоханки трансплантированной почки наиболее трудоемким и сложным, после которого выполняется уретеропиелоанастамоз нативного мочеточника с лоханкой трансплантированной почки на мочеточниковом стенте.
Период стентирования мочеточника составил 23–28 дней, уретральный катетер после операции был удален на 6-е сутки, дренаж из брюшной полости на 2-е. Течение послеоперационного периода протекало у всех пациентов без осложнений. После удаления мочеточникового стента проводилось ультразвуковое исследование, по результатам которого у всех пациентов не зафиксировано нарушений уродинамики; выделительная функция трансплантата удовлетворительная. Эпизодов рефлюкс-пиелонефритов не отмечено, период наблюдения составил от 13 до 48 месяцев.
Заключение. Наиболее частая проблема позднего после-операционного периода пациентов с трансплантацией почки носит урологический характер и связанные с ним инфекционно-воспалительные осложнения, приводящие к утрате функции трансплантата. Неизбежное увеличение количества пациентов с урологическими осложнениями трансплантата объяснятся увеличением естественной популяции трансплантированных пациентов. Своевременная диагностика урологического заболевания трансплантированной почки позволяет в подавляющем количестве случаев выполнять хирургическую коррекцию с достижением хорошего клинического результата, при этом методы коррекции проводятся по основным урологическим принципам.
Наличие клинически значимых конкрементов в мочевыводящих путях трансплантированной почки является показанием к проведению чрескожного или ретроградного эндоскопического вмешательства. По нашему мнению, наиболее оптимальным является использование ретроградного доступа с использованием гибкого уретерореноскопа, использование которого позволяет минимизировать риски послеоперационных осложнений.
Лечение обструктивных осложнений трансплантированной почки является сложной задачей, при этом эффективность эндоурологического хирургического вмешательства при стриктурах уретероцистоанастомоза протяженностью до 1 см достигает 75%. Реконструктивно-восстановительные операции обладают хорошими клиническими результатами при любой протяженности обструкции мочеточника. Однако они требуют достаточно высокой квалификации хирурга вследствие сложности топографо-анатомического ориентирования и диссекции в измененных перитрансплантных тканях. Внедрение лапароскопического доступа при этих операциях существенно снижает операционную агрессию и связанное с ней количество осложнений. Использование собственного мочеточника для выполнения реконструктивных операций является оптимальным при протяженных стриктурах мочеточника трансплантата, а также при некорригируемом ПМР в трансплантированную почку при исключении ГАМП и инфравезикальной обструкции.



