Актуальность. Хроническая болезнь почек (ХБП) как полиэтиологическая патология нефрона проявляется каскадом морфоанатомических изменений в паренхиме в виде фокально-сегментарного гломерулосклероза, сосудистого склероза и тубулоинтерстициального фиброза, возникающих вследствие как микробно-воспалительных, аутоиммунных, токсических, так и обструктивных причин [1, 2]. При этом патологический процесс характеризуется скрытным течением начала болезни и необратимостью в период клинико-лабораторной манифестации нефропатии. Разработка новых универсальных методов ранней диагностики, позволяющих визуализировать болезнь на доклинической стадии, а также контролировать функциональную состоятельность почек на более длительную перспективу, остается чрезвычайно актуальной задачей клинической урологии и нефрологии [3, 4].
Известно, что жизнеспособность тканей определяет функциональное состояние любого органа, в том числе и паренхимы почек. Новейшие высокотехнологичные и наукоемкие ядерные технологии, прежде всего позитронно-эмиссионная томография (ПЭТ) с различными изотопами биологически активных веществ, позволяют изучать важнейшие физиологические функции органа на клеточно-молекулярном уровне, а также количественно рассчитывать тонкие биохимические процессы, лежащие в основе различных патологических состояний [5, 6]. При этом нормальные, «уснувшие» или «оглушенные» ткани и рубцы часто соседствуют, а больные могут не предъявлять никаких жалоб даже при запущенных случаях локального поражения этого органа [7]. Наиболее информативным неинвазивным и морфофункциональным методом изучения жизнеспособности тканей принято считать совмещенную позитронно-эмиссионную и компьютерную томографию (ПЭТ/КТ) всего тела человека с 18F-ФДГ-глюкозой, захват которой в анализируемом регионе того или иного органа отражает жизнеспособность клеток. При этом стандартный показатель захвата изотопа (SUV) с высокой точностью (89–94%) позволяет оценивать ее количественно в условных единицах. Так, в процессе физиологической жизнедеятельности 18F-ФДГ-глюкоза активно утилизируется в митохондриях клетки, обеспечивая ее энергетические потребности [8]. Распределение радиофармпрепарата (РФП) в различных регионах органа оценивается в процентном отношении к величине максимального накопления (SUVmax). При величине минимального вклада накопления 18F-ФДГ-глюкозы (SUVmin) в максимальное его значение менее чем в 40% в пределах органа тканевые структуры подтверждают свою жизнеспособность. Увеличение его более чем на 50% указывает на угасание метаболических процессов, вплоть до полной потери функциональной состоятельности. При этом морфологическая целостность клеточных образований не исключает обратимости выявленных функциональных нарушений и может служить показателем эффективности лечебных мероприятий [9–12]. Морфоанатомическая верификация ХБП на сегодняшний день остается основным методом постановки нозологической формы поражения паренхимы почек. Прижизненная пункционная нефробиопсия, операционный и секционный заборы материала на гистологические исследования с визуальной оценкой состояния органа – безусловно объективные, но инвазивные, а иногда посмертные методы диагностики. Они позволяют выявлять гистологические проявлений ХБП в 16–18% случаев среди всех проведенных в популяции исследований почек, но, как правило, в стадии необратимых изменений [13–17]. Вместе с тем в России в настоящее время функционируют 15 радиологических центров, выполняющих суммарно более 130 тыс. ПЭТ/ЕКТ всего тела в год, и это количество постоянно растет. Исходя из вышеперечисленного, возникла необходимость изучения возможности использования ПЭТ/КТ всего тела человека независимо от показаний к ее проведению с целью клинической оценки жизнеспособности паренхимы почек в качестве скрининг-теста на выявление ХБП или дополнения к диагностической нефробиопсии [18, 19].
Материалы и методы. В рамках настоящей работы на основе случайно выборочного метода проанализированы результаты ПЭТ/КТ всего тела человека с 18F-ФДГ-глюкозой у 134 пациентов в возрасте 35–65 лет (63 мужчины и 71 женщина), выполненных в Радиологическом центре Тюменского областного онкологического диспансера в 2015–2019 гг. по поводу различных заболеваний, не связанных с патологией почек. При этом установлено, что в анамнезе 18 (13,3%) больных этой группы были указания на наличие ХБП (у 9 – хронический пиелонефрит, у 5 –хронический гломерулонефрит и у 4 – хронический интерстициальный нефрит). При анализе их клинико-лабораторного статуса на момент направления на ядерное исследование установлено, что в 8 случаях имело место проявление изолированного мочевого синдрома, в 6 – клинико-лабораторные проявления ХБП без азотемии и в 4 проявлениях ХБП сопровождались повышением уровня креатинина крови до 0,150 ммоль/л. Во всех наблюдениях пациенты с проявлениями ХБП находились в состоянии ремиссии. ПЭТ/КТ-исследования выполнялись по стандартной методике на аппарате (Biograph) фирмы Siemens. Анализ полученных данных проводился визуальным методом с реконструкцией изображения. В работе изучались функциональные изменения в паренхиме почек, которые анализировались по ее тропности к 18F-ФДГ-глюкозе. Визуальный контроль дополнялся количественной оценкой этого процесса. Зоны метаболизма анализировались в автоматическом режиме по уровню захвата 18F-ФДГ-глюкозы регионами интереса (SUVmax и SUVmin) в условных единицах. Исследования проводились через 20 мин после внутривенного введения 5 мл препарата в дозе 200 МБк, изготовленного в Радиологическом центре на компактном циклотроне «Scanditronix».
Морфоанатомические исследования состояния клубочкового аппарата и тубулоинтерстициальной зоны выполнены на биопсийном, операционном и секционном материалах 45 пациентов с различными клинико-лабораторными проявлениями ХБП с использованием сетки Г. Г. Автангилова и расчетом в 30 полях зрения. Исследования проводились в патологоанатомическом бюро ГАУЗ ТО МК МЦ «Медицинский город» с окраской препаратов с помощью реактива Шиффа и визуальной оценкой при увеличении х25. Статистическая обработка материала проводилась согласно международным требованиям, предъявляемым к обработке данных научных исследований при помощи программы для персональных компьютеров Statistica for Windows (версия 11.5). Непрерывные переменные представлены в виде M±m. (Среднее±стандартная ошибка среднего). Достоверность выявленных различий оценивалась по t-критерию Стьюдента.
Результаты. Сравнительный визуальный анализ ПЭТ/КТ-томограмм почечной паренхимы с 18F-ФДГ-глюкозой, морфологической и анатомической структуры почки пациентов с неотягощенным нефроурологичесим анамнезом представлен на рис. 1. Проведенные исследования наглядно показали достаточную информативность комплексного взаимодополняющего морфофункционального и морфоанатомического исследования почек в условиях их физиологической состоятельности. При этом цветовое насыщение паренхимы энергоемкими молекулами 18F-ФДГ-глюкозы характеризовалось неравномерностью, напоминающей перистальтическую волну от коркового слоя, через структуры мозгового вещества паренхимы до полостей чашечно-лоханочной системы (условными пунктирами отмечены регионы интереса для исследования). Нормальная морфологическая картина элеметов нефрона визуально дополняла данные ПЭТ/КТ-томографии, и это нашло свое логическое отражение в четкой архитектонике макроструктуры почечной паренхимы.

При анализе данных сводной визуальной картины, отразившей этапы снижения жизнесопобности элеменов парехимы почек в процессе реазизации хронической болезни почек, выявлена определенная приемственность в проявлениях морфофункциональных и мофроанатомических измненений на клеточно-молекуляном уровне. Так, по визуальным данным ПЭТ/КТ наблюдалось поэтапное снижение интенсивности фиксации РФП в паренхиме, вплоть до появления регионов углеводного «аметаболизма», имеющих синий цвет. На гистологических препаратах в зависимости от выраженности проявлений ХБП имело место увеличение количества клубочков с утолщеной капсулой, плотными стенками сосудов, мембран канальцев и лейкоцитарно-лимфоцитарной инфильтрации интерстиция. На макропрепаратах почек в динамике нарастающих проявлений ХБП прогрессировала стертость визуальных границ коркового и мозгового слоев, сопровожавшаяся появлением признаков склерозирования и сморщивания паренхимы (рис. 2).
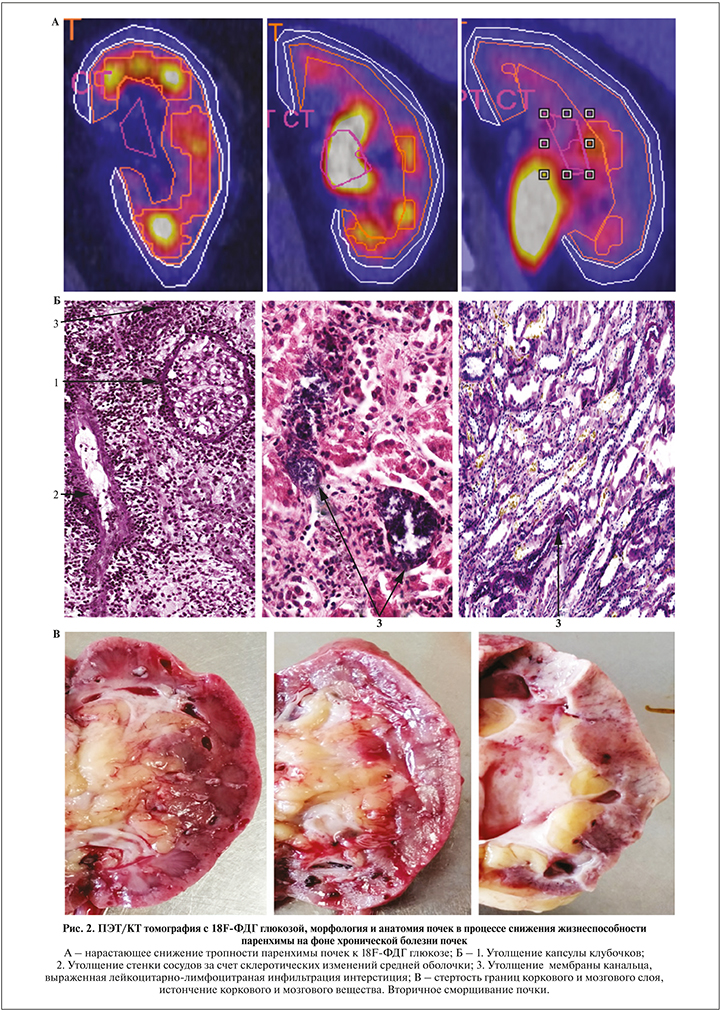
Количественный расчет интенсивности метаболизма 18F-ФДГ-глюкозы в паренхиме почек пациентов в различные стадии клинико-лабораторных проявлений ХБП представлен в табл. 1.
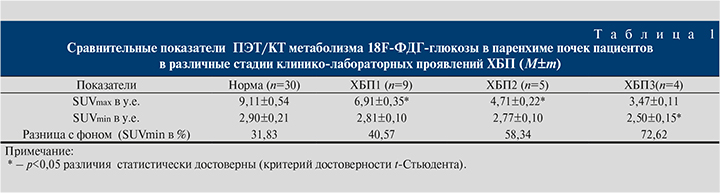
В результате проведенного исследования установлено, что у пациентов без нефроурологического анамнеза и клинико-лабораторных проявлений ХБП вклад показателя энергетического метаболизма SUVmin, отражающего уровень поддержания жизнеспособности клеточных элементов нефрона в показатель обеспечения энергичности процесса адекватного мочеобразования SUVmax, составлял не более 32%. У пациентов без нефроурологического анамнеза, но с наличием изолированного мочевого синдрома он увеличивался до 41%, что могло быть проявлением некоторого метаболического «оглушения» клеточных элементов нефрона. У больных с клинико-лабораторными проявлениями ХБП этот вклад превышал 50%, что указывало на значимое снижение жизнеспособности паренхимы. Для пациентов с ХБП в условиях начальных проявлений азотемии показатель поддержания жизнеспособности клеточных элементов нефрона (SUVmin) оказался достоверно ниже уровня, сопровождавшего метаболическое «оглушение» паренхимы, и составлял более 70% вклада в SUVmax, что позволило говорить о несостоятельности не только энергического обеспечения процессов очищения организма от азотистых шлаков, но и поддержания жизнеспособности самих нефронов.
Гистологические, а также морфометрические изменения гломерулярного аппарата и тубулоинтерстициальной зоны почек пациентов в различные стадии клинико-лабораторных проявлений ХБП представлены в табл. 2.

Проведенные исследования показали, что для функционально состоятельной паренхимы почек характерно ограниченное число обнаруженных склерозированных клубочков и лейкоцитарно-плазмоцитарных клеток на различных уровнях межуточной ткани, что могло быть проявлением естественного регенеративно-репаративного процесса по поддержанию физиологического уровня механизмов мочеобразования. В стадии ХБП-С1 (СКФ 95±3 мл/мин/1,73 м2) не было выявлено гистологических и морфометрических проявлений нежизнеспособности почечной паренхимы. Для стадии ХБП-С2 (СКФ 84±5 мл/мин/1,73 м2) оказалось характерным статистически значимое увеличение количества склерозированных клубочков и лейкоцитарно-плазмоцитарных клеток в межуточной ткани, свидетельствующее о реализации патологического процесса, сопровождающегося достоверным уменьшением количества функционирующих нефронов, однако компенсаторно-приспособительные паренхиматозные механизмы позволили сохранять уровень адекватного очищения крови. В стадии ХПН-С3 (СКФ=55±4 мл/мин/1,73 м2) наблюдалось дальнейшее увеличение числа функционально несостоятельных склерозированных клубочков и клеток, участвовавших в воспалительной инфильтрации межуточной ткани¸ что совпадало со снижением СКФ до уровня, характерного для необратимых морфологических изменений в паренхиме почек.
Обсуждение. В рамках объективизации представленных данных предлагаются два клинических примера, изображенных на рис. 3.

Пример А. ПЭК/КТ всего тела пациента без нефроурологического анамнеза с функционально состоятельными почками. На цветную визуальную реконструкцию почек наложены компьютеризированные цифровые данные, отражающие минимальные и максимальные уровни захвата 18F-ФДГ-глюкозы в различных регионах почек (белые цифры – проекция коркового слоя, оранжевые – проекция мозгового слоя, розовые – проекция лоханки) Во всех регионах паренхимы этого человека вклад уровня стандартного захвата SUVmin не превышал 30% от SUVmax, обеспечившего адекватность процесса мочеобразования.
Пример Б. ПЭК/КТ всего тела человека с проявлениями впервые выявленной ХБП. Несмотря на неустановленную нозологическую форму патологии, в данном клиническом случае оказалось возможным констатировать наличие процесса снижения жизнеспособности паренхимы обеих почек. Так, в регионах с вкладом стандартного уровня захвата молекул глюкозы (SUVmin) от 30 до 40% имело место проявление метаболического «оглушения» паренхимы, что не исключало возможности ее восстановления в процессе своевременно начатого этиотропного лечения.
В регионах паренхимы с вкладом SUVmin более 50% изменения гломерулярного аппарата и тубулоинтестициальной зоны оказались необратимыми, о чем свидетельствовали визуальные проявления сморщивания почек. Эта зона наиболее предпочтительна для проведения нефробиопсии, а данные ПЭТ/КТ могут быть инструментом для навигации ее проведения.
Выводы. В результате проведенного исследования установлено, что около 13% пациентов, прошедших ПЭТ/КТ-исследования всего тела с 18F-ФДГ-глюкозой независимо от показаний к ее проведению имели морфофункциональные проявления снижения жизнеспособности паренхимы по причине ХБП. Исходя из существующих требований к проведению ядерных исследований, оценка состояния почек не была сферой интереса как врача конкретной специальности, направившего пациента на процедуру, так и врача-радиолога, соблюдавшего требования действующих нормативов. Однако электронные носители материалов ПЭТ/КТ-исследования всего тела человека с 18F-ФДГ-глюкозой могут содержать неоценимую информацию о наличии скрытого течения ХБП, а сама технология в перспективе может стать дополнением или альтернативой нефробиопсии, а также инструментом для оценки эффективности проводимого лечения.



