Ведение. Скрытая угроза серьезных эпидемиологических осложнений, связанных с ростом антибиотикорезистентности возбудителей инфекций, передаваемых половым путем (ИППП), во всем мире, включая Россию, придает проблеме борьбы с ИППП особую значимость [1].
Уретрит является весьма распространенным заболеванием у мужчин, которое в подавляющем большинстве случаев обусловлено ИППП. В России, по данным официальной статистики, выявляется около 350 тыс. случаев уретритов ежегодно, однако эти показатели явно занижены ввиду недостаточной регистрации инфекций во многих коммерческих клиниках, с одной стороны, и высокой распространенности самолечения, с другой [2]. В то же время у 20–30 % больных негонококковыми уретритами не удается обнаружить никаких инфекционных агентов, за исключением представителей условно-патогенной микрофлоры, колонизирующей слизистые оболочки урогенитального тракта [3].
В мире на долю уретритов у мужчин приходится более 65% в структуре воспалительных заболеваний мочеполовой системы. Особое место занимают лица с латентными и бессимптомными формами болезни. Отсутствие клинических симптомов приводит к тому, что такие пациенты не обращаются в лечебные учреждения, а значит, продолжают инфицировать половых партнеров.
Классическая клиническая картина непосредственно после инкубационного периода развивается лишь у 40–50% инфицированных, из них еще около 20% пациентов имеют стертую картину инфекционного заболевания. Этими факторами обусловлена поздняя обращаемость пациентов к специалисту, что неизбежно приводит к развитию осложнений со стороны органов репродуктивной системы [4, 5].
Основными возбудителями воспалительных негонококковых заболеваний урогенитального тракта являются Сhlamydia trachomatis, Trichomonas vaginalis, а также Mycoplasma genitalium. Их обнаруживают в половых путях супругов в большинстве случаев бесплодного брака. Бесплодие при наличии хламидийной инфекции встречается у 50% инфицированных, при наличии мико- и уреаплазм – у 30%, трихомонад – примерно у 45%. С. trachomatis является наиболее частым этиологическим агентом негонококковых уретритов у мужчин. При этом клинические симптомы уретрита могут наблюдаться лишь у 40–60% пациентов [6]. Недостаточная эффективность антибактериальной терапии, длительные и неоднократные курсы лечения приводят к еще большему угнетению факторов местного иммунитета, снижению колонизационной резистентности репродуктивного тракта [7]. Кроме того, в последние годы отмечается неуклонный рост резистентности патогенных и условно-патогенных микроорганизмов к традиционно применяемым антибактериальным препаратам [8]. Сложившаяся на протяжении десятилетий порочная практика шаблонного назначения антибиотиков при разнообразной патологии без достаточных на то оснований привела к массе осложнений, резкому повышению уровня резистентности уропатогенов [9].
Для того чтобы получить требуемый фармакологический эффект, необходимо доставить лекарственное вещество непосредственно к пораженному органу, в частности в уретру [11]. Воспалительный процесс в уретре, в том числе инфекционного характера, всегда сопровождается нарушением целостности ткани. Процесс регенерации начинается одновременно с образованием грануляционной ткани. Фибриногенез сопровождается сложными многокомпонентными взаимодействиями клеточных структур, нарушением микроциркуляции в очаге воспаления, что препятствует достижению необходимой концентрации лекарственных средств в пораженном органе, а значит, не позволяет добиваться полной элиминации возбудителя инфекции [12]. В связи с этим для повышения эффективности лечения органов мочеполовой системы представляется необходимым применение таких лекарственных средств, которые прямо и непосредственно воздействовали бы на микробную клетку. На сегодняшний день таким препаратом является Мирамистин® [4]. Для понимания механизма, обеспечивающего высокую эффективность местно применяемых лекарственных средств, считаем необходимым вкратце остановиться на строении слизистой оболочки мочеиспускательного канала, где разворачиваются основные патологические процессы при хронических уретритах. Слизистая оболочка выстилает мочеиспускательный канал изнутри, влажная, покрытая слизью, в зависимости от кровенаполнения сосудов имеет цвет от ярко-красного до бледно-розового. Она состоит из двух основных слоев: эпителия и собственно слизистой оболочки. Между эпителием и собственно слизистой оболочкой находится базальная мембрана, в которой отсутствуют кровеносные сосуды. Таким образом, трофика эпителиальных клеток слизистой оболочки происходит за счет трансфузии интерстициальной жидкости, заполняющей межклеточное пространство всей ткани и образующейся в основном из плазмы крови. Концентрации лекарственных препаратов в интерстициальной жидкости, как правило, ниже таковой в плазме крови [13].
Использованный нами в качестве местного антисептика отечественный препарат Мирамистин® относится к группе катионных поверхностно-активных веществ, а именно к четвертичным аммониевым соединениям [14]. Препарат обладает широким спектром антимикробного действия, включая госпитальные штаммы, резистентные к антибиотикам. Оказывает выраженное бактерицидное действие в отношении грамположительных и грамотрицательных, аэробных и анаэробных, спорообразующих и аспорогенных бактерий, в виде монокультур и микробных ассоциаций. Он обладает выраженными антимикробными свойствами в отношении грамположительных и грамотрицательных бактерий, патогенных грибов, некоторых вирусов и простейших. Необходимо отметить, что Мирамистин® повышает чувствительность бактерий, грибов и простейших к действию антибиотиков. Синергизм действия Мирамистина® с антибиотиками и другими препаратами позволяет сокращать длительность лечения и значительно повышать его эффективность. Препарат характеризуется избирательностью действия, т.е. эффективно воздействует на патогенные микроорганизмы, в бактерицидных концентрациях не всасывается и не оказывает повреждающего действия на слизистые оболочки и кожные покровы [14]. Мирамистин® не обладает местно-раздражающим, мутагенным, канцерогенным и аллергизирующим свойствами. В отдельных случаях возникает кратковременное чувство жжения в месте применения, которое безопасно, проходит самостоятельно и не требует отмены препарата.
Кроме того, доказана способность Мирамистина® оказывать следующие эффекты:
- повышать местный иммунитет через стимуляцию защитных реакций в месте применения за счет активации поглотительной и переваривающей функций фагоцитов;
- усиливать процессы регенерации посредством стимуляции эпителизации и репаративных процессов в тканях, что ускоряет заживление;
- противовоспалительный за счет активизации процесса фибринолиза в очаге воспаления.
В основе биологического действия Мирамистина® лежит его прямое влияние на мембраны клеток микроорганизмов. Преобладающим механизмом является гидрофобное взаимодействие молекул Мирамистина® с липидными мембранами микроорганизмов, приводящее к их фрагментации и разрушению. Одновременно неполярная часть молекулы Мирамистина®, погружаясь в гидрофобную часть мембраны, разрушает надмембранный слой, разрыхляет мембрану, повышает ее проницаемость для крупномолекулярных веществ и изменяет энзиматическую активность клетки, угнетая ферментативные системы, т.е. ее жизнедеятельность. Катионный радикал Мирамистина® сначала уменьшает, а затем и нейтрализует заряд клеточной стенки. Мирамистин® на оболочки клеток человека действует слабее, поскольку их липидные радикалы имеют большую, чем радикалы мембран микроорганизмов, длину и гидрофобные взаимодействия с молекулами препарата не выражены [4]. Отечественный препарат Мирамистин® – бензилдиметил [3-(миристоила-мино)пропил] аммоний хлорид, моногидрат, выпускается в форме раствора для местного применения.
Цель исследования: оценить эффективность местного применения Мирамистина® в комплексном лечении хронических уретритов, ассоциированных с ИППП.
Материалы и методы. В исследовании приняли участие 150 человек в возрасте 19–49 лет (M±m=33,8±0,6) с давностью заболевания от 6 месяцев до 2 лет (M±m=1,2±0,8) при p≤0,05.
Исследование включило два последовательных этапа: первый – методом простой слепой выборки были сформированы две группы: основная (n=100) и группа сравнения (n=40), второй этап – оценка эффективности лечения пациентов основной группы с местным использованием раствора Мирамистин® в комплексном лечении больных хроническим уретритом по сравнению с эффективностью лечения больных группы сравнения, где местное лечение не применялось.
Общее лечение больных обеих групп поведено согласно Клиническим рекомендациям Российского общества дерматовенерологов [15]. В основной группе дополнительно к стандартному лечению проведены инстилляции уретры раствором Мирамистина® в объеме 3–4 мл с экспозицией 4 мин через день 5 раз с последующей рекомендацией больному воздерживаться от мочеиспускания в течение не менее 3 ч.
При выборе препарата руководствовались анамнестическими данными (аллергические реакции, индивидуальная непереносимость препаратов, наличие сопутствующих инфекций) и результатами определения антибиотикорезистентности возбудителя.
В лечении больных как основной группы, так и группы сравнения использовали следующие препараты. Гонококковая инфекция: цефтриаксон 250 мг однократно внутримышечно или цефиксим 400 мг однократно внутрь; микоплазменная инфекция: доксициклин по 100 мг внутрь 2 раза в сутки в течение 10 дней или джозамицин по 500 мг внутрь 3 раза в сутки в течение 10 дней, или азитромицин 500 мг внутрь в первый день, далее по 250 мг в сут. в течение 4 дней; хламидийная инфекция: доксициклин по 100 мг внутрь 2 раза в сут. в течение 7 дней, или азитромицин 1 г однократно, или джозамицин по 500 мг внутрь 3 раза в сутки в течение 7 дней; трихомонадная инфекция: метронидазол 2 г однократно внутрь, или тинидазол 2 г внутрь однократно, или орнидазол 1,5 г внутрь однократно; гарднереллез: орнидазол 500 мг внутрь 2 раза в сут. в течение 5 дней. Для лечения вирусной инфекции использовали препараты ацикловира в различных дозах в зависимости от клинических проявлений.
Группы были сопоставимыми по факторам, которые могли бы повлиять на конечный результат лечения. Таким образом, исследование носило рандомизированный характер, являющийся общепринятым стандартом качества научных исследований эффективности лечения согласно критериям доказательной медицины.
При диагностике ИППП руководствовались рекомендациями, разработанными Российским обществом дерматовенерологов и косметологов (Москва, 2012), учитывая, что в настоящее время приоритетными в диагностике возбудителей ИППП являются прямые методы исследования, при которых выявление возбудителя ИППП или его ДНК или РНК служит абсолютным подтверждением этиологического диагноза [15].
Верификация диагноза гонококковой инфекции базировалась на результатах микроскопического исследования препарата, окрашенного 1%-ным раствором метиленового синего и по Граму, а также культуральными и молекулярно-биологическими методами с освещением специфических фрагментов ДНК и/или РНК.
Диагностика инфекции, вызванной микоплазмами, хламидиями и вирусами, осуществлена с помощью молекулярно-биологических методов. Возбудителя урогенитального трихомониаза выявили путем микроскопического исследования нативного препарата, препарата, окрашенного 1%-ным раствором метиленового синего и по Граму, молекулярно-биологическим и культуральным методами.
Возбудителей урогенитального кандидоза и гарднереллеза определяли микроскопическим, культуральным и молекулярно-биологическим методами. О выраженности воспалительной реакции при всех инфекциях судили на основании результатов микроскопии биоматериала с оценкой пейзажа мазка.
Топический диагноз в обеих группах основывался на результатах цифровой оптиковолоконной видеоэндоскопии на эндоскопе фирмы «RZ» (Германия). Местная анестезия при этом проведена 2%-ным гелем лидокаина (2–3 мл с экспозицией 3–4 мин). В качестве ирригационной жидкости использован физиологический раствор комнатной температуры. Состояние уретры оценено по общей эндоскопической картине и данным разработанной О. А. Лобкаревым и адаптированной нами оценочной шкалы, определяющей состояние уретры по 13 основным параметрам, каждый из которых имеет 5 оценочных значений качества: «отличное» состояние уретры оценивалось в 52 балла, «плохое» – в 0 баллов [16].
Все контрольные исследования проводили через 4 нед. после окончания лечения, как того требуют Клинические рекомендации РОДВК (Москва, 2012).
При статистической обработке полученных данных применяли методы вариационной статистики с подсчетом средних показателей (М), их отклонений (δ) их ошибки (m). Оценку полученных данных проводили по критерию достоверности Стьюдента (t).
Аналитическое программное обеспечение: статистический анализ данных осуществлен с помощью программного обеспечения SAS®, версия 9,3, включившим статистическую базу данных, подлежащих оценке, включая все изменения, дополнения, а также получение и расчет переменных, зафиксированных в данной работе.
Результаты. Целью лечения стали:
- эрадикация возбудителя ИППП;
- предотвращение развития осложнений;
- предупреждение инфицирования других лиц;
- полное или частичное восстановление анатомической целостности поврежденных тканей.
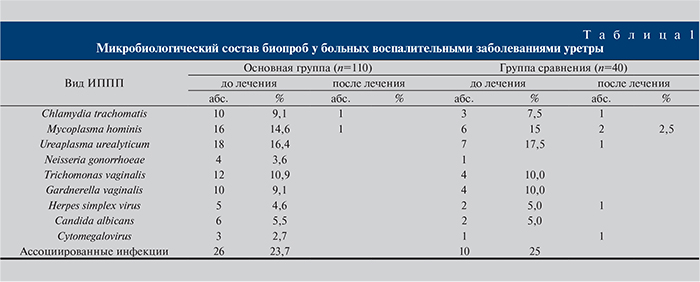
В обеих группах наиболее часто встречались ассоциированные инфекции, несколько реже – уреаплазменная, микоплазменная, гарднереллезная и хламидийная.
После проведенного лечения в основной группе определены по 1 случаю хламидийной и микоплазменной инфекций. Этиологическое излечение составило 98,2%. В группе сравнения определены по 1 случаю хламидийной, уреаплазменной, герпесвирусной и цитомегаловирусной инфекций и 2 случая микоплазменной инфекции. Этиологическое излечение составило 85,0% при р≤0,05 (табл. 1).
Нормальное содержание лейкоцитов в мазке уретры до начала лечения в основной группе наблюдалось у 66 (60,1%) больных, в группе сравнения – у 24 (60%). Десять–пятнадцать лейкоцитов в поле зрения в основной группе выявлено у 17 (15,5%) больных, в группе сравнения – у 7 (17,5%), 15–20 в поле зрения – у 12 (10,8%) и 3 (7,5%), 20–25 – у 11 (10%) и 5 (12,5%) и более 25 в поле зрения – у 4 (3,6%) и у 1 больного соответственно. По окончании лечения нормальное количество лейкоцитов в основной группе констатировали в 109 (99,2%) наблюдениях, 15–20 в поле зрения – у 1 больного. В то же время в группе сравнения нормальное содержание лейкоцитов в поле зрения определено у 30 (75%) больных, 10–15 – у 4 (10%), 15–20 – у 2 (5%), 20–25 – у 3 (7,5%) и более 25 – у 1. В целом доля пациентов с нормальным количеством лейкоцитов в мазках из уретры после лечения в основной группе выросла на 39,1%, в группе сравнения – на 15% (р≤0,05).
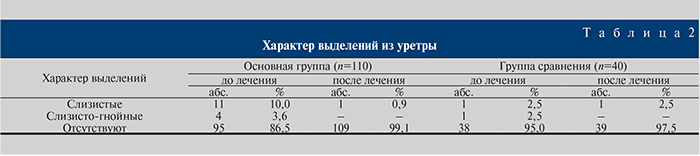
Как видно из табл. 2, в подавляющем большинстве случаев исходно выделения из уретры отсутствовали. Обращает на себя внимание то, что ни в одном случае не было гнойных выделений. После лечения отсутствие выделений констатировали у 109 (99,2%) больных основной группы и у 39 (97,5%) группы сравнения при р≤0,05). По этому параметру эффективность лечения в основной группе оказалась выше, чем в группе сравнения.
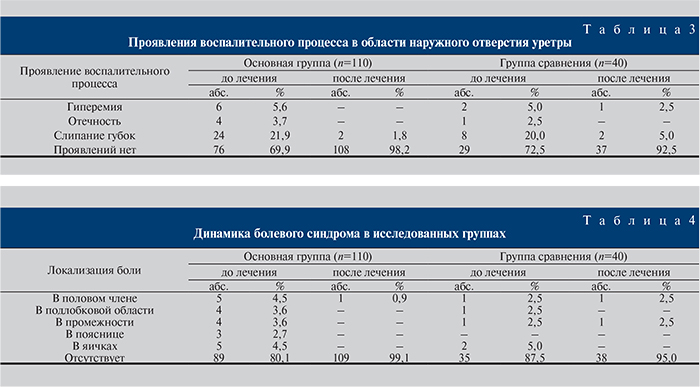
Обращали внимание на наличие и характер воспалительного процесса в области наружного отверстия уретры (табл. 3). Оказалось, что в 76 (69,2%) и 29 (72,5%) наблюдениях основной группы и группы сравнения соответственно клинических проявлений не было. У остальных больных отмечали гиперемию, отечность, слипание губок уретры (табл. 3). После лечения проявления отсутствовали в 108 (98,2%) и 37 (92,5%) случаях (р≤0,05).
В ходе изучения болевого синдрома при хронических уретритах установлено следующее. Жалобы на боли не предъявили 89 пациентов основной группы (80,1%) и 35 пациентов (87,5%) группы сравнения (табл. 4). При наличии жалоб пациенты указывали на боль в половом члене и в яичках, в подлобковой области и в промежности, в единичных случаях в основной группе – на боли в поясничной области (см. табл. 4). По окончании лечения только у 1 пациента основной группы сохранялась боль в половом члене, в группе сравнения по 1 больному отметили боли в половом члене и в промежности.
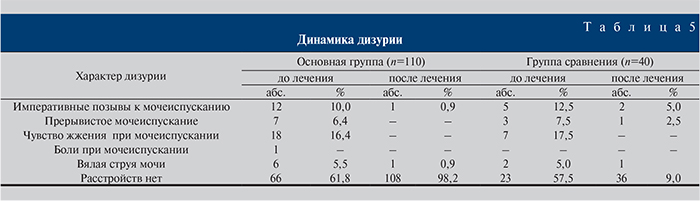
Больные обеих групп предъявляли жалобы на различные нарушения акта мочеиспускания (табл. 5). Следует отметить, что более чем в половине случаев жалобы отсутствовали: в основной группе – у 66 (61,8%), в группе сравнения – у 23 (57,5%). Чаще всего пациенты жаловались на чувство жжения во время мочеиспускания (табл. 5). После лечения отсутствие дизурии в основной группе констатировали в 108 (98,2%) наблюдениях, в группе сравнения – в 36 (90%) при р≤0,05.
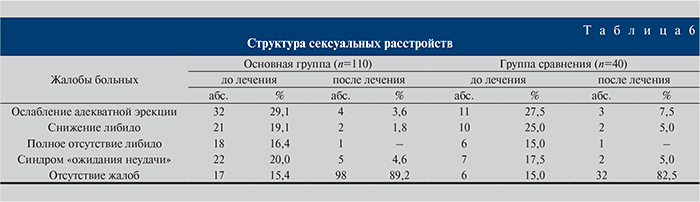
Данные о встречаемости жалоб на сексуальные расстройства представлены в табл. 6. Необходимо отметить, что только у 17 (15,4%) пациентов основной группы и у 6 – группы сравнения(15,0%) отсутствовали жалобы на сексуальные расстройства, т.е. в подавляющем большинстве случаев, а именно в 84,6 и 85% наблюдений соответственно, воспалительные заболевания мочеполовой сферы сопровождались различными видами сексуальных расстройств. После лечения улучшение отмечено в обеих группах, но в основной группе оно оказалось более значимым (табл. 6). В целом сексуальная функция восстановилась у 81% пациентов основной группы и у 67,5% – группы сравнения при р≤0,05.
После анкетирования 138 больных уретритами оказалось, что 56% больных испытывают трудности в сексуальной жизни. Только в 5% случаев врач задавал вопрос об их сексуальной функции, хотя пациенты считают, что врач должен обсуждать с ними эту проблему и ожидают от врача подобной инициативы.
Опрос мужчин, обращающихся к врачу, показал: 82% больных считают, что сексуальные расстройства не воспринимаются врачом как медицинская проблема, 71% мужчин боятся, что эта тема может смутить врача, 64% пациентов не решаются спросить о сексуальных расстройствах из-за сильного смущения. В то же время 78% пациентов хотели бы обсуждать вопросы своей сексуальной жизни и ожидают от врача подобной инициативы.
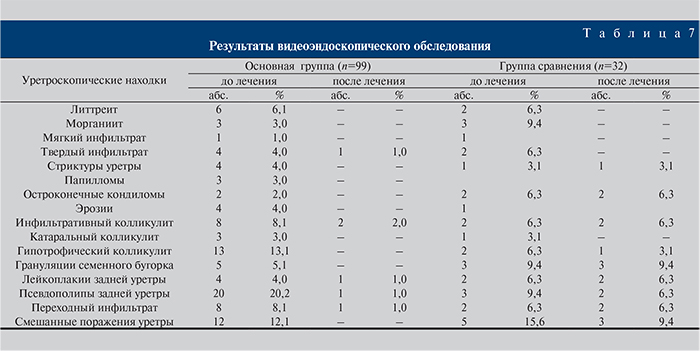
После первичного обследования больных обеих групп было проведено цифровое видеоэндоскопическое исследование слизистой оболочки уретры, результаты которой представлены в табл. 7. При этом различные патологические состояния уретры выявлены у 99 из 110 пациентов основной группы, что составило 83,3%, и у 32 (80 %) из 40 больных группы сравнения; смешанные поражения уретры диагностировали в основной группе в 12 (12,1%) случаях, в группе сравнения – в 5 (15,6%).
Через 4 недели после лечения была проведена повторная уретроскопия. Полное нивелирование патологического процесса в основной группе наступило у 93 (94%) из 99 пациентов, в то время как в группе сравнения – лишь у 14 (43,7%) из 32. Состояние слизистой оболочки больных основной группы оценивалось в 19,5±0,2 балла как «удовлетворительное», группы сравнения в 21,3±0,4 балла также как «удовлетворительное» при р≤0,05.
Через 6 недель после окончания лечения в основной группе состояние значительно улучшилось и соответствовало 39,5±0,1 балла («хорошее»), а в группе сравнения осталось примерно на том же уровне – 24,2±0,6 балла («удовлетворительное»; p=0,05).
Выводы
- Эффективность этиологического излечения в основной группе, где проводилось комплексное лечение с использованием препарата Мирамистин®, была выше на 13,2%, составив 98,2% против 85,0% в группе сравнения.
- Эффективность патогенетического излечения в основной группе составила 94%, что на 50,3% выше, чем в группе сравнения (43,7%).
- Полученные данные свидетельствуют об эффективности использования препарата Мирамистин® в комплексном лечении уретритов, ассоциированных с ИППП, что позволяет рекомендовать его применение в практическом здравоохранении.



