Введение. Стентирование мочеточника широко используется для дренирования почек у онкологических пациентов. Причинами нарушения оттока мочи из почек и верхних мочевыводящих путей (ВМП) могут являться сдавление или прорастание мочеточника опухолью увеличенными пакетами лимфатических узлов или рубцовыми тканями после перенесенной лучевой терапии, а также в результате развития забрюшинного или тазового фиброза после химиотерапии. Нарушение оттока мочи в половине случаев носит билатеральный характер. Для данной категории пациентов установка нефростомического дренажа не оптимальна с позиции как качества жизни, так и последующего лечения основного заболевания [1, 2].
 К преимуществам внутреннего дренирования почек, которые позволили широко использовать метод как для профилактики, так и для ликвидации суправезикальной обструкции, относятся относительная простота установки внутреннего стента и возможность длительного поддержания адекватного пассажа мочи по ВМП без контакта катетера с внешней средой [1].
К преимуществам внутреннего дренирования почек, которые позволили широко использовать метод как для профилактики, так и для ликвидации суправезикальной обструкции, относятся относительная простота установки внутреннего стента и возможность длительного поддержания адекватного пассажа мочи по ВМП без контакта катетера с внешней средой [1].
К недостаткам внутреннего дренирования относятся трудности, связанные с контролем функции дренажа, возможность развития инфекционно-воспалительных осложнений (пузырно-мочеточниковый рефлюкс, обструктивный пиелонефрит), а также выраженные в различной степени нарушения мочеиспускания (дизурия, странгурия, поллакиурия, боли в надлобковой области) – так называемые стентзависимые симптомы. Одной из основных причин развития вышеуказанных симптомов является гиперактивность детрузора, обусловленная дистальным («пузырным») завитком внутреннего стента. Поскольку нередко внутреннее дренирование ВМП онкологическим пациентам проводится в течение длительного времени, обеспечение надлежащего качества жизни данной категории пациентов остается одной из актуальных проблем современной урологии [1].
Проблемы, связанные со стентзависимыми симптомами, изучались и ранее, в том числе и отечественными урологами. Были разработаны международные анкеты-опросники, позволившие оценить степень выраженности симптомов нижних мочевыводящих путей (СНМП), связанных с наличием внутреннего стента, которые были модернизированы и адаптированы для удобства применения в клинической практике [2–9].
Большое значение в снижении степени выраженности стентзависимых симптомов имеют правильный выбор длины стента и адекватное расположение его дистального завитка в мочевом пузыре [3, 7]. Было установлено, что назначение α-адреноблокаторов и м-холиноблокаторов позволяет влиять на различные СНМП, значительно уменьшая их проявления при непродолжительном нахождении внутреннего стента в ВМП [3, 6, 8]. Однако онкологические больные представляют собой особую группу, у которых внутренние стенты находятся в ВМП длительное время, и выбор терапии, например, из группы м-холиноблокаторов, по нашему мнению, должен учитывать профиль безопасности данной группы лекарств. Частота и выраженность основных побочных реакций при применении м-холиноблокаторов, которые могут включать сухость во рту, тахикардию, запор и бессонницу, могут быть обусловлены степенью их селективности [8]. Кроме того, стенты последнего поколения и так называемые онкологические стенты для длительного нахождения в ВМП значительно отличаются от обычных стентов в первую очередь новым и нередко более жестким материалом, из которого они сделаны (для противостояния внешнему сдавлению) и рядом других конструктивных особенностей, что, несомненно, может влиять на выраженность стентзависимых симптомов. Однако в доступной нам литературе каких-либо сведений по этому вопросу найти не удалось.
Внедрение в клиническую практику и последующее широкое использование стентов из новых материалов и специальных длительностоящих онкологических стентов, а также солифенацина (5 и 10 мг) для терапии гиперактивного мочевого пузыря послужило поводом для проведения исследования, целью которого стала оптимизация терапии стентзависимых симптомов у онкологических пациентов с наличием внутреннего стента с длительным сроком стояния. Учтя особенности онкологических пациентов, мы применили солифенацин в дозе 5 мг.
Материалы и методы. С ноября 2013 по ноябрь 2015 г. в отделении малоинвазивной урологии ГКБ № 57 ДЗ Москвы и в отделении урологии ММЦ Банка России плановое стентирование ВМП выполнено 68 онкологическим пациентам (26 мужчин, 42 женщины, возраст – 36–79 лет). Для всех пациентов причиной обструкции мочевыводящих путей были онкоурологические (24), онкогинекологические (26) и онкопроктологические (18) заболевания. Всем пациентам до решения вопроса о дренировании мочевых путей проведена либо лучевая, либо химиотерапия, 28 (41,2%) пациентам – оперативное лечение, но при поступлении в отделение всем пациентам радикальное оперативное лечение по тем или иным причинам было противопоказано.
С учетом характера обструкции, необходимости проведения повторных курсов химиотерапии или лучевой терапии, а для 10 пациентов – невысокой (менее 1 года) продолжительности предстоящей жизни в связи с наличием отдаленных метастазов наиболее перспективным оказалась установка стентов с длительным сроком стояния. Двадцати восьми пациентам были установлены специальные онкологические стенты Superglide Tumour DD («Rüsch», Германия) с открытым или закрытым концом диаметром 6–7 Fr, со сроком стояния до 12 мес. Данные стенты изготовлены из новой формы полиуретана (wirutan), имеют гидрогелевое покрытие (значительно облегчающее его установку и обладающее противоинкрустирующим эффектом) и внутреннюю армированную обмотку прямой части, которая препятствует внешнему сдавлению и перегибу стента (рис. 1). Остальным 40 пациентам были установлены внутренние стенты Superglide длительного стояния (до 6 мес) той же фирмы и из того же материала, но не имеющие армированной обмотки прямой части, т.е. у всех 68 пациентов пузырные завитки внутренних стентов были представлены одним и тем же материалом с гидрогелевым покрытием.
Все пациенты были разделены на две группы. Пациенты 1-й группы (n=32) получали стандартную терапию (норфлоксацин 400 мг 2 раза в сутки 10 дней, далее растительные уроантисептики, спазмолитики и анальгетики по показаниям) в сочетании с препаратом солифенацин 5 мг/сут (Везикар®, Астеллас, Нидерланды). Во 2-й группе (n=36) в течение всего времени стояния стента пациенты получали только стандартную терапию. Специальные онкологические стенты Superglide Tumour DD были установлены 12 пациентам 1-й группы и 16 – 2-й. Осуществляли также регистрацию нежелательных явлений, связанных с приемом препаратов. Дизайн исследования представлен на рис. 2.
Технические особенности внутреннего дренирования онкологическим больным
Внутреннее дренирование ВМП онкологическим пациентам, когда имеется внешнее сдавление и смещение мочеточника, прорастание его опухолью или лучевое сужение его просвета, – задача очень непростая, нередко требующая большого опыта рентгеноэндоскопической хирургии и серьезного технического оснащения.
Операция стентирования ВМП 52 (76,5%) пациентам выполнена с использованием трансуретрального доступа, 12 (17,6%) – с помощью перкутанного доступа и еще 4 (5,9%) – с помощью комбинированного доступа в положении пациента на спине. Перкутанный и комбинированный доступы применяли при невозможности (неудаче) стентирования через трансуретральный доступ. С левой стороны дренирование произведено 28 пациентам, справа – 22 и билатеральное – 18. До стентирования 39 (57,3%) пациентов имели предварительно установленный нефростомический дренаж диаметром 8–14 Fr с одной или с двух сторон, при этом у 13 больных он был установлен нами интраоперационно во время стентирования.
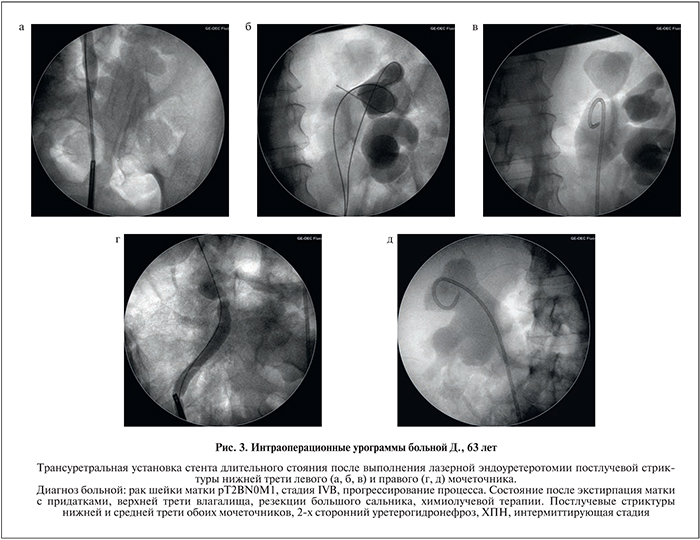
Среди 52 онкологических больных, которым выполнено трансуретральное стентирование, только 22 (42,3%) пациентам его удалось выполнить по стандартной методике – в цистоскопическом положении больного путем катетеризации устья мочеточника с использованием ригидного цистоскопа под рентгенотелевизионным контролем. Во всех остальных наблюдениях пришлось прибегать к различным рентгенинтервенционным методикам с применением селективных ангиографических катетеров (рентгенпозитивные катетеры-направители с изогнутым дистальным концом различных диаметров типа ангиографического катетера «кобра») и сверхскользких проводников, трансуретральную ригидную или гибкую уретероскопию, бужирование (10 больных), баллонную дилатацию (3) и гольмиевую лазерную эндоуретеротомию (12) (рис. 3). Мочеточниковое устье 5 пациентов было найдено только после «поисковой» трансуретральной резекции мочевого пузыря.
Двенадцати пациентам внутренний стент удалось установить только с использованием антеградного доступа, так как первоначально при цистоскопии устье мочеточника определить не удалось (преимущественно пациенты после лучевой терапии). При этом для антеградного проведения струны-проводника в мочевой пузырь также требовались как рентгенпозитивные катетеры-направители с изогнутым дистальным концом различных диаметров, так и фиброуретеропиелоскопы диаметром 7–9 Fr. Помимо этого в ряде случаев требовались и сверхскользкие проводники.
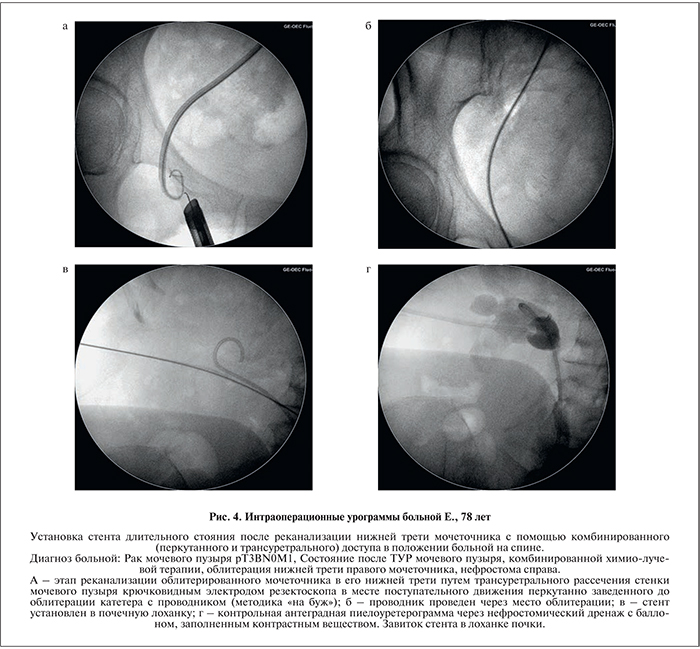
Четырем больным для установки стента пришлось выполнить реканализацию мочеточника из комбинированного доступа в положении больного на спине: 2 пациентам выполнена реканализация в нижней трети мочеточника, 1 – в средней и 1 – в верхней третях мочеточника. Реканализации выполняли по методике «на буж» или «на свет» (рис. 4) [10].
Правильность стояния стента определяли на основании данных рентгенологического и ультразвукового обследования.
Критерии исключения из исследования: гибель пациента вследствие прогрессирования основного заболевания (10 пациентов), неправильный выбор длины стента (слишком короткий, слишком длинный, 5 пациентов), неправильная его установка (отсутствие полностью сформированного дистального или проксимального завитка, 1 пациент), неадекватное его функционирование (пиелоэктазия, 2 пациента), выраженная инфекция мочевыводящих путей (бактериурия выше 105 КОЕ в 1 мл, 2 пациента).
Контрольные осмотры (в среднем 1 раз в 3 мес) после установки стента, которые пациенты проходили в амбулаторном порядке, включали УЗИ, контроль лабораторных данных и обзорную урографию (при подозрении на миграцию или инкрустацию стента) по показаниям, а также заполнение специального опросника и визуальной аналоговой шкалы симптомов. В сроки через 3 мес после стентирования удалось обследовать 63 (92,6%) пациента (30 пациентов 1-й группы, 33 – 2-й), через 6 – 62 (соответственно 30 и 32 пациента), через 9 – 55 (28 и 27) и через 12 мес – 48 (70,6%) (26 и 22). Сменить стент по тем или иным причинам через 3 мес пришлось 7 пациентам (1-я группа –2 пациента и 2-я – 5), через 6 – 4 (соответственно 2 и 2 пациента), через 9 мес – еще 5 (2, 3).
Через год с момента установки стента всем 48 пациентам проведена цистоскопия и смена внутреннего стента, причем у 30 (62,5%) из них стенты простояли in situ все 12 мес.
За время наблюдения 12 (17,6%) из 68 пациентов (5 – из 1-й группы и 7 – из 2-й) перед сменой стента была произведена дистанционная, перкутанная или трансуретральная литотрипсия в связи с инкрустацией завитков стента, причем подобные вмешательства всем больным были проведены после не менее чем 6-месячного стояния стента в ВМП (2 – после 6 мес, 7 – после 9 и 3 – после 12 мес). Специальные онкологические стенты Superglide Tumour DD оказались инкрустированы у 1 больного 1-й группы и у 2 – 2-й.
Оценка стентзависимых симптомов у онкологических больных
С целью объективизации степени выраженности симптомов, возникающих у онкологических пациентов при наличии внутреннего мочеточникового стента, мы провели анкетирование 68 пациентов с помощью специальной анкеты-опросника, разработанной нами в 1998 г. совместно с С. С. Зенковым [1] и незначительно адаптированной к дизайну исследования [3, 4]. Больным предлагалось ответить на ряд вопросов, характеризующих интенсивность симптоматики, обусловленной наличием внутреннего стента. Выраженность симптоматики оценивалась самими пациентами по четырехбалльной шкале (0 – нет симптомов, 1 – незначительные, 2 – умеренные, 3 – выраженные симптомы) и фиксировалась ими в специальной анкете. Оценивали наличие и степень выраженности следующих симптомов: боли в области мочевого пузыря, боли в области почки в покое и после мочеиспускания, дневная и ночная поллакиурия, наличие ургентных позывов на мочеиспускание. Анкета заполнялась через 3, 6, 9 и 12 мес после установки стента. Мы оценивали только симптомы, связанные с мочеиспусканием, и не оценивали, например, частоту гематурии. Мы также не предлагали пациентам оценивать влияние стента на степень выраженности затруднений в быту, на работе и в половой жизни, так как все пациенты имели инвалидность вследствие основного заболевания и не вели половую жизнь. Таким образом, при максимально выраженной симптоматике пациент набирал максимальную сумму в 18 баллов, в отсутствие симптомов – 0 баллов.
Оценка качества жизни при наличии внутреннего стента
Для субъективной оценки состояния своего организма пациенты во время лечения заполняли визуальную аналоговую шкалу (ВАШ), которая представляет собой 100-миллиметровую горизонтальную шкалу от 0 (плохое состояние) до 100 (хорошее состояние). Визуальная аналоговая шкала заполнялась при проведении контрольных обследований спустя 3, 6, 9 и 12 мес после установки стента.
Статистическая обработка результатов
Первичной конечной точкой исследования стало снижение суммы баллов по анкете оценки стентзависимой симптоматики в течение лечения и повышение показателя самочувствия по ВАШ в процессе лечения. Вторичной конечной точкой исследования являлась оценка выраженности инкрустации стента в обеих группах, а также оценка нежелательных явлений, связанных с постоянным длительным приемом солифенацина 5 мг. Анализ литературы и внутренний аудит полученных данных позволили считать, что 30%-ное различие в сумме баллов по анкете может быть принято как значимое улучшение.
С учетом малого объема выборки (n<30) для оценки межгрупповых различий использовали критерий Фишера. Статистически значимым считали различие при р<0,05.
Результаты. Через год исследование смогли завершить только 48 пациентов (26 больных 1-й группы и 22 – 2-й). Как видно из табл. 1, статистически значимо более низкий балл степени выраженности стентзависимых симптомов на всех контрольных визитах и лучшие показатели ВАШ с 6-го по 12-й месяц имели место у пациентов 1-й группы.
При анализе ответов на вопросы анкеты было выявлено, что наибольшие различия (1–2 балла) происходят при ответе на вопросы, которые затрагивают наличие ургентных позывов на мочеиспускание и частоту мочеиспусканий. В период с 9-го по 12-й месяц отличия также были получены и при ответе на вопрос, который касался болевого синдрома в области мочевого пузыря.
При анализе частоты инкрустации стента спустя 12 мес с момента его установки во 2-й группе данное осложнение было выявлено статистически недостоверно чаще, чем среди пациентов 1-й группы (5 против 7 больных).
Профиль безопасности солифенацина 5 мг в целом соответствовал определенному ранее: нами не было отмечено развития серьезных нежелательных явлений, которые могли бы быть связанными с приемом препарата, также не было выявлено случаев отмены препарата пациентами вследствие развития нежелательных явлений (табл. 2).
Ни в одном наблюдении препарат не был отменен – спустя 2–3 нед у пациентов было отмечено исчезновение вышеуказанных жалоб. Пациенту с острой задержкой мочи потребовалась установка уретрального катетера на двое суток с последующим восстановлением самостоятельного мочеиспускания.
Обсуждение. Проблема лечения окклюзии ВМП у онкологических пациентов весьма актуальна в урологии. К важным аспектам данной проблемы относятся: 1) адекватное дренирование для профилактики гибели паренхимы почек; 2) обеспечение должного качества жизни, особенно для пациентов с билатеральным поражением ВМП; 3) возможность продолжения онкологического лечения (хирургическое лечение, лучевая, химиотерапия, таргетная терапия); 4) доступность проведения контрольного обследования и его адекватность; 5) длительность дренирования; 6) стоимость дренирования. В настоящее время не разработан способ деривации мочи, который бы удовлетворял всем вышеперечисленным требованиям, однако установка длительностоящих онкологических мочеточниковых стентов представляется оптимальным методом.

Проблема эта мультидисциплинарная, так как лечение основного заболевания в нашей стране обычно осуществляется врачом-онкологом, а деривация мочи – врачами-урологами. Контроль за внутренними дренажами в онкологических учреждениях в отсутствие симптоматики обычно не проводится, поэтому для обеспечения непрерывности онкологического лечения предпочтение в дренировании мочевыводящих путей данной категории пациентов следует отдавать дренажам с возможностью длительного (более 3 мес) стояния.
Симптомы, связанные с наличием стента (стентзависимые симптомы), включают ирритативную симптоматику со стороны нижних мочевых путей (боли в надлобковой области, позывы на мочеиспускание, учащенное мочеиспускание, ночная поллакиурия), боли в поясничной области, пузырно-мочеточниковый рефлюкс, обострение инфекционно-воспалительных заболеваний мочеполовой системы (пиелонефрит, цистит, простатит, орхоэпидидимит), гематурию и др. [1–9]. Клиническую картину затрудняет наличие у пациентов основного онкологического заболевания, нередко с отдаленными метастазами либо последствиями лучевой и химиотерапии, когда болевой синдром помимо суправезикальной обструкции может быть связан с нарушением иннервации и кровообращения внутренних органов. В отличие от пациентов, которым, например, внутренний стент установлен по поводу мочекаменной болезни, все внимание и забота онкологических больных в основном направлены на лечение главного заболевания и установка им стандартных внутренних стентов с короткими сроками стояния (1–3 мес) не вызывает у них энтузиазма, а нередко и усугубляет имеющуюся депрессию и ощущение тревоги в связи со сложившейся ситуацией. Установка таким больным наружных дренажей нередко является первым фактором развития у них полной социальной дезадаптации, когда пациенты под предлогом бережного отношения к дренажу отказываются выходить на улицу, посещать общественные места, вставать с кровати, принимать душ и т.д.
Традиционно для терапии стентзависимых симптомов применяется противовоспалительная, спазмолитическая и анальгетическая терапия. В течение последних лет был успешно разработан и внедрен алгоритм применения α-адреноблокаторов и м-холиноблокаторов для терапии стентзависимых симптомов [3, 6–8]. До последнего времени мы использовали данные препараты только в отношении пациентов с неонкологическими причинами стентирования ВМП (стриктуры ВМП, мочекаменная болезнь). Посольку онкологическим пациентам стенты устанавливаются обычно на длительное время, для улучшения качества их жизни мы использовали препарат солифенацин 5 мг в сутки. В нашем исследовании пациенты принимали его постоянно в течение года. Выбор солифенацина был обусловлен сочетанием селективного действия препарата на м3-холинорецепторы и отсутствия негативного влияния на моторику кишечника, частоты сердечных сокращений, качества сна и функции детрузора.

По данным наших исследований, правильное расположение внутреннего стента является одним из ведущих факторов профилактики развития стентзависимых симптомов. При правильном расположении стента оба завитка должны быть полностью сформированы в лоханке (чашечке) почки и в мочевом пузыре, а пузырный завиток не должен пересекать срединную линию пациента на обзорной урограмме. Инкрустация стента также является серьезным предрасполагающим фактором развития стентзависимых симптомов [9]. В связи с этим длительностоящие стенты с антиинкрустационным гидрогелевым покрытием, а также специальные онкологические стенты оптимальны для их применения данной категорией пациентов.
Ограничением данного исследования является трудность отбора двух групп однородных пациентов, так как клиническая картина основного заболевания была различной, как и причины, приведшие к обструкции ВМП. Пациенты имели разное функциональное состояние почек и мочевого пузыря (детрузора), различную выраженность болевого синдрома, ожидаемую продолжительность жизни и др. Дизайн исследования был спланирован так, чтобы эти факторы не влияли на интерпретацию результатов исследования, поэтому мы производили оценку только симптомов, связанных с мочеиспусканием, и не оценивали, например, частоту гематурии. При оценке показателей ВАШ пациентов просили указывать только интегральную оценку качества мочеиспускания, чтобы избежать погрешностей, связанных с наличием основного заболевания, и его влияния на качество жизни. Данные табл. 1 убедительно свидетельствуют об улучшении качества мочеиспускания онкологических больных с внутренними стентами на фоне приема солифенацина 5 мг (снижение суммарного показателя качества мочеиспускания с 13,4±1,1 балла у больных без м-холинолитика до 10,1±0,9 балла с м-холинолитиком). Выявленная динамика была стабильной в течение всего периода наблюдения, различия носили статистически значимый характер с учетом вышеуказанных ограничений исследования. По нашему мнению, механизмом улучшения симптомов мочеиспускания на фоне приема солифенацина 5 мг/сут является снижение частоты мочеиспусканий днем и ночью, а также устранение ургентных позывов на мочеиспускание днем и ночью. Влияние препарата на болевой компонент не отмечали.
Профиль безопасности солифенацина 5 мг/сут в течение года в целом соответствовал описанному ранее в исследованиях по изучению его эффективности в терапии гиперактивного мочевого пузыря [6–8]. Не было выявлено серьезных нежелательных явлений, которые бы были связаны с приемом препарата или потребовали бы его отмены. В одном наблюдении была отмечена острая задержка мочи, что потребовало дренирования мочевого пузыря уретральным катетером, однако у данного пациента задержка мочи могла быть обусловлена наличием сопутствующей гиперплазии предстательной железы. После удаления катетера было достигнуто адекватное самостоятельное мочеиспускание без наличия остаточной мочи. В остальных наблюдениях нежелательные явления отмечались только в начале лечения, носили непродолжительный характер и не требовали коррекции проводимого лечения или отмены препарата.
Заключение. Установка внутреннего стента в ВМП онкологическим больным требует наличия специального оборудования и соответствующего опыта проведения рентгенэндоскопических операций из трансуретрального и перкутанного доступов. В большинстве случаев для профилактики и ликвидации суправезикальной обструкции, вызванной онкологическим процессом различной этиологии и локализации, целесообразно применять специальные внутренние стенты с возможностью длительного нахождения в ВМП. Применение солифенацина 5 мг/сут онкологическими больными с наличием внутреннего стента позволяет практически на 20% снизить выраженность ирритативных симптомов, связанных с наличием стента, и улучшить качество жизни этой очень непростой категории больных.



