Введение. Нейрогенный мочевой пузырь (НМП) может быть проявлением любого заболевания или повреждения нервной системы. Так, при рассеянном склерозе (РС) около 75% больных имеют нарушения мочеиспускания [1], проявляющиеся ургентностью и недержанием мочи (50%), обструктивной симптоматикой и задержкой мочи (25%) или их сочетанием (25%).
Оценка урологического статуса пациентов с нейрогенной дисфункцией нижних мочевыводящих путей (НДНМВП) должна быть комплексной и включать сбор жалоб и анамнеза, физикальный осмотр, анализы крови и мочи, ультразвуковые, рентгенологические, уродинамические и эндоскопические методы исследования. Для объективизации и детализации жалоб больного с нарушениями мочеиспускания в урологической практике традиционно применяются дневник мочеиспускания и различные анкеты-опросники, которые пациент заполняет самостоятельно [2].
Использование неспецифических для НДНМВП опросников, таких как Международная шкала симптомов предстательной железы (IPSS) или Шкала оценки выраженности ургентности мочеиспускания (PPIUS), пациентами с нейрогенными нарушениями мочеиспускания затруднено в связи с тем, что варианты дисфункции мочевыводящих путей могут быть различными, часто отсутствуют чувствительность и самостоятельное мочеиспускание, пациент может иметь цистостому, кишечный резервуар, находиться на периодической катетеризации или прибегать к специальным приемам для опорожнения мочевого пузыря. Кроме того, НМП приводит к тяжелым осложнениям. Все это должно быть учтено в вопросах анкеты.
Русскоязычного опросника, который был бы специально создан для больных НМП и позволял бы комплексно оценивать функцию мочевого пузыря и возможные осложнения, в настоящее время нет. В мировой практике в последние годы широко используется Шкала симптомов нейрогенного мочевого пузыря (The Neurogenic Bladder Symptom Score – NBSS), позволяющая оценивать выраженность симптомов независимо от характера нейрогенной дисфункции и наличия или отсутствия самостоятельного мочеиспускания. Анкета состоит из вопроса о способе отведения мочи (A – цистостома или постоянный катетер, B – уропрезерватив, С – периодическая катетеризация, D – самостоятельное мочеиспускание), 22 вопросов, объединенных в 3 домена (недержание, накопление/опорожнение и осложнения) и одного дополнительного вопроса о качестве жизни.
Шкала симптомов нейрогенного мочевого пузыря разработана B. Welk et al. в 2014 г. для пациентов с НМП [3]. Первичная оценка валидности и надежности опросника проведена на когорте из 230 пациентов (35% после позвоночно-спинномозговой травмы, 59% с РС, 6% с врожденным НМП). Шкала показала высокую внутреннюю согласованность (α Кронбаха – 0,89) и надежность (коэффициент межклассовой корреляции [ICC] – 0,91). Внешняя валидность подтверждена высокой корреляцией с результатами других опросников. Пациенты, посещавшие уролога ранее, имели достоверно большее значение NBSS (22,1), чем те, кто к урологу не обращался (17,1). Последующие исследования на группе из 609 больных НМП доказали высокую валидность и надежность NBSS [4]. Авторы также продемонстрировали, что как шкала NBSS в целом, так и ее домены чувствительны к изменению клинической картины заболевания и могут быть использованы для оценки эффективности проведенного лечения [5].
E. Fragala et al. [6] продемонстрировали, что сумма баллов NBSS ≥20 ассоциирована с более высоким давлением в момент гиперактивности детрузора при цистометрии наполнения (≥20 см водн.ст.), меньшей цистометрической емкостью (<212 мл) и более низким комплаенсом мочевого пузыря (≤3 мл/см водн.ст.).
Цель исследования: перевод шкалы симптомов нейрогенного мочевого пузыря (NBSS) на русский язык с последующей оценкой валидности и надежности русскоязычной версии.
Материалы и методы. С разрешения разработчиков (В. Welk et al.) опросник NBSS был переведен на русский язык в соответствии с алгоритмом языковой и культурной адаптации.
На первом этапе профессиональный переводчик, носитель русского языка, перевел оригинальную англоязычную версию опросника NBSS на русский язык. Затем группа из 5 урологов, владеющих английским языком, изучила перевод, чтобы определить его точность, достоверность содержания и эквивалентность английской версии. После этого носителем американского английского языка, владеющим русским языком, был осуществлен обратный перевод русскоязычной версии на английский язык. Переводчики, принимавшие участие в этой работе, согласились, что оригинальный текст и русскоязычная версия обратно переводимы и эквивалентны. Окончательная версия перевода была выдана участникам исследования.
В исследовании участвовали 80 человек в возрасте 18–61 года (37,7±10,7 года), 60% мужчин и 40% женщин. Группу A составили 40 больных НМП на фоне РС, группу Б – 20 больных РС без расстройств мочеиспускания и группу В – 20 условно здоровых добровольцев. Среди больных РС 67% имели ремиттирующее, 31% – вторично прогрессирующее и 2% – первично прогрессирующее течение заболевания. Респонденты дважды с интервалом 2 нед. отвечали на вопросы NBSS, а также заполняли анкету IPSS и опросник для оценки симптомов гиперактивного мочевого пузыря (OABA wareness Tool). Для анализа качества жизни больных РС использовали русскоязычную версию краткого опросника ВОЗ WHOQOLBREF. Врачи-неврологи проводили осмотр больных и давали количественную оценку инвалидизации пациентов по расширенной шкале нарушений жизнедеятельности Куртцке (EDSS), которая в среднем составила 3,72±1,98.



Статистический анализ результатов исследования осуществляли при помощи программы SPSS 22.0 с использованием методов параметрической и непараметрической статистики. Внутреннюю согласованность опросника NBSS оценивали путем расчета коэффициента α Кронбаха, при этом очень хорошим считалось значение более 0,9, хорошим – более 0,8, достаточным – более 0,7, сомнительным – более 0,6. Надежность оценивали с помощью коэффициента межклассовой корреляции (ICC). Ретестовая надежность говорит о воспроизводимости результатов теста при повторных исследованиях на одних и тех же испытуемых. Внешняя валидность, т.е. согласованность результатов NBSS с данными других анкет, исследована с использованием коэффициента корреляции Пирсона.
Результаты. Русскоязычная версия шкалы NBSS представлена в табл. 1, алгоритм подсчета баллов по доменам – в табл. 2.

Средний суммарный балл NBSS в группе А составил 22,56±12,6, что достоверно (p<0,001) превысило значения показателя в группах Б (6,42±2,3) и В (5,31±1,9), которые статистически не различались. Аналогичные данные получены для доменов шкалы NBSS (табл. 3).
Коэффициент α Кронбаха в целом для опросника, а также по доменам «недержание», «накопление/опорожнение» и «осложнения» равнялся 0,939, 0,965, 0,801 и 0,712 соответственно, что указывает на высокую внутреннюю согласованность анкеты.

При повторном заполнении опросника не было выявлено значимых различий в результатах, коэффициенты межклассовой корреляции не превышали 0,82 как для суммы баллов NBSS, так и для значений по отдельным доменам.
Анкета продемонстрировала также высокую внешнюю валидность (табл. 4). Суммарный балл NBSS достоверно коррелировал со значениями IPSS, опросника гиперактивного мочевого пузыря, количеством мочеиспусканий за сутки и объемом мочи за одно мочеиспускание. Коэффициент корреляции Пирсона равнялся соответственно 0,797, 0,810, 0,842 и -0,685 (р<0,001).

Статистически значимые различия качества жизни между пациентами с нарушениями мочеиспускания и без них были отмечены для домена «физическое здоровье WHOQOL BREF» (U-критерий Манна–Уитни равнялся 44,5, p<0,001). Значения составили 13,93±1,2 и 11,89±1,6 соответственно. Коэффициенты корреляции Пирсона между суммарным баллом NBSS и качеством жизни больных РС равнялись -0,699 (p<0,001) для домена «физическое здоровье» -0,655 (p<0,001), для домена «психологическое здоровье» -0,437 (p<0,01) для домена «социальные взаимоотношения» и -0,638 (p<0,001) для домена «окружающая среда».
Сумма баллов по шкале EDSS в наибольшей степени коррелировала с общей удовлетворенностью состоянием здоровья и качеством жизни (r=-0,604, p<0,001), значениями домена «физическое здоровье» WHOQOL BREF (r=-0,486, p<0,01), качеством жизни по NBSS (r=0,601, p<0,001). Коэффициент корреляции между суммарным баллом NBSS и EDSS равнялся 0,533 (p<0,001).
Обсуждение. В англоязычной литературе описано более 30 различных опросников, используемых для оценки симптомов НМП и их влияния на качество жизни больных, самые известные представлены в табл. 5. Только несколько из них были созданы специально для больных НДНМВП [7]. Самым известный – опросник Qualiveen, разработанный P. Costa et al. [8] для изучения качества жизни, связанного с нарушениями микции, у пациентов, перенесших позвоночно-спинномозговую травму. Он содержит 30 вопросов, сформулированных на основании интервью с больными, экспертной оценки и предшествовавших исследований. Краткая форма этого опросника валидизирована также для больных РС и доступна на английском, французском, немецком и итальянском языках [9].
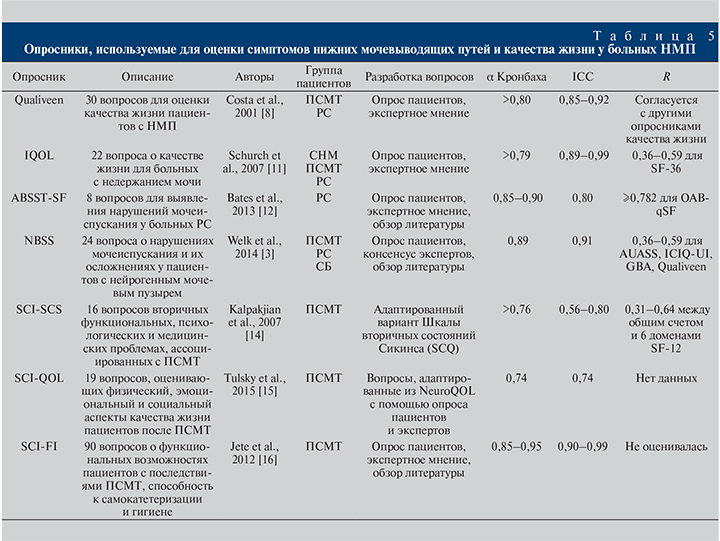
IQOL (Incontinence Quality of Life Questionnare – опросник качества жизни, связанного с недержанием мочи) был создан D. Patrick et al. для больных с недержанием мочи и гиперактивным мочевым пузырем [10]. Он состоит из 22 вопросов, разделенных на 3 блока: I – избегание и ограничивающие факторы, II – психосоциальное влияние, III – социальные трудности. Позже B. Schurch et al. валидизировали эту анкету для пациентов с недержанием мочи вследствие позвоночно-спинномозговой травмы [11].
Скрининговый опросник ABSST-SF (Actionable Bladder Symptom Screening Tool – практический инструмент скрининга симптомов мочевого пузыря) включает 8 вопросов и рекомендован как тест для больных РС, позволяющий определять, кто из пациентов нуждается в консультации уролога [12].
В последние годы стал широко использоваться опросник NBSS, который наиболее полно отражает все варианты нарушений акта мочеиспускания и их осложнения [2–5]. Универсальность анкеты NBSS позволяет использовать ее больными нейрогенным мочевым пузырем любой этиологии.
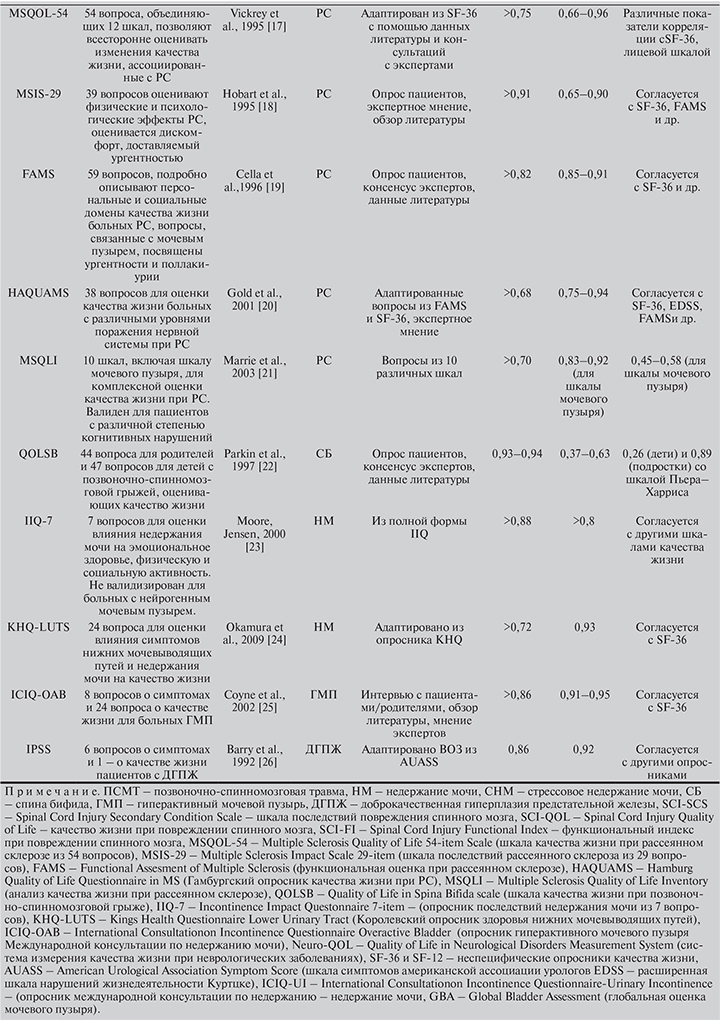
Остальные анкеты (см. табл. 5) разработаны для оценки симптомов неврологического заболевания в целом и не специфичны для НДНМВП, однако содержат вопросы, касающиеся работы мочевого пузыря. Это опросники SCI-SCS, SCI-QOL и SCI-FI для пациентов, получивших травму спинного мозга; MSQOL-54, MSIS-29, FAMS, HAQUAMS, MSQLI – для больных РС; QOLSB – для пациентов с последствиями спинномозговой грыжи.
Кроме того, для оценки нейрогенных нарушений мочеиспускания используются анкеты, не предназначенные для неврологических больных, такие как IIQ-7, KHQ-LUTS, ICIQ-OAB, а в отечественной практике – IPSS.
В обзорах [7, 13] продемонстрировано, что наиболее качественными опросниками, разработанными специально для пациентов с НДНМВП с соблюдением всех требований доказательной медицины, считаются Qualiveen и NBSS. Qualiveen – это в большей степени опросник качества жизни, посвященный страхам, ограничениям и ощущениям, связанным с функцией мочевого пузыря. Шкала NBSS подробно оценивает симптомы нейрогенной дисфункции и наличие осложнений НМП независимо от способа от ведения мочи.
При анализе валидности и надежности русскоязычной версии NBSS были получены значения коэффициента α Кронбаха и коэффициента межклассовой корреляции, сопоставимые со значениями, описанными для англоязычной версии NBSS при ее первичной и вторичной оценке [3, 4].
Заключение. Русскоязычная версия шкалы нейрогенного мочевого пузыря (NBSS) – валидный и надежный инструмент оценки симптомов НДНМВП у больных РС и может быть рекомендована к использованию в клинической практике.



