Введение. Мочекаменная болезнь (МКБ) по распространенности занимает 3-е место среди заболеваний мочевыделительной системы после инфекционных поражений и заболеваний предстательной железы [1, 2]; является одним из самых распространенных и частых заболеваний в мире (5–10%), встречается чаще всего у пациентов трудоспособного возраста [3]. В настоящее время формируется представление о микробиоме мочевыделительной системы в условиях МКБ и его значении в патогенезе осложнений нефролитиаза [4, 5]. Вместе с тем выживание возбудителей при контакте с эффекторами иммунитета во внутренней среде макроорганизма обеспечивает определенный набор патогенетически значимых свойств (факторы уропатогенности), среди которых ключевое место занимают персистентные характеристики [6]. Показано, что лидирующие позиции в структуре микрофлоры мочи, полученной из лоханки и мочевого пузыря у больных МКБ при хирургическом вмешательстве, занимают энтеробактерии (Escherichia coli, Klebsiella spр. и др.) и псевдомонады (в частности, Pseudomonas aeruginosa), обладающие выраженными персистентными свойствами [7, 8].
Нередко микроорганизмы, выделенные из мочи при МКБ, характеризуются полиантибиотикорезистентностью к широко применяемым в клинической практике антимикробным препаратам [9], что затрудняет терапию заболевания, в то время как эффективность лечения и прогноз болезни зависят от рациональности стартовой эмпирической антибактериальной терапии [10].
Поскольку биоразнообразие и распространенность микроорганизмов с повышенной резистентностью к тем или иным антимикробным препаратам могут быть различными и изменяться во времени в каждом конкретном стационаре, целесообразно изучение региональных особенностей видового состава микроорганизмов, выделенных из мочи при мочекаменной болезни, их биологических свойств и антибиотикорезистености.
Цель работы: охарактеризовать персистентные свойства и антибиотикорезистентность микроорганизмов, выделенных из мочи при оперативном лечении МКБ.
Материалы и методы. В исследование были включены 252 пациента в возрасте от 23 до 87 лет (средний возраст – 52 года), из них было 124 мужчины и 128 женщин. Больным было выполнено оперативное лечение по поводу камней почек и верхней трети мочеточников в урологическом отделении Оренбургской областной клинической больницы № 1. Конкременты из верхней трети мочеточника смещали в лоханку и удаляли методом чрескожной нефролитотрипсии и литоэкстракции. Все операции заканчивались установкой нефростомического дренажа с закрытой системой. В ходе оперативного вмешательства отбирали пробы мочи из почечной лоханки и мочевого пузыря для проведения бактериологического исследования. Пробы мочи доставляли в бактериологическую лабораторию в течение 1–2 ч.
Микроорганизмы выделяли в чистой культуре и идентифицировали до вида с использованием биохимических тест-систем Lachema («Erba Lachema s.r.o.», European Union).
Чувствительность микроорганизмов к антибактериальным препаратам определяли диско-диффузионным методом, согласно [11]. В работе использовали стандартные диски промышленного производства (ЗАО «Научно-исследовательский центр фармакотерапии», Санкт-Петербург) с антибиотиками, сгруппированными в четыре класса.
Для количественной характеристики антибиотикорезистентности был использован показатель MР – маркер резистентности, рассчитанный как отношение числа штаммов, резистентных к четырем и более антибиотикам, к общему числу штаммов [12].
Антилизоцимную активность (АЛА) микроорганизмов определяли фотометрическим методом [13], способность образовывать биопленки – по методике [14]. Рассчитывали коэффициент биопленкообразования (КБО), положительными считали значения ≥1,1.
Статистический анализ включал определение средних значений и среднеквадратичной ошибки Т-критерия Стьюдента.
Результаты. Частота обнаружения и выраженность изученных факторов персистенции представлены в табл. 1. Одним из факторов персистенции микроорганизмов является образование ими биопленок.
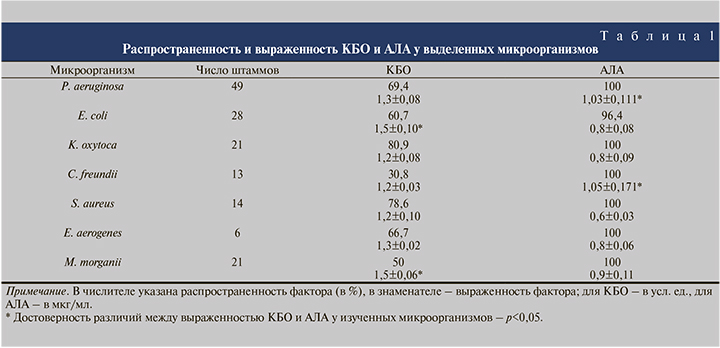
Показано, что выделенные микроорганизмы формировали биопленки в 30,8–80,9% случаев. При этом отмечено, что максимальное количество штаммов, способных образовывать пленки на абиотической поверхности, регистрировалось среди K. oxytoca и S. aureus, минимальное – среди M. morganii. Достоверно более высокими значениями биопленкообразования обладали штаммы E. coli и M. morganii по сравнению с более низким уровнем КБО, характерным для изолятов K. oxytoca, C. freundii и S. aureus (p<0,05).
Что касается антилизоцимной активности, то она была обнаружена у всех изученных микроорганизмов. Показано, что достоверно более высокими значениями признака характеризовались изоляты P. aeruginosa и C. freundii по сравнению с минимальным значением АЛА, которым обладали штаммы S. aureus (p<0,05).
Изучены особенности резистентности доминирующих микроорганизмов к четырем классам антибактериальных препаратов (табл. 2).
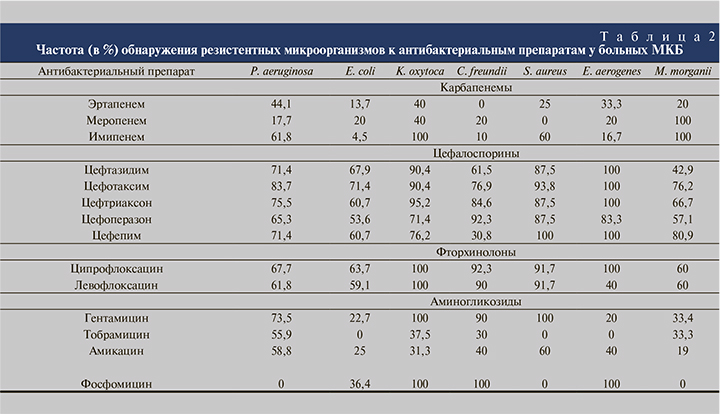
Установлена наименьшая устойчивость выделенных микроорганизмов к карбапенемам.
Самым эффективным препаратом, к которому проявляли высокую чувствительность изученные микроорганизмы, оказался меропенем, подавляющий рост штаммов S. aureus и P. aeruginosa в 100 и 82,3% случаев соответственно. Среди выделенных энтеробактерий устойчивыми к меропенему было 20–40% культур и лишь штаммы M. morganii в 100% случаев были резистентными к данному препарату.
Устойчивость к имипенему большинства изученных штаммов энтеробактерий, относящихся к видам E. coli, C. freundii и E. aerogenes, была невысокой и составила 4,5, 10,0 и 16,7 % соответственно; вместе с тем среди культур K. oxytoca и M. morganii чувствительных штаммов не выявлено. К имипенему также было устойчиво более половины (60%) изученных культур S. aureus и P. aeruginosa.
Эртапенем оказался наиболее эффективным в отношении C. freundii и E. coli, подавляя в первом случае рост всех выделенных штаммов, во втором – 86,3% культур.
Цефалоспорины показали низкую активность по отношению к изученным уропатогенам. Наиболее эффективным среди них в отношении C. freundii был цефепим с показателем резистентности 30,8%.
Выделенные при мочекаменной болезни микроорганизмы демонстрировали также высокую резистентность к фторхинолонам, причем число штаммов P. aeruginosa, E. coli и C. freundii, устойчивых как к ципрофлоксацину, так и к левофлоксацину, различалось незначительно; все культуры K. oxytoca были резистентными к данным антибиотикам, и только 40% штаммов E. aerogenes характеризовались резистентностью к левофлоксацину, 100% – к ципрофлоксацину.
Изучение резистентности микроорганизмов к аминогликозидам показало высокую эффективность тобрамицина в отношении E. coli, S. aureus, E. aerogenes, амикацина – в отношении M. morganii. Отмечена резистентность всех изученных штаммов K. oxytoca и S. aureus, 90% культур C. freundii и 73,5% P. aeruginosa к гентамицину.
К фосфомицину были чувствительными все исследуемые штаммы P. aeruginosa, S. aureus и M. morganii и устойчивыми K. oxytoca, C. freundii, E. aerogenes.
Таким образом, показано, что микроорганизмы, выделенные из мочи при МКБ, обладают вариабельной антибиотикорезистентностью, что необходимо учитывать при эмпирическом выборе препарата(-ов) для проведения антимикробной профилактики инфекционно-воспалительных осложнений после чрескожной нефролитотрипсии.
Проведенными исследованиями установлено, что культуры P. aeruginosa наиболее чувствительны к меропенему и фосфомицину, E. coli – к имипенему, тобрамицину и фосфомицину, K.oxytoca – к тобрамицину и амикацину, C. freundii и E. aerogenes – к карбапенемам; S. aureus – к мерапенему, эртапенему и фосфомицину; M. morganii – к эртапенему, амикацину, фосфомицину.
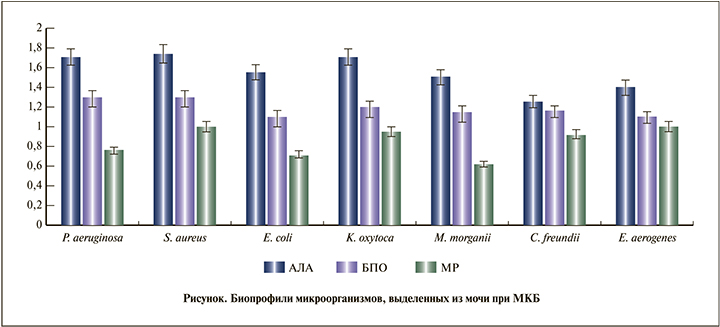
При сравнительном анализе антибиотикорезистентности выделенных штаммов максимальное значение МР было получено от E. aerogenes и S. aureus и снижалось в ряду K. oxytoca, C. freundii, P.aeruginosa, E. coli, M. morganii. Биопрофили (комбинация) изученных биологических свойств микроорганизмов представлены на рисунке.
Заключение. Известно, что спектр биологических свойств микроорганизмов, инициирующих воспалительный процесс, способствует увеличению продолжительности течения гнойно-воспалительных заболеваний и возникновению послеоперационных осложнений [15–17]. Одним из важных персистентных свойств микроорганизмов является способность образовывать биопленки [18, 19]. На обширном фактическом материале показана клиническая значимость антилизоцимной активности микроорганизмов и установлена ее роль в определении хронического и/или затяжного характера гнойно-воспалительного процесса [20, 21].
Данные о факторах персистенции микроорганизмов, выделенных из мочи при МКБ, полученные в настоящем исследовании, показали высокую частоту встречаемости способности к инактивации лизоцима и образованию биопленок, что свидетельствует об их потенциальной патогенности.
Представленные результаты согласуются с другими исследованиями, в частности [22], в которых было показано, что возбудители пиелонефрита, протекающего на фоне МКБ, характеризуются более высокой способностью к формированию микробных биопленок по сравнению с возбудителями инфекций, протекающих без уролитиаза.
Б. А. Рамазановой и соавт. (2006) [23] установлено, что большинство уроштаммов при пиелонефрите обладало антилизоцимной активностью, причем выраженность признака была выше при хронической форме заболевания.
Другим важным моментом является факт обнаружения антибиотикорезистентности выделенных микроорганизмов. Современные условия требуют разработки схем рациональной антибиотикотерапии для данного региона с учетом различия в этиологии и спектре чувствительности к антимикробным препаратам уропатогенов [24].
Полученные нами данные по устойчивости микроорганизмов, выделенных из мочи, к антибиотикам важны в первую очередь для адекватного эмпирического выбора терапии.
Высокий уровень резистентности микроорганизмов, выделенных из мочи при МКБ, к изученным антибиотикам, их способность к инактивации лизоцима и формированию биопленок могут быть причиной возникновения послеоперационных осложнений.
Дальнейшие исследования нацелены на разработку алгоритма прогнозирования риска развития послеоперационных осложнений у больных МКБ с использованием биологических свойств микроорганизмов.



