Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) – одно из самых частых заболеваний у мужчин, и его частота увеличивается по мере общего старения населения [1, 2]. Доброкачественная гиперплазия предстательной железы – связанное с возрастом состояние, обусловленное пролиферацией эпителиальных клеток и гладкомышечных волокон предстательной железы. Симптомы дизурии при ДГПЖ обусловлены преимущественно обструкцией и гипертонусом мышц.
Аутопсийные исследования выявили первые признаки ДГПЖ у 8% мужчин в возрасте от 31 до 40 лет, к 80 годам изменения в железе становятся закономерностью [3]. Истинную частоту бессимптомной ДГПЖ можно определить только по данным аутопсий. Ни у одного из мужчин, умерших в возрасте до 30 лет, не была обнаружена ДГПЖ, тогда на 9-м десятке жизни соответствующие изменения найдены в 90% наблюдений [4]. Сопутствующий ДГПЖ простатит усугубляет симптоматику и ухудшает результаты терапии больных [5–8].
В популяционном исследовании в США [9] показано, что выраженность клинических проявлений зависит от возраста. Так, 13% мужчин в возрасте от 40 до 49 лет имели умеренные или выраженные проявления симптомов нижних мочевыводящих путей (СНМП), в то время как у пациентов старше 70 лет такой уровень симптомов регистрировали уже в 28% наблюдений.
Появилось сообщение о роли андрогенов в ингибировании апоптоза клеток простаты, что индуцирует гиперплазию предстательной железы [10, 11]. Отмечено негативное влияние метаболического синдрома на течение многих заболеваний предстательной железы, в том числе и ДГПЖ [12, 13]. У пациентов с ДГПЖ и ожирением, инсулинорезистентностью и андрогенным дефицитом обнаружены большие, чем у больных ДГПЖ без метаболического синдрома, размеры предстательной железы и объем остаточной мочи [12]. Более того, у пациентов с метаболическим синдромом достоверно чаще развивается ДГПЖ. У них также наблюдается и более быстрое прогрессирование заболевания [14].
Ведущим симптомом, побуждающим мужчин с ДГПЖ обратиться к врачу, служит нарушение мочеиспускания. Многие исследователи высказывают сомнение, будто именно ДГПЖ как увеличение стромально-эпителиальных компонентов предстательной железы служит причиной дизурии у мужчин [15], тем более что с возрастом увеличивается частота заболеваний, которые могут сопровождаться аналогичными симптомами [16, 17]. Детальное обследование пациентов, наблюдавшихся по поводу ДГПЖ, установило, что основной причиной дизурии у 22,3% пациентов была дисфункция шейки мочевого пузыря, у 40,1% – обструкция, у 31,4% – гиперактивность, у 6,2% – гипоактивность детрузора. Не удивительно, что проводимое им стандартное лечение α-адреноблокаторами показало недостаточную эффективность [7, 18].
Проблема ДГПЖ окончательно не решена, остается много вопросов и противоречий в отношении как патофизиологии, так и эпидемиологии этого заболевания [4]. Традиционно нарушения мочеиспускания у пожилого мужчины списывают на ДГПЖ, хотя может быть множество других причин, требующих, соответственно, иного его лечения. Нельзя основываться только на шкале симптомов, непременно следует учитывать данные урофлоуметрии, объем остаточной мочи [4]. В то же время факт наличия ДГПЖ как таковой не обязательно означает появление клинических проявлений, в ряде случаев заболевание протекает бессимптомно [19]. Иногда относительно небольшое увеличение железы обусловливает более выраженное нарушение мочеиспускания, чем простата значительно более крупных размеров. В первую очередь это связано с анатомической локализацией аденомы.
Тем не менее ДГПЖ – распространенное заболевание, зачастую диагностируемое на поздних стадиях по развившимся осложнениям (острая задержка мочеиспускания, камни мочевого пузыря, гидронефроз и т.д.). До настоящего времени не изучены корреляции между возрастом и длительностью заболевания, выраженностью симптомов по шкале IPSS, объемом предстательной железы и мочевого пузыря и количеством остаточной мочи после самопроизвольного мочеиспускания, а также качеством жизни больных ДГПЖ. До сих пор не ясны причины, ведущие к позднему выявлению больных ДГПЖ.
Цель исследования: охарактеризовать пациентов с впервые установленным диагнозом «доброкачественная гиперплазия предстательной железы»; выявить закономерности, ведущие к поздней диагностике заболевания.
Дизайн исследования: простое открытое ретроспективное несравнительное.
Материалы и методы. С целью определить частоту обращений за медицинской помощью по поводу ДГПЖ были проанализированы 3544 амбулаторные карты всех пациентов, обратившихся к урологу муниципальной городской поликлиники № 26 г. Новосибирска в 2013 г. Дополнительно проанализированы амбулаторные карты 165 пациентов поликлиники, которым впервые был поставлен диагноз ДГПЖ; данные из карт внесены в специальные таблицы. Критерии включения: возраст старше 30 лет; впервые установленный диагноз ДГПЖ по следующим критериям: выраженность симптомов по шкале IPSS – 7 и более баллов, объем предстательной железы – 30 см3 и более, максимальная скорость потока мочи – 14 мл/с и менее. Критерии исключения: любые заболевания, которые могут сопровождаться нарушением мочеиспускания (опухоли мочевого пузыря и простаты); состояние после операций и травм мочевого пузыря и простаты; острые инфекции урогенитального тракта; наличие цистостомы, постоянного катетера.
Длительность заболевания и выраженность симптомов по шкале IPSS, объем предстательной железы, объем мочевого пузыря и количество остаточной мочи после самопроизвольного мочеиспускания, уровень простатспецифического антигена (ПСА) в крови, качество жизни и напрямую сопряженную с ним частоту ночных мочеиспусканий определяли в 4 возрастных группах: 1-я – моложе 50 лет, 2-я – 51–60, 3-я – 61–70 и 4-я – старше 70 лет. Также определяли влияние на перечисленные факторы размеров предстательной железы, распределив пациентов по группам: 1А – объем простаты до 40 мл, 2А – 41–50, 3А – 51–60, 4А – 61–70 и 5А – более 70 мл. Дополнительно оценивали степень запущенности заболевания в момент выявления в зависимости от семейного статуса пациента.
Выборки сравнивали с использованием критерия Краскелла–Уоллиса (если сравнивали больше двух групп) либо критерия χ2 или теста Манна–Уитни (если сравнивали две группы). Полученные p-величины корректировали по методу Бенджамини–Хохберга. Post-hoc-тестирование после использования критерия Краскелла–Уоллиса осуществляли с помощью теста Данна, корректировку p-величин при множественном тестировании выполняли по методу Бенджамини–Хохберга [20, 21].
Результаты. Из 3544 пациентов уролога поликлиники 960 (27,1%) была диагностирована ДГПЖ. Таким образом, каждый четвертый пациент муниципального лечебного амбулаторного учреждения, обратившийся за урологической помощью, имел ДГПЖ, что подтверждает значительную частоту этой нозологии в популяции.
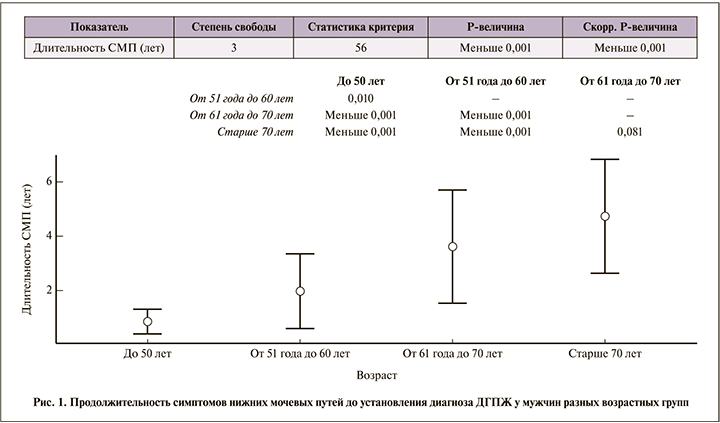
Анализ историй болезни 165 мужчин, которым диагноз был поставлен впервые, показал, что это заболевание ассоциировано с возрастом. Относительно молодых (до 50 лет) пациентов было всего 14 (8,5%), самую многочисленную группу составили мужчины в возрасте 51–60 лет – 75 (45,5%) человек и 61–70 лет – 57 (34,5%). Старше 70 лет было 19 (11,5%) мужчин. Самому молодому пациенту было 45 лет, самому старому – 81 год. Ни один пациент не обратился к врачу немедленно после возникновения симптомов нарушения мочеиспускания, что объясняется постепенностью их развития. Наименьшая длительность заболевания (0,8±0,5 года) отмечена у молодых пациентов, наибольшая – в старшей возрастной группе (4,7±2,1 года; рис. 1).
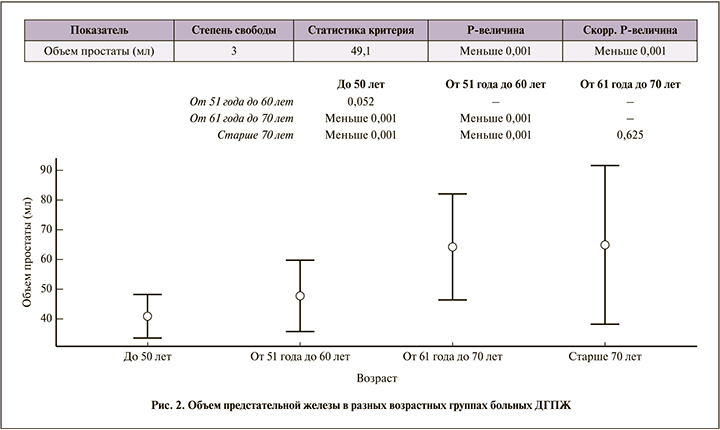
Наименьший объем предстательной железы составил 32, наибольший – 150 мл. Средний размер железы закономерно увеличивался с возрастом: в 1-й и 2-й группах он составил 41,1±7,3 и 47,9±11,8 мл соответственно, в 3-й и 4-й – 64,2±17,8 и 64,9±26,6 мл соответственно (рис. 2).
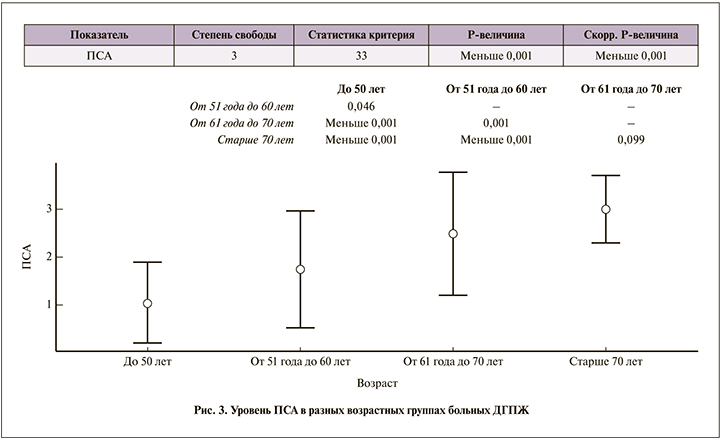
Ни у одного пациента 1-й возрастной группы не было остаточной мочи, в трех остальных ее количество колебалось от 37,4±23,6 мл во 2-й группе до 54,7±34,2 и 54,0±26,3 в 3-й и 4-й соответственно. Объем мочевого пузыря в среднем был наибольший (332,2±196,5 мл) во 2-й группе, наименьший (205,5±72,5 мл) – в 4-й. Увеличение среднего уровня ПСА также закономерно коррелировало с возрастом: от 1,1±0,8 нг/мл в 1-й группе до 3,0±0,7 нг/мл в 4-й группе (рис. 3).
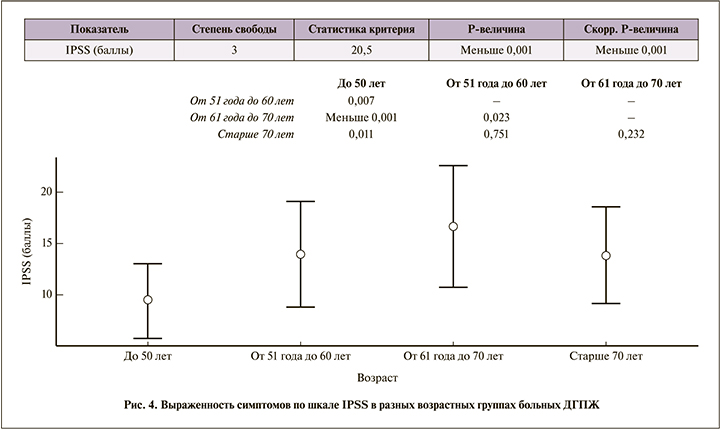
Выраженность симптомов по шкале IPSS была наибольшей в 3-й возрастной группе 61–70 лет (16,7±5,9 балла), наименьшей – в 1-й (9,5±3,6 балла; рис. 4).
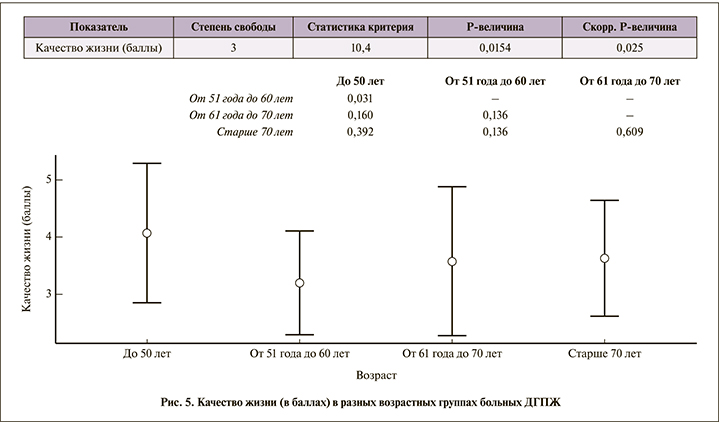
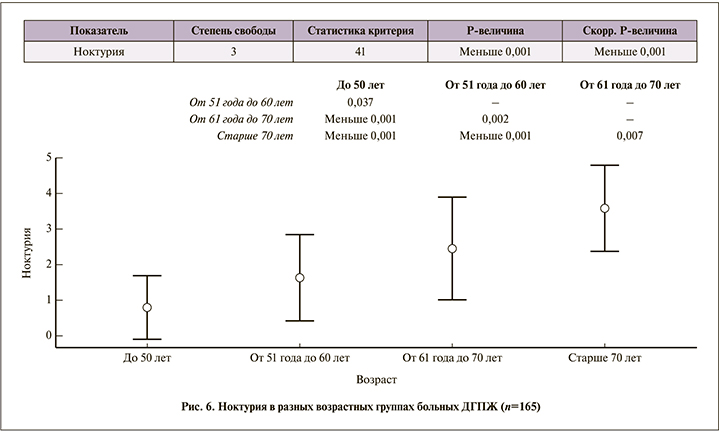
Мужчины более молодого трудоспособного возраста раньше обращаются к врачу, в то время как пожилые пациенты мирятся с симптомами. Молодые мужчины считают, что проявления ДГПЖ существенно снижают качество их жизни (средний балл – 4,1±1,2), в то время как в более старшем возрасте даже более тяжелая симптоматика не оказывает такого влияния на качество жизни, даже несмотря на то что ноктурия в 4-й группе составила в среднем 3,6±1,2, в 1-й – 0,8±0,9 (рис. 5, 6).
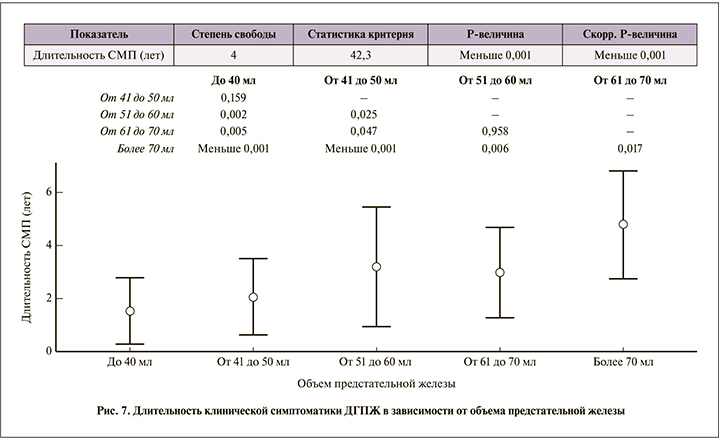
Длительность симптоматики напрямую коррелировала с объемом предстательной железы. Если в группе 1А (объем простаты до 40 мл) первые признаки заболевания появились в среднем за 1,5 года до обращения, то в группе 5А (объем простаты более 70 мл) клинические проявления присутствовали в среднем в течение 4,8±2,1 года (рис. 7).
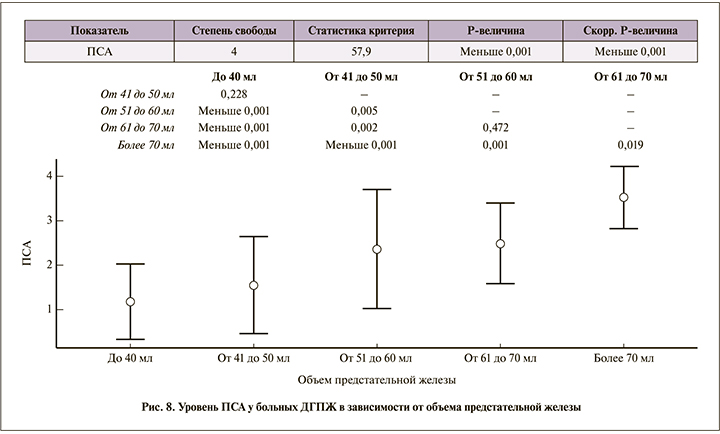
Уровень ПСА также имел положительную корреляцию с объемом предстательной железы (рис. 8).
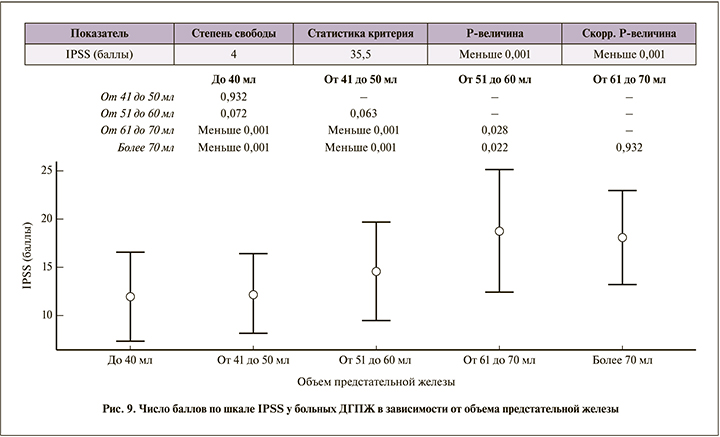
Количество баллов по шкале IPSS существенно не различалось в группах 1А, 2А и 3А, однако при увеличении объема предстательной железы до 60 мл и выше степень проявления симптомов увеличилась в 1,5 раза (рис. 9).
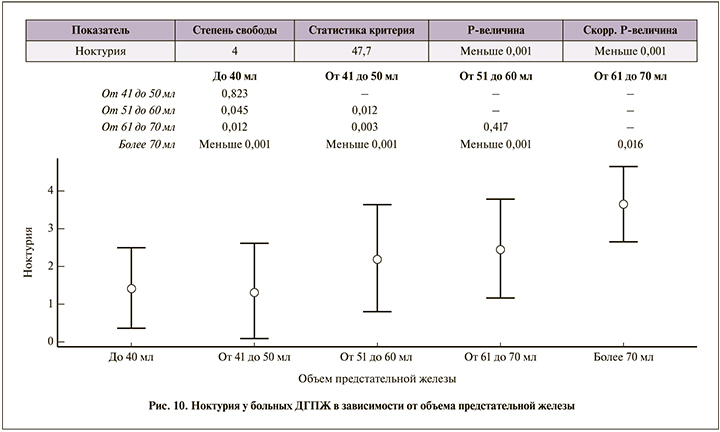
Для ночного мочеиспускания пациенты с объемом предстательной железы до 50 мл вставали не более 2 раз; при объеме железы свыше 70 мл частота ноктурии в среднем приблизилась к 4 (рис. 10).
Качество жизни у мужчин в группе 1А в среднем соответствовало 2,5±1,0 балл, при увеличении объема железы средний балл увеличился до 3,5–3,6–3,8–4,0. Таким образом, самым низким было качество жизни самых молодых мужчин с самым большим объемом простаты.
Как и ожидалось, семейный статус пациента оказал существенное влияние на выраженность симптомов при первичном обращении к врачу: у женатых средний балл по шкале IPSS составил 13,8±5,4, у одиноких – 16,3±5,5 (р=0,008). Данный факт подтверждает постулат: ДГПЖ остается социально значимым заболеванием, причиняющим изрядные страдания не только самому пациенту, но и его семье, побуждающей больного как можно раньше обратиться к врачу.
Обсуждение. Выраженное нарушение мочеиспускания, особенно обусловленное обструкцией, требует хирургического вмешательства, что несет дополнительные риски. Есть работы, подвергающие сомнению преимущество лазерной вапоризации по сравнению с биполярной трансуретральной резекцией [22]. Наличие биполярного резектоскопа позволяет выполнять не только резекцию, но и энуклеацию предстательной железы, что в некоторых случаях может оказаться более предпочтительным [23]. В последние годы набирают популярность технологии минимально инвазивных вмешательств при ДГПЖ [24].
Проведена масса международных многоцентровых плацебо-контролируемых рандомизированных исследований, подтверждающих высокую эффективность монотерапии α-адреноблокаторами, в частности 0,4 мг тамсулозина [25]. У ряда больных хорошую эффективность показал солифенацин – в немалой степени за счет противовоспалительного эффекта [1]. Одним из наиболее угнетающих симптомов ДГПЖ является ноктурия; показаны обещающие результаты от применения десмопрессина [26]. С 2003 г. появились сообщения о применении инъекций препаратов ботулотоксина для купирования СНМП, обусловленных гиперплазией простаты [27]. Целый ряд исследований подтверждает эффективность ингибиторов 5α-редуктазы, особенно для пациентов с большой предстательной железой [28]. Однако бессмысленно иметь в своем арсенале эффективные методики, если больной не обращается за помощью своевременно.
Сегодня нет четких критериев, которые позволили бы диагностировать ДГПЖ по размеру простаты. Клинические проявления ДГПЖ включают СНМП, обструкцию мочевого пузыря, неполное опорожнение мочевого пузыря, острую и хроническую ретенцию, мочевую инфекцию, уросепсис, камни мочевого пузыря и гематурию. Аналогичные проявления могут быть при раке простаты, простатите, раке мочевого пузыря, камнях мочевого пузыря, гиперактивном мочевом пузыре, интерстициальном или пострадиационном цистите, уретрите, диабете, болезни Паркинсона и т.д. Порой диагноз ДГПЖ является диагнозом исключения.
Эпидемиология ДГПЖ не известна. Мужчины с объемом простаты более 50 см3 имеют 5-кратный риск развития средних и тяжелых симптомов и 3-кратный риск развития обструкции (максимальная скорость потока мочи <10 мл/с) [4].
В настоящее время нет убедительных данных, подтверждающих, что больного ДГПЖ можно оставить без лечения, под так называемым выжидательным наблюдением. Напротив, отмечали прогрессирование заболевания и утяжеление симтоматики ДГПЖ в течение 42 мес. [29]. Результаты исследования MTOPS также подтверждают это положение [30].
В настоящее время не достигнут консенсус по ряду вопросов: следует ли опираться при выборе лечения на размер предстательной железы, насколько специфичны симптомы ДГПЖ, каковы диагностические критерии и каков необходимый и достаточный минимум обследования пациента?
Полагаем, что наше исследование дало дополнительные данные о характеристике пациента с ДГПЖ, что позволит скоординировать усилия терапевта и уролога, санитарно-просветительной службы и будет способствовать своевременному выявлению этих больных.
Заключение. Больные ДГПЖ составляют 27,1% от всех обращений к урологу поликлиники. Проведенное исследование позволило установить ряд закономерностей, присущих этому заболеванию. У молодых мужчин степень проявления симптомов ниже, чем у пожилых, однако они сильнее ими обеспокоены, у них более выражено нарушение качества жизни, поэтому они раньше обращаются за медицинской помощью. Женатые мужчины обращаются к врачу с достоверно менее выраженными симптомами, чем одинокие, что также объяснимо, поскольку один из наиболее изнуряющих симптомов ДГПЖ, ноктурия, негативно влияет на качество жизни не только самого пациента, но и проживающей с ним семьи. Обеспокоенные родственники настаивают на проведении обследования и назначении лечения таким пациентам.



